Алейрон қабатындағы программаланған клеткалық өлімнің молекулалық-генетикалық механизмі: гиббереллин, абсциз қышқылы және ОБТ (альдегид оксидаза, ксантиндегидрогеназа) рөлдері


КІРІСПЕ
Өсімдік клеткалардың программаланған өлімінің немесе апоптоздың генетикалық механизмін зерттеу қазіргі заманғы молекулалық биология және генетиканың өзекті проблемаларының бірі болып табылады. Клетканың дифференцияциясың фундаментальді механизмін ашуға, өсімдіктің дамуы мен өсуін сонымен қатар өсімдіктің өнімділігін жоғарылату әр түрлі ортаның биотикалық және абиотикалық факторларына төзімді және өнімділігі жоғары ауылшаруашылық өнімдерін алу жолында Өсімдік клеткалардың программаланған өлімінің молекулалық және генетикалық негіздерін зерттеу өте маңызды. Жоғарыдағы мәселені зерттеу соңғы жылдарда интенсивті түрде дамып келе жатқан және биологиялық өнімнің қалыптасуын шешуші факторлардың бірі.
Алейрон қабатының онтогенетикалық программаланған клеткалар өлімі (ПКӨ) апоптотикалық сипатта жүзеге асатыны анықталған. Бұл процестің белсенділігінің артуымен, геномдық ДНҚ молекуласының фрагментациялануымен үйлесіп, фитогормондар - гиббереллин (ГҚ) және абсциз қышқылдарымен (АБҚ) бақыланылатыны көрсетілген.
Алейрон клеткалары - жоғары деңгейде дифференциацияланған ұлпа. Бұл ұлпаның негізгі қызметі - гидролитикалық ферменттерді (альфа-амилазаны қоса) синтездеп, крахмалды эндоспермге секрециялау. ГҚ және АБҚ гормондарының Клетканың программаланған өліміндегі рөлі анықталған. ГҚ клеткалардың өлімін жеделдетеді, ал АБҚ бұл әсерді тежейді.
Өсімдіктер жүйесінде, оттегінің белсенді түрлерінің (ОБТ) көзі ретінде липидтердің асқын тотығуымен қатар, фотосинтез үрдістерін де атап өтуге болады. Сондықтан да пластидтерде ОБТ -нің зиянды әсеріне қарсы әртүрлі қорғаныс клетканың механизмдері жақсы дамыған.
Шынымен де, Өсімдік жүйесінде фотосинтез барысында пайда болған оттегінің белсенді түрлері программаланған өлімі кезінде генрацияланған ОБТ синтезін немесе сигналының көрінуін тежейді.
Организмдерде өзінің арнайы субстраттарымен және O 2 арасындағы тура реакцияларды катализдейтін өзіне тән ферменттер болады. Жоғарыда айтылған реакциялар биосинтез үрдісінің әр түрлі сатыларына, ароматтық қосылыстар метаболизміне, стероидтар синтезіне, ыдырау ракцияларына қатысады. Ондай ферменттер қатарына альдегидоксидаза (ФК 1. 2. 3. 1; AO) және ксантиндегидрогеназа (ФК 1. 2. 3. 2. ; КДГ) ферменттері жатады.
Альдегид оксидаза (альдегид оксидоредуктаза; ФК 1. 2. 3. 1; AO) электрон акцепторы ретінде оттегін пайдалана отырып, әр түрлі альдегидтердің және N - гетероциклді компоненттердің тотыға гидроксилденуін катализдейді. Альдегидоксидаза ферменттер оттегі радикалдарының негізгі көздері болып табылады . АО ферменттерінің кең субстраттық спецификасын ескере отырып, бұл ферменттер фитогормондардың синтезімен қатар, басқада заталмасу үрдістеріне қатысуы мүмкін. Мысалы, сүтқоректілер организміндегі АО-лар Н 2 О 2 және О 2 -ның маңызды көзі екендігі белгілі. .
Оттегінің жетіспеуі кезінде ксантиноксидаза НАД + - тәуелді ксантиндегидрогеназа (ФК 1. 2. 1. 37; КДГ), ретінде функциялық қызмет атқарады. Ксантингегидрогеназа тірі ағзадағы оттегінің белсенді формасын генерациялайтын басты жүйе болып табылады. негізгі қызметі аденин және гуаниннің бірінші реттік өнімінің тотығуы нәтижесінде зәр қышқылына айналдыру. Ксантиндегидрогеназа пуриндердің ыдырауын жүзеге асырушы орталық орынға ие орынға ие болған . Ксантиноксидаза (ФК 1. 2. 3. 2; XO) гипоксантиннің ксантинге айналуын катализдейді, одан ары қарай зәр қышқылына дейін ыдырайды, сонымен қатар, птериндер, альдегидтер, имидазолдардың тотығуын катализдейді [1] .
Гипоксантин және ксантин бар ортада адамның ксантин оксидоредуктазысының О 2 және Н 2 О 2 түзу қабілеттінің бар екендігі анық. Адамда бұл фермент, патологиялар мен физиологиялық күйлер кезінде ОБТ көзі болып табылады деген болжам бар.
Соңғы кездерде АО и МоСо - сульфуразасы бойынша жабайы және мутантты томат және арабидопсис өсімдіктерін пайдалана отырып, жануарлар гомологтарының жағдайындағыдай, өсідіктер АО-сы және КДГ ОБТ-ның көзі ретінде қызмет атқарады. Жоғарыдағы мәліметтерге сүйенетін болсақ, оттегінің белсенді түрлері митохондриальді тізбектегі электрондардың тасымалдануы нәтижесінде және ксантиндегидрогеназа және альдегид оксидазалардың көмегімен жүреді
1 ӘДЕБИЕТКЕ ШОЛУ
1. 1 Астық тұқымдастарының алейрон қабаттары
Астық тұқымдастарының алейронын зерттеу кем дегенде 2 ғасырға созылып келеді. Астық алейроны өсімдіктердің ең қарқынды түрде зерттеліп келе жатқан ұлпаларының бірі болып табылады. Сыра қайнатуда және ашытқы дайындауда астық алейроны маңызды орын алатындықтан химия және биология мамандары шамамен 200 жыл бұрын арпаның қызметтерін егжей-тегжейлі зерттей бастады [1] .
Бидай дәнінің эндоспермасы тозаң қапшығында, орталық клетканың аталық жыныс клеткасымен ұрықтану нәтижесінде пайда болатын, триплоидты ұлпа. Тозаңдану процесінен кейін шамамен 8-10 тәуліктен соң, дән эндоспермасы крахмалды эндоспермаға және алейрон қабатына дифференциацияланады [2] . Алайда, ұрықтанған бір клеткадан пайда болатынына қарамастан, алейрон ұлпасы мен крахмалды эндосперм клеткаларының өлуі әртүрлі уақытта жүзеге асады. Крахмалды эндосперм клеткалары бидай дәнінің пісіп-жетілу барысында өліп, дән қуысын белокты және крахмалды гранулалар түрінде толтырып тұрады деген болжам бар. Ал алейрон клеткалары, дәннің пісіп- жетілу сатысында еш-өзгеріссіз сақталып, тек қана оның өсіп-өну сатысын, гидролитикалық ферменттерді синтездеп, секрециялау арқылы индукциялағаннан кейін ғана элеминацияланады [3] .
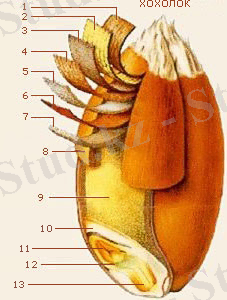
1сурет. Бидай дәнінің құрылысы
ЕСКЕРТУ: 1, 2, 3 - өнім қабығы, 4, 5, 6 - дән қабығы, 7 - алейрон қабаты,
8 - беткі өнім қабығының клетка қабаттары, 9 - эндосперм, 10 - қалқан (щиток), 11 - бүршік (почечка), 12 - ұрық, 13 - түп (корешок) .
Алейрон қабатының онтогенетикалық программаланған клеткалар өлімі(КПӨ) апоптотикалық сипатта жүзеге асатыны анықталған [4] . Бұл процестің белсенділігінің артуымен, геномдық ДНҚ молекуласының фрагментациялануымен үйлесіп, фитогормон-гиббереллин және абсциз қышқылдарымен бақыланылатыны көрсетілген.
Жоғарыда айтылғандай, алейрон клеткаларының негізгі қызметі гидролитикалық ферменттерді (альфа-амилазаны қоса) синтездеп, крахмальды эндоспермге секрециялау[5] .
Алейрон клеткаларының ультра құрлымы олардың қызметін көрсетеді. Дәндегі алейронның көптеген көрсеткіштері оның ерекше және жан-жақты тәжірибиелік жүйе болуын қамтамассыз етеді. Астық тұқымдастарының алейрон қабаты біртекті, жоғары дифференциалданған клеткалардың бір қабатынан (сұлы, жүгері, қара бидай, бидай) немесе бірнеше қабатынан (күріш, арпа) тұрады Пісіп жетілген, құрғақ алейрон клеткалары қалың, геммицелюлозалық қабырғамен қоршалған және олар ешқандай да клеткалық бөлінуге ұшырамайды [6] .
Алейрон клеткаларының цитоплазмасына белоктар қорынан тұратын көптеген вакуольдер тән, оларды көбінесе алейрондық түйіршіктер деп те атайды, олар бүкіл клеткаларды алып жатады. Бұл органелла алейронның гормондар әсеріне қайтаратын реакциясында негізгі қызмет атқарады. Протеиндердің қоры бар вакуольдер-гиббереллинмен өңделгеннен кейін гидролизге ұшыраған протеиндерді, секреторлық белоктардың түзілуіне қажетті аминқышқылдармен қамтамассыз ету үшін қор ретінде сақтай бастайды. Протеиндердің қоры бар вакуольдер - сондай-ақ, астық тұқымдастардың дәндеріндегі минералдардың негізгі қоймасы болып табылады. Олардың құрамынан минералдар фитин түрінде бөлініп алынған. Фитин-бұл К, Mg, және Ca иондары мен фитинді қышқылынан (гексофосфат) түзілген кристалды ерімейтін комплекс болып табылады. Бұл кристалды қосынды глобоид деп те аталады. Рентгендік микроанализ нәтижелері бойынша дән құрамындағы Р, К, Mg+2 және Ca+2 иондарының шамамен 75% алейрон қабаттарында сақталады [6] . Алейрон немесе протопластардың инкубациялық кезеңінде вакуольдер көлемдері ұлғайып, бір-бірімен орталық үлкен бір вакуоль түзілгенше қосыла бастайды. Инкубациялық ортада гиббереллин болған жағдайда клеткалармен протопластардағы алейрон қабаттарының вакуольдену процесі жылдамдай түседі. Бейтарап майларды сақтайтын липидтік қосындылар немесе олеосомдар да алейрон клеткаларының маңызды органеллалары болып табылады, олар клетканың бүкіл кеңістігінің 30% алып жатқан үшглицеридтік негізден тұрады. Алейрон клеткалардағы олеосомдар эндоплазмалық торда пайда болып, кейіннен эндоплазмалық торға және протеиндердің қоры бар вакуольдер бетіне бекінген күйде болады. Олеосомдардың вакуольдер бетіне бекініп жатуы вакуолдердің кейбір түрлері тікелей эндоплазмалық тордан пайда болады деген болжамды растайды. Қор ретінде сақталған бейтарап майлар алейрон клеткаларын көміртегі көзімен де қамтамассыз етеді, эндоспермді мобилизациялау басталғанға дейін клетка көміртегіні осы жерден жұмсай алады, сонымен бірге мұндағы май қышқылдары мембрананы түзуге пайдаланылады. Бұл май қышқылдарының алейрон клеткалары арқылы метоболизденетініне бірнеше дәлелдер бар. Алейрон клеткаларында малатсинтетазадан және изоцитрат лиазадан тұратын көптеген глиоксисомалар да болады [7] және оқшауланып алынған алейрон қабаттары сахарозаны синтездей алады.
ЕСКЕРТУ: 1 - өнім жаны, 2 - дән қабығы, 3 - алейрон қабаты, 4 - ядро, 5 - эндосперм клеткалары және крахмал түйіршіктері, 6 - крахмал түйіршіктері.
2 сурет. Бидайдың көлденең кесіндісіндегі ( Triticum aestivum ) қор заттар
Жоғарыда айтылғандай, алейрон клеткалары жоғары деңгейде дифференциацияланған ұлпа. Бұл ұлпаның негізгі қызметі гидролитикалық ферменттерді (альфа-амилазаны қоса) синтездеп, крахмалды эндоспермге секрециялау. Олай болса, алейрон ұлпаларында, оның секреторлық қызметіне байланысты эндоплазматикалық тор, Гольджи аппараты, митохондриялар өте жақсы дамыған Аталған гидролитикалық ферменттердің ішінде α-амилаза, дәннің өніп-өсуіне қатысты маңызды болып табылады. Крахмалды эндоспермге секрецияланған α-амилаза крахмалды қанттарға дейін ыдыратып, өсімдіктің өніп-өсуіне қажет энергиямен қамтамасыз етеді [8] .
α-амилаза ферментінің практикалық маңыздылығына байланысты (ауыл-шаруашылығы, сыра дайындау, нан өндіру, фармокология және т. б. ) оларды зерттеу жұмыстарына ғалымдар ертеден көңіл аударуда. Осыған орай альфа-амилаза ферментінің құрылысы мен қызметі келесі бөлімде терең қарастырылады [9] .
1. 2 Гиббереллин және абсциз қышқылдарының метаболизмдері
Гиббереллиндер - химиялық тұрғыдан табиғаты дитерпеноидты биологиялық активті қосылыстарға жатады. Олар барлық зерттелген жоғарғы сатыдағы өсімдіктердің ұлпаларында табылған. Қазіргі кезде гиббереллиндер қарқынды зерттелуде, себебі олар өсімдік организмдеріндегі алуан түрлі физиологиялық процестерді реттеуге қатысады.
Ең алғаш рет 1926 жылы Кусова деген жапон ғалымы, күріш тұқымының қалыпты өсуіне кедергі болатын паразиттік саңырауқұлақтарында ( Gibberella fujikuroi ) бірінші рет, гиббереллин фитогормонын тапты. Гибберелин қышқылына (ГҚ) 1930 жылы жапон биохимиктері химиялық сипаттама беріп, таза күйде бөліп алды. Осы кезге дейін гиббереллиндердің 65-тен аса түрлері бөлініп, химиялық статусы анықталды. Оның ішінде ең жақсы зерттелгені - Гиббереллин қышқылы 3 (ГҚ 3 ), ол Gibberella fujikuroi саңырауқұлағында түзіледі [10; 11] .
Гиббереллин қышқылы 4-А, В, С, және D сақиналарынан түзілген, 4 изопрендік сақинадан құралған тетрациклді дитерпеноид болып табылады. Гиббереллиндердің химиялық құрлымының негізінде гиббереллан қаңқасы жатыр. Гиббереллиндер өзара А сақинасында қаныққан байланыстар, гидрок-сильді және карбоксильді топтардың, сонымен қатар, осы топтардың орнала-суымен ажыратылады. Гиббереллин молекулаларының тетрациклді ядросында бірнеше тұрақты орынбасарлары болады: С-7-де карбоксильді топ; С-17-де экзометиленді қос байланыс; С-18-де СН 3 топ; С-19-де лактон немесе карбоксильді топ орналасқан. Басқа орынбасарлардың айырмашылығы немесе олардың ұқсастығы барлық гиббериллиндердің алуан түрлілігін анықтайды. Көміртегі атомының санына сәйкес, гиббереллиндер екі топқа бөлінеді: 20 көміртекті және редукцияланған 19 көміртекті. Энт-гибберелан С 20 гиббереллиндерінің молекулалық бастамасы болып табылады. 10-шы жағдайда 20 көміртекті гиббереллин қышқылдарының қосымша метильді, гидроксиметильді, карбоксильді топтары болады [12] . С 19 гиббереллині келесі негізгі көміртекті қаңқасының модификациялануы және С 20 атомының аластатылуы нәтижесінде түзіледі. С 20 гиббереллиндер физиологиялық белсенді емес және де олар С 19 гиббереллиндердің биогенетикалық бастаушысы болып табылады. Жоғарыда айтылғандай, ГҚ тетрациклді дитерпеноидтар класына жатқызылады, сондықтан да олардың биосинтезінің алғашқы сатысы ацетил СоА-дан (ГГПФ) дейін полиизопренойдтар үшін ортақ болады [13-15] . Гиббереллиндердің синтезінің бірінші фазасы (ГГПФ-ГА 12 -альдегид) жоғарғы сатыдағы өсімдіктерде қандай болса, саңырауқұлақтар үшін де тура сондай ( Gibberella fujikuroi ) . Бірінші этапта, ГГПФ копалилпирофосфат және кейіннен энт-кауренге айналады. Бұл айналу тізбегі екі типті активтілік көрсететін энт-кауреназа арқылы катализденеді. Гибберелин 12 альдегидтен бастап гиббереллиндерге дейінгі сатысы Gibberella fujikuroi саңырауқұлағында толығымен анықталған. Кейбір жағдайларда аталмыш саты жоғарғы сатыдағы өсімдіктердің клеткадан тыс жүйелерінде зерттелген [16-18] . Gibberella fujikuroi саңырауқұлағының культурасы жоғарғы сатыдағы өсімдіктерге қарағанда, өсу ортасына көп мөлшерде гиббереллин қышқылын бөледі. Бұл олардың (ГҚ-ның) алынуы мен таза күйде бөлініп алуын оңайлатады. Сонымен қатар, in vitro жағдайда саңырауқұлақ клеткалары жақсы өседі және ортадағы экзогенді гиббереллиндер түзуге қажет бастаушы заттарды тез сіңіре алады. Атап айту керек, Gibberella fujikuroi В1-41а мутантарымен жүргізілген жұмыс ең нәтижелі болып шықты. Бұл мутанттар энт-кауреннің тотығуын қамтамасыз ете алмайды. Алайда, мутанттағы гиббереллиндердің биосинтездің келесі сатыларын жүзеге асыратын ферменттердің сақталатыны анықталды. Сондықтан да тек экзогенді бастамаларды қосып, оның қандай соңғы өнімге айналатынын бақылауға болады. Gibberella fujikuroi В1-41а мутанттарына жүргізілген эксперименттің негізінде, ГҚ-ның биосинтез жолы гиббереллиннің 12- альдегиді сатысында екі тармаққа бөлінетіні анықталды: 1) 3-бета гидроксильденудің ерте жолы және 2) 3-бета гидроксильденуді айналып өту жолы. Бірінші жолдың ГҚ 3 -ның және басқа жақсы зерттелген 3-бета оксигиббереллиндердің түзілуіне әкелетіні көрсетілді. Екінші жол 12 және 19 гиббереллин қышқылдарының түзілуіне әкеледі. Соңғы жылдары гиббереллиндердің синтезін зерттеу, жоғарғы сатыдағы өсімдіктердің, жоғарыда айтылып өткен екі жолдан бөлек, тағы бір типті С-13-гидроксильденудің ерте жолы бар деуге мүмкіндік берді. Ең соңында осы барлық альдегид жолдарының алмасу мүмкіндіктері С 19 және С 10 атомдарының арасындағы лактонды сақинаның ажырауына әкеледі. Гиббереллин-А 12 -альдегидінің энт-кауреннен түзілуін зерттеудегі тәжірибелерде аралық буындардың созылғыш қабықтарына және қараңғыда өсірілген жүгері өсінділерінің гомогенатына енгізілген 17-13С, 3 Н-кауреноидтар қолданылды. Тәуелсіз биохимиялық және физика-химиялық әдістер, капилярлы газды хромотографияны қолдана отырып, алғаш рет өсімдіктердің вегетативтік ұлпаларындағы энт-кауреннің гиббереллиндерінің түзілуінің 5 метаболиттік сатысы ашылды. Олар: энткауренол, энткаурен қышқылы, энт-альфа гидроксикаурен қышқылы, гиббереллин А 12 -альдегид [19] .
1) Сонымен көптеген көрсеткіштердің бірлестігі С-19 гиббереллиннің ГҚ 3 мысалында биосинтездің негізгі этаптарын айқындап түсіндіреді, гиббереллиндердің тегі жалпы тетроциклиндер болып табылады.
2) Энт-кауреннің бірнеше тізбектелген тотығу реакцияларының айналуы: кауренол-кауренал-каурен қышқылы - 20 көміртекті А 12 -альдегид;
3) А 12 -альдегидінің әртүрлі гиббереллиндерге дейін тотығуы.
Ең басты мәселе, ГҚ биосинтезіне жауапты ферменттерді анықтау. Әзірге олардың табылғандары аз. Біртіндеп терпен тізбегінің С 5 -С 10 -С 15 -С 20 ұзаруын катализдейтін геранил-геранилпирофосфат синтетаза ферменті бөлініп алынған. Кауренсинтетаза 2 белсенді орталықтардан тұрады, оның біріншісі копалилпирофосфаттың түзілуін катализдейді, екіншісі кауренге циклдейді. Сонымен қатар, монооксигеназаларда микросомалық ферменттер табылған, олар ГҚ 12 -альдегидті С 20 және С 19 -гиббереллиндерге айналдырады [20] .
Хлорхолинхлорид және АМО-1618 геранил-геранилпирофосфаттан копалилпирофосфаттың түзілуін, оның кауринге циклденуінің Фосфон Д стадиясын тежейді, анцилиндал кауренінің тотығуын ингибирлейді .
ГҚ-ның өсімдіктердің бойымен қозғалуы базипетальды бағытта жүреді: көбіне флоэмада және аз мөлшерде сұйық заттармен ксилеманың бойында. Табиғи гиббереллиндер өсімдіктердің бойында көбіне бос қышқыл түрінде кездеседі. Соңғылары комплексті түрде болады, мұнда гиббереллиндер төменгі молекулалы заттармен коваленттік байланыс арқылы байланысады. Жиі сипатталғандары ацетаттар, β-глюкопироноидтер, β-глюказилды эфирлер, Н-пропилді эфирлер. Коньюгацияланған ГҚ-ның негізгі ерекшелігі олардың биологиялық белсенділігінің төмендеуі. Өсімдік онтогенезіндегі гиббереллиндердің құрамының өзгеруі көп қызығушылық тудырады. ГҚ деңгейі, арпаның 2-3 жапырақты және түктелу фазаларында жоғарлайды, яғни сабақтың ұзына бойы өсу барысында белсенді болады, ал сабақтың өсуі әлсіреген кезде белсенділігі төмендейді [21] . Осыған ұқсас көрсеткіштер қосжарнақты өсімдіктерде байқалған. Сонымен қатар жапырақтың құрамындағы гиббереллиндердің мөлшері өсу деңгейіне қарай артып отырады. Оның артуы жапырақтың өсу кезеңі аяқталуға жақын уақытта байқалады, ол кезде жапырақтар фитогормон түзілу орталығы және өсімдік ағзасының басқа мүшелеріне оның доноры болып табылады. Жоғарыда айтып өткендей гиббереллиндер кең көлемде өсімдік клеткаларының физиологиялық процестеріне: гүлденуіне, жақсы жеміс беруіне, фотосинтезге, сабақ пен тамырдың ұзарып өсуіне және басқа да үрдістерге әсерін тигізеді [22; 23] .
Гиббереллиндердің көптеген физиологиялық эффектісін оның табиғи антогонисі абсциз қышқылы (АБҚ) тежейді. Сонымен қатар, АБҚ-өсімдіктер өмірінде маңызды рөл атқарады. Басқа фитогормондар сияқты соңғы жылдары АБҚ-ның әсер ету механизмін зерттеу алға қойылған. АБҚ өсімдік дәніндегі қор заттардың синтезі және олардың клеткада жиналуын реттеу, эмбриогенездің соңғы сатысындағы дәнді құрғату, дәннің пісіп-жетілуі және оның тыныштық жағдайына өту кезеңіне қатысады. Сонымен қатар, өсімдіктің сыртқы орта әсеріне жауап беруінде, құрғақшылық және суыққа төзімділігінің қалыптасуында АБҚ-ның маңызы зор [24] .
Құрылымы жағынан АБҚ үш изопренді қалдықтан тұратын сесквитерпеноид болып келеді. 1949 жылы Т. Хамберг үйеңкі ағашының тыныштық күйдегі бүршігінен және сұлының колеоптилі кесіндісінен, өсімдіктің өсуін тежейтін затты бөліп алды. Одан кейінгі жылдары «β-ингибиторлық комплекс» деп аталатын өсуді тежейтін заттарды бүршіктен, түйнектен және өсімдіктің басқа әртүрлі бөліктерінен тапқан. В. Лью және Х. Карнс 1961 жылы пісіп-жетілген мақта жемісінен, жапырақсызданған кесінділердің түсуін жылдамдататын кристал түрдегі затты бөліп алып, оны абсцизин деп атады (ағылшын тілінен abscission-бөлім, түсу), бірақ та бұл қосылыстың құрылымдық табиғатын зерттеген жоқ. 1963 жылы Калифорния университетінде Ф. Эддикот лабораториясында К. Окумой мақтаның жас жемісінен, сонымен қатар, сұлының колеоптилінің өсуін тежеген және жемістің түсуін жылдамдататын кристалды заттарды бөліп алған болатын. Авторлар оны ″абсцизин II″ деп атады. Олар абсцизин II-нің химиялық қатарын және физиологиялық қасиетін сипаттап, оған С 15 Н 20 О 4 эмпирикалық формуланы ұсынды. Сол жылы ағаш өсімдіктерінде табиғи ингибиторларды зерттеген П. Уоринг және басқалар аққайың жапырағынан хроматографиялық тәсілмен өсу ингибиторын бөліп алды. Бұл ингибитордың өсіп келе жатқан өркендердің бүршіктерінде тыныштық күйді шақыратыны анықталды, және оны ″дормин″ деп атады [25] . 1965 жылы Дж. Корнфорт және П. Уоринг басқалармен бірлікте үйеңкі жапырағынан шыққан дормин мен абсцизин II екеуін молекулалық массалары жағынан, инфрақызыл спектр және еру нүктесі жағынан салыстырып, бұл екі заттың ұқсастығын анықтап тапты. Абсцизин II-нің молекулалық құрамы Окума және басқалар тарапынан 1965 жылы ұсынылды. Абсцизин II астық-тұқымдас өсімдіктің бірнеше түрінен бөлініп алынған. 1967 жылы абсцизин II «абсциз қышқылы» (АБҚ) атын алды. АБҚ-ның бірқатар полифенолдармен бірлікте β-ингибиторлық комплекс құрамына кіретіндігі анықталды. Абсциз қышқылы [3-метил-5-(1′-окси-4-оксо-2′, 6′, 6′-три метил-2′-циклогексен-1′-ил) -цис, транс-2, 4-пентадиен қышқылы] моно-терпендер және дитерпендер туысы (ГҚ-ын қосқанда) С 15 сесквитерпендер қатарына жатады. АБҚ молекуласында сақина іші көміртегінің 1 осметриялық атомы (1′) кездеседі, сондықтан молекула оптикалық изомерияны көрсетеді. Ол екі стериоизомерлік (энантимерлік) формада болуы мүмкін: (+) формасы немесе оңға айналу (а) және (-) формасы немесе солға айналу (б) . Өсімдік ұлпасында көбінесе (+) АБК кездеседі.
АБҚ тек оптикалық изомерияны ғана емес, геометриялық изомерияны көрсетеді. Ол: 2-транс, 4-транс I және бүйір тізбектегі қос байланысты 2-цис, 4-транс-изомер II.
АБҚ-ның табиғи формасы 2-цис, 4-транс бүйір тізбектегі конфигурацияға ие, оны жай абсциз қышқылы деп атаса, ал 2-транс, 4-изомерді 2-транс-абсциз қышқылы деп атайды. Көрінетін және ультра күлгін сәулелермен әсер еткенде, ферменттің қатысуынсыз табиғи форма бірден биологиялық белсенділігі аз 2-транс формасына изомерленеді [26] .
Химиялық таза (+) АБҚ еру температурасы 160-161ºС және молекулалық массасы 264, 31 тән, кристалдық зат болып келеді. АБҚ ерітінділері суда рН 7-ден төмен кезде 262 нм толқын ұзындығында максимум УК-спектрге ие, рН 7-ден жоғары су ерітінділерінде максимум сіңіру - 245 нм толқын ұзындығы болып табылады. АБҚ сілтіде, хлороформда, ацетон, спирт және эфирде жақсы ериді; суда, бензолда нашар ериді.
АБҚ барлық зерттелген жабық тұқымдастар мен жалаңаштұқымдас өсімдіктерінде табылған. , қырықбуын, мүктерде АБҚ- ның болуы көрсетілген. Оларда АБҚ-ның концентрациясы 1нМ-ден 1мкМ-ға дейін. Балдырларда АБҚ-ның функциясын АБҚ-ның аналогы - лунулар қышқылы орындайды. Ол бірінші рет Lunularia cruciata (L) Dum мүгінен бөлініп алынған. Бұл қышқыл дигидростильбендер класына жатады. АБҚ әлі күнге дейін саңырауқұлақ пен бактерияларда табылған жоқ [27] .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz