Аналитикалық химия: сандық талдау, сынама алу, қателер және гравиметриялық әдістер - дәрістер конспектісі


“Аналитикалық химия. 2 өлім” пәні
Дәрістер мазмұны (конспектісі) .
1 - Дәріс. Химиялық сандық талдау, оның мақсаттары, түрлері және әдістері. Орташа сынама алу, оны анализге даярлау.
Сандық талдау заттың сандық құрамын анықтаумен щұғылданады. Қойылатын мақсаттарына қарай сандық талдау элементті және фазалық анализ бөлып бөлінеді. Элементті анализде зерттейтін үлгідегі элементтің жалпы мөлшері анықталады: мысалы, Pb S, Pb CO 3 . Фазалық анализде үлгідегі әр қосылыстың сандық мөлшері анықталады. Ол үшін әр қосылыс жеке-жеке бөлінеді де, әрқайсысының сандық мөлшері анықталады: PbS (HNO 3 ), PbCO 3 (НАс), PbSО 4 (к. НАс+к. NН 4 Ас) .
Сандық талдауда химиялық, физикалық, физика-химиялық, биологиялық әдістер қолданылады: 1. Химиялық әдістер химиялық реакцияларды қолдануға негізделген: гравиметрияда (Ғе 3+ → Ғе(ОН) 3 → Ғе 2 О 3 ) анықталатын зат белгілі бір қосылыс түрінде бөліп алынып, оның массасы дәл өлшенеді; титриметрияда (Ғе 3+ → 5 Ғе 2+ + МпО 4 - + 8Н + → 5Ғе 3+ + Мп 2+ + 4Н 2 О) анықталатын затпен әрекеттесетін концентрациясы белгілі реагенттің көлемі дәл өлшенеді; көрнекі колориметриялық әдіс (Ғе 3+ +3SСN - → Ғе(SСN) 3 ) түзілген комплекстің бояуының интенсивтілігін байқауға негізделген. 2. Физика-химиялық әдістер заттың химиялық реакция жүруі нәтижесінде өзгеретін белгілі бір физикалық параметрін өлшеуге негізделген (мысалы, полярография, амперометрия әдістерінде - ток күші; потенциометрияда -потенциал; кулонометрияда - электр мөлшері; фотометрияда - оптикалық тығыздық т. б. ) . 3. Физикалық әдістер мөлшері анықталатын заттың белгілі бір физикалық қасиетін (тығыздығы, электрөткізгіштігі, сәулеленуі, оптикалық тығыздығы, потенциалы т. б. ) тікелей өлшеуге негізделген (мысалы, атомды-абсорбциялық әдістер-ультракүлгінді, инфрақызылды, рентгенді спектроскопия - заттың әр түрлі сәулелерді жұтуына; атомды-эмиссионды әдістер - спектральды, жалынды фотометрия, т. б. - заттың әр түрлі сәулелерді сыртқа шығаруына негізделген) . 4. Биологиялық әдістер биологиялық активті заттарды қолдану арқылы заттың мөлшерін анықтауға негізделген.
Кез-келген сандық талдау жалпы мынадай сатылардан тұрады:
- Орташа сынаманы сұрыптап (таңдап алу) .
- Сынаманы (үлгіні) анализге дайындау;
- Таңдап алынған әдіспен талдауды жүргізу;
- Аналитикалық сигнал алу, оны сенімді тіркеу және өлшеу.
- Анализ нәтижелерін өңдеу және есептеу.
Сынаманы сұрыптау техникасы заттың агрегаттық жағдайына байланысты. Онымен тәжрибеде техникалық бақылау бөлімі (ТББ) шұғылданады. Анализденетін зат қатты, сұйық немесе газ күйінде болуы мүмкін. Анализдеуге сынаманы белгілі бір мөлшерде алады. Сынаманың құрамы анализденетін заттың орташа құрамына түгелімен сәйкес болуы керек. Анализдеуге қажетті сынаманы механикалық не химиялық тәсілдермен дайындайды. Зат газ не сұйық күйінде болатын болса, одан құрамы анализденетін заттың құрамына сәйкес келетін сынама дайындау қиын емес. Қатты зат түрлі компоненттердің гетерогенді қоспасы болғандықтан, оның әр жерінен алынған сынама құрамы әр түрлі болуы мүмкін. Сынама алу қателігі зат түйіршіктерінің мөлшері өскен сайын және сынама мөлшері азайған сайын артады. Сондықтан сынама өте аз мөлшерде алынатын талдау әдістері (спектрография, микроанализ, балқу нүктесін анықтау т. б. ) үшін оны өте жоғары дәрежеде гомогендеу керек. Егер анықталатын компонент (мысалы, кен) сынаманың өте аз ғана бөлігін құраса және сынамадағы жеке компоненттердің тығыздықтары әртүрлі болса, сынама алу қиындай түседі. Сынама алмас бұрын талданатын затты жақсылап араластыру керек. Анализдеу үшін сынаманы азайтып алу керек және оны жақсылап ұсақтау қажет. Орташа сынаманың мөлшері мына формула бойынша есептелінеді:
q = K . d 2 , (q - орташа сынама мөлшері, кг; d - түйіршік диаметрі, мм; ) . Егер бөлшектерінің диаметрі d = 0, 1 мм сынама алу қажет болса, онда оның массасын q = 0, 1 . 0, 1 2 = 0, 001 кг = 1 гр. етіп өлшеп алу керек.
Сынаманы азайтуды бөлшектеу (кварттау), шаршылау әдістері арқылы немесе механикалық бөлгіштердің көмегімен жүзеге асыруға болады:
- Бөлшектеуді (кварттауды) сақиналы және конусты тәсілдерді қолданып іске асырады.
- Шаршылау әдісіндесынаманы сызғыштың көмегімен тегістеп жайып алады да, содан соң оны шахматтық реттегі квадраттарға бөліп, квадраттардан сынама алады.
- Механикалық бөлгіштер көмегімен сынама алубір жағы бітеу майыстырылған түтік бөлгіш көмегімен орындалады. Бұндай бөлгіштің әр айналымында (бұрылысында) сынаманың көлемі екі есе азайып отырады.
Егер сынаманы саусақпен сипап не уқалап көргенде, оның түйіршіктері қолға білінбейтін болса, онда бұл - сынаманың жақсы ұсақталғандығының белгісі болып табылады. Әрмен қарай талдауды жүргізу үшін анализденетін сынаманың қатты не сұйық күйіндегі белгілі мөлшері дәл өлшеп алынады.
2 - Дәріс. Сандық анализ қателіктері, олардың жіктелуі, шығу көздері. Қателіктерді анықтау және жою. Талдау мәліметтерін математикалық статистика әдісімен өңдеу.
Кездейсоқ және жүйелі қателердің салыстырмалы сипаттамасы
Қателер
Жүйелі қателерді топтастыру
Табиғаты белгілі,
мәні белгілі немесе оларды есептеуге болады
Айқын емес заңдылықтардың байқалмай қалуы. Мысалдар:
1) температураның концентрацияға әсері;
2) индикаторлық қателер және т. б.
Әртүрлі
- Аспаптық:
а) өлшеуіш ыдыстарды қолданғанда;
б) салмақты өлшегенде;
в) өлшеудің дәл болмауы;
г) сигналдың дұрыс өңделмеуі.
2) Реактивтік - реактивтер тазалығының қанағаттанарлықтай болмауы.
3) Әдістемелік: әр алуан себептерден (реакцияның толық өтпеуі, толық бөлінбеу, қосарласып тұну, ұшқыш қосылыстардың түзілуі және т. б. )
Эксперимент қою ар-қылы немесе анализ жасалып жатқанда
1а) өлшеуіш ыдыс-тардың көлемін тексеру;
1б) таразыны салыстырып тексеру; таразы тастарын эта-лонмен салыстыру;
1в) түрлі аспаптарды салыстырып тексеру;
1г) математикалық әдістерді қолдану.
2) Бақылау тәжірибе-лерін және бос тәжірибелер өткізу.
3) Әр әдістеме үшін өзіндік ерекшелігі болады.
Әртүрлі:
- ыдыстан былғану;
- температураның әсері;
- уақыт әсері;
- ылғалдың әсері;
- жұмыс реті;
- бөліп алу кезінде физика-химиялық үрдістердің бұзылуы;
- анализденген объектінің өзіндік ерекшеліктері;
- оперативтік, жеке бастылық және т. б.
Анализдің кездейсоқ қателерінің бағалануы математикалық статистика әдістерін қолдану арқылы жүргізіледі. Нәтижелер қатесінің кездейсоқ құраушысының мінездемелерін бағалау ішкі зертханалық эксперимент жоспарын қолданумен жүзеге асырылуы мүмкін.
Сынама алу және сынаманы анализге дайындау операцияларының кездейсоқ қателері тәуелсіз зерттеледі. Олар бір ғана заттан (материалдардың партиясынан) алынған сынамалардағы анықталатын компоненттің нақты мөлшерінің шашырандылығын сипаттайды. Сынамада ізделінген компонентті параллельді анықтау (сынама анализінің) нәтижелерінің кездейсоқ қателері, бұл - бір ғана сынамадан ізделінген компонентті анықтау нәтижелерінің шашырандылығы.
Анықтау нәтижелері үлестірілуінің нормальдығын ГОСТ 8. 207-76 бойынша тексереді. Бұл мақсатта әрбір сынама үшін ізделінетін компонентті параллельді анықтау нәтижелерінің саны 15-тен кем болмауы қажет, ал бұл көп еңбекті талап етеді. Сондықтан, әдеттегідей, сынаманың аз санымен шектелуге тырысады.
Құрамында анықталатын компоненттің шекті (х max және х min ) мөлшерлері және ілескен компоненттердің максималды мөлшері бар екі сынама үшін анықтау нәтижелерінің үлестірімі зерттеледі. Егер үлестірім нормальды болса, онда үлкен ықтималдықпен басқа да сынамалардағы анықтау нәтижелерінің үлестірімі де нормальды болады деп санауға болады.
Таңдамалық стандартты ауытқу (S) көлемі (n) 30÷50 болатын бас таңдаманың стандартты ауытқуына шамамен тең деп алынады. Егер S көлемі кішірек болса, онда сенімді (СА) аралықты бағалау үшін Стьюдент үлестірімін қолданады:
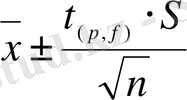 ,
,
мұндағы, t(p, f) - Стьюдент коэффициенті;
S - таңдамалы стандарттық ауытқу;
n -таңдаманың көлемі.
Бас жиынтық үшін СА былай есептеледі:
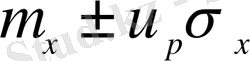
мұндағы, μ х - анықтау нәтижесінің математикалық күтімі;
u p - квантиль, нормаль үлестірімнің коэффициенті;
σ x - бас жиынтықтың стандартты ауытқуы.
Таңдаманың көлемі n неғұрлым үлкен болса, соғұрлым
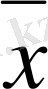 шамасы μ-ге жақын болады.
шамасы μ-ге жақын болады.
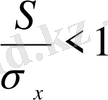 шартының орындалу ықтималдығы, таңдаманың көлемі кішірейгенде арта түседі.
шартының орындалу ықтималдығы, таңдаманың көлемі кішірейгенде арта түседі.
Аналитикалық бақылау практикасында 10-20 параллельді анықтаудан тұратын арнаулы тәжірибелердің нәтижелерінен алынған метрологиялық сипаттамалар, зертханалық мұрағат (архив) мәліметтері арқылы дәлденеді. Сынамалардың ең аз санын таңдағанда S r -ың анықталатын компоненттің мөлшеріне тәуелділігін көрсететін жүрісі бірқалыпты қисығын алуға ұмтылады. Әдетте мұрағатта көптеген сынамалардан ізделінген компонентті саны аз (n≥3) параллель анықтаулар арқылы табудың нәтижелері сақталған. Стандартты ауытқуды мына формулалар арқылы:
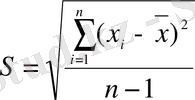 - анықтау нәтижелерінің нормаль үлестірімі үшін
- анықтау нәтижелерінің нормаль үлестірімі үшін
және
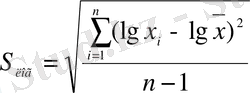 - логнормаль үлестірім үшін есептейді.
- логнормаль үлестірім үшін есептейді.
Егер аналитиктің қолында құрамдары ұқсас үлгілер серияларының қайталап жасалынған анализдерінің деректері болса, онда ортасалмақты дисперсия есептеледі. Әртүрлі әдебиет көздерінде оны әрқалай белгілейді:
а) [6] -да, мысалы, D n, k =S n, k 2 , мұндағы n - параллельді анализдер саны, k - үлгілер не сынамалар саны;
б) ИЮПАК ұсыныстарында бұл шама S g 2 деп белгіленген, мұндағы g - анализ серияларының саны;
в) [17] -ң авторларының ұсынысы бойынша:
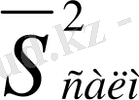 және
және
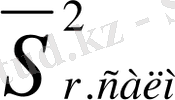 - ортасалмақты салыстырмалы ауытқу.
- ортасалмақты салыстырмалы ауытқу.
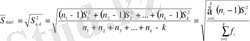 ,
,
мұндағы S 1 2 , S 2 2 , …S k 2 - әрбір үлгі (сынама) анализінің деректері бойынша алынған таңдамалық дисперсиялар;
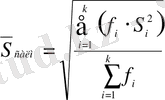 ; мұндағы
; мұндағы
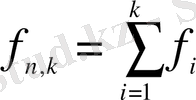 - бұл,
k
-тектес
- бұл,
k
-тектес
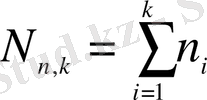 элементтен тұратын біріккен статистикалық таңдаманың еркіндік дәрежесінің саны;
элементтен тұратын біріккен статистикалық таңдаманың еркіндік дәрежесінің саны;
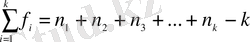 ;
;
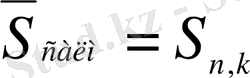 - ортасалмақты стандартты ауытқу.
- ортасалмақты стандартты ауытқу.
Егер
 болса, онда стандарттық ауытқудың бұл мәндерін шамамен бас жиынтықтың стандартты ауытқуы ретінде қабылдауға болады. Бұл жағдайда
болса, онда стандарттық ауытқудың бұл мәндерін шамамен бас жиынтықтың стандартты ауытқуы ретінде қабылдауға болады. Бұл жағдайда
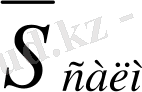 (
(
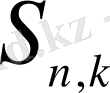 ) пен
) пен
 бас параметрі мәндерінің айырмашылығы аз. Ортасалмақты салыстырмалы стандартты ауытқу
бас параметрі мәндерінің айырмашылығы аз. Ортасалмақты салыстырмалы стандартты ауытқу
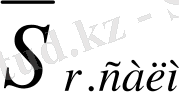 мына формула арқылы есептеледі:
мына формула арқылы есептеледі:
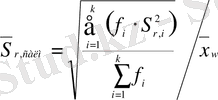 , мұндағы
, мұндағы
 - ортасалмақты орта мән.
- ортасалмақты орта мән.
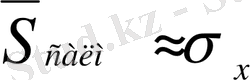 деген жағдайдың қабылдануы, анализге түскен компонентті анықтаудың дәлдігі оның мөлшерлерінің барлық деңгейлерінде анықтау дәлдігі бірдей екендігін мойындауды білдіреді. Дәлдік бірдей деген пайымдауды S
i
2
таңдамалық дисперсияларды бір-бірімен жұптап салыстыру арқылы тексеруге болады, мәселен, Фишердің критерийі және тағы да басқа, математика курсында келтірілген статистикалық әдістердің (Бартлет және Кохран критерийлері) көмегімен тексеруге болады.
деген жағдайдың қабылдануы, анализге түскен компонентті анықтаудың дәлдігі оның мөлшерлерінің барлық деңгейлерінде анықтау дәлдігі бірдей екендігін мойындауды білдіреді. Дәлдік бірдей деген пайымдауды S
i
2
таңдамалық дисперсияларды бір-бірімен жұптап салыстыру арқылы тексеруге болады, мәселен, Фишердің критерийі және тағы да басқа, математика курсында келтірілген статистикалық әдістердің (Бартлет және Кохран критерийлері) көмегімен тексеруге болады.
Тәжірибелердің нәтижелері және мұрағаттың деректері бойынша есептелген S тәжр және S мұра стандартты ауытқуларын салыстырса, мынадай қорытындыларға келеміз. Егер S 2 тәжр және S 2 мұра біртекті емес, ал S мұра >S тәжр болса, онда зертханада анализ әдістемесі әлі дұрыс игерілмеген деп есептеледі. Егер S мұра <S тәжр болса, онда зертханамен салыстырғанда осы әдістемені жасаушылар нашарлау жинақтылықпен істейді деп есептеледі, сондықтан жинақтылықтың стандартты ауытқуын бағалаудың негізі ретінде мұрағаттық деректерді алу керек. Математикалық статистика әдістерімен дисперсияларды салыстыру былай жүргізіледі:
1. Фишер критерийі, F-критерий.
Бір ғана сынаманың әр түрлі тәуелсіз анализ әдістерімен (әдістемелерімен) алынған нәтижелерінің үлестірімі нормальды болатын n 1 және n 2 екі таңдамалы жиынтықтарды қарастырайық. Олардың таңдамалы дисперсиялары S 1 2 және S 2 2 бірдей болмайды.
Егер олардың айырмашылығы кездейсоқ сипатты болса, бұлар бір ғана
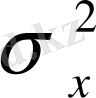 бас дисперсиясының жуық бағалары болып табылады. Бұл жағдайда, екі таңдама нәтижесінің дәлдігі бірдей болып есептеледі. Мұны Фишердің үлестіріміне негізделген F-критерийі арқылы бағалайды. Әдетте маңыздылық деңгейі
β
(0, 05 немесе 0, 01) болып таңдалады. Еркіндік дәрежесі
f
1
=
n
1
-1;
f
2
=n
2
-1.
F
-критерийінің критикалық мәндері кестелерде келтіріледі [
F
кесте
,
(
β, f
1
,
f
2
) ] . Екі салыстырылып отырған таңдама үшін
F
-функциясының мәнін есептейді:
бас дисперсиясының жуық бағалары болып табылады. Бұл жағдайда, екі таңдама нәтижесінің дәлдігі бірдей болып есептеледі. Мұны Фишердің үлестіріміне негізделген F-критерийі арқылы бағалайды. Әдетте маңыздылық деңгейі
β
(0, 05 немесе 0, 01) болып таңдалады. Еркіндік дәрежесі
f
1
=
n
1
-1;
f
2
=n
2
-1.
F
-критерийінің критикалық мәндері кестелерде келтіріледі [
F
кесте
,
(
β, f
1
,
f
2
) ] . Екі салыстырылып отырған таңдама үшін
F
-функциясының мәнін есептейді:
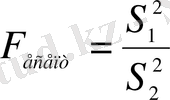 , және бөлшектің алымында әрқашан салыстырылып отырған екі таңдамалы дисперсияның үлкенірегі тұрады (
f
1
- дисперсиясы үлкенірек таңдамаға сәйкес болады) . Егер
F
есепт
≤F
кесте
болса, онда анализ нәтижелерінің таңдамалы жиынтықтарының дәлдігі бірдей деген қорытындыға келеді, сондықтан оларды бірге өңдеу және бас дисперсиясын есептеу мүмкін. Егер
F
есепт
>F
кесте
болса, онда анализ нәтижелерінің таңдамалы жиынтықтарының дәлдігі бірдей емес.
, және бөлшектің алымында әрқашан салыстырылып отырған екі таңдамалы дисперсияның үлкенірегі тұрады (
f
1
- дисперсиясы үлкенірек таңдамаға сәйкес болады) . Егер
F
есепт
≤F
кесте
болса, онда анализ нәтижелерінің таңдамалы жиынтықтарының дәлдігі бірдей деген қорытындыға келеді, сондықтан оларды бірге өңдеу және бас дисперсиясын есептеу мүмкін. Егер
F
есепт
>F
кесте
болса, онда анализ нәтижелерінің таңдамалы жиынтықтарының дәлдігі бірдей емес.
Бұлай қарастыру тәсілі формальды болып келеді. Мәселен, ол мынадай оғаш (парадоксалды) пікірге әкелуі мүмкін: дисперсияларды біркелкі деп танудың, бұдан шығатын салдарымен қоса, оңай жолы -
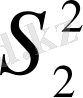 min
мәнін үлкейту, яғни нәтижелердің жинақтылығын нашарлату керек деген тұжырым. Бұл тұйықтан шығудың дұрыс бағыты - априори (немесе нормативтік әдебиеттен), яғни рұқсат етілген
min
мәнін үлкейту, яғни нәтижелердің жинақтылығын нашарлату керек деген тұжырым. Бұл тұйықтан шығудың дұрыс бағыты - априори (немесе нормативтік әдебиеттен), яғни рұқсат етілген
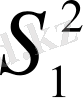 max
мәні қабылданады және тек осының негізінде анализді орындаған кезде өлшеулердің дәлдіктерінің бірдейлігі жөнінде және S
2
max
мәніне жетіп қалғаны жайлы сұрақтар шешіледі.
max
мәні қабылданады және тек осының негізінде анализді орындаған кезде өлшеулердің дәлдіктерінің бірдейлігі жөнінде және S
2
max
мәніне жетіп қалғаны жайлы сұрақтар шешіледі.
2. Бартлеттің критерийі .
n 1 , n 2 , ……n k сияқты бірқатар таңдамалы жиынтықтарымен көрсетілген анализ нәтижелерінің біртектілігін және статистикалық өңдеуден біріктіріліп өтуіне жарамдығын бағалау арқылы бірнеше дисперсияларды салыстыру үшін қолданылады. Мына шамалар есептеледі:
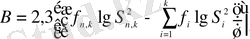 ;
;
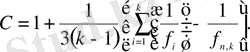
Біріктірілген таңдаманың еркіндік дәрежесінің саны:
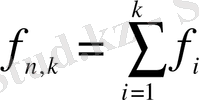 ; және
; және
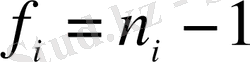 - бөлек таңдамалар үшін еркіндік дәрежесінің саны; S
i
2
- таңдамалық дисперсиялар;
- бөлек таңдамалар үшін еркіндік дәрежесінің саны; S
i
2
- таңдамалық дисперсиялар;
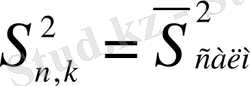 - ортасалмақты дисперсия.
- ортасалмақты дисперсия.
Бартлет критерийі
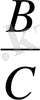 бөліндісі ретінде есептеледі.
бөліндісі ретінде есептеледі.
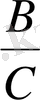 критерийін,
f=k-1
(мұндағы
k
- анализге түскен анализ серияларының немесе сынамалардың, не болмаса зертханалардың саны), маңыздылық деңгейінің (
β
) 0, 05 не 0, 01 шамалары үшін кестеде келтірілген
критерийін,
f=k-1
(мұндағы
k
- анализге түскен анализ серияларының немесе сынамалардың, не болмаса зертханалардың саны), маңыздылық деңгейінің (
β
) 0, 05 не 0, 01 шамалары үшін кестеде келтірілген
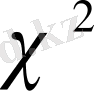 - тің мәнімен салыстырады.
- тің мәнімен салыстырады.
Егер
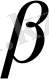 <
<
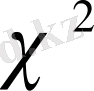 (f,
(f,
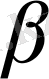 ) болса, онда барлық таңдамалы дисперсиялар біртекті, бір-бірінен айырмашылығы еленбейтін шамада деп саналады және барлық анықтаулардың нәтижелерінің дәлдігі бірдей деп есептеледі.
Қайталанымдылықтың өлшемі
ретінде бас параметрдің мәніне жақын генерализацияланған (шоғырланған) стандартты ауытқу
S
n, k
алынады.
) болса, онда барлық таңдамалы дисперсиялар біртекті, бір-бірінен айырмашылығы еленбейтін шамада деп саналады және барлық анықтаулардың нәтижелерінің дәлдігі бірдей деп есептеледі.
Қайталанымдылықтың өлшемі
ретінде бас параметрдің мәніне жақын генерализацияланған (шоғырланған) стандартты ауытқу
S
n, k
алынады.
3. Кохранның (Кохреннің) критерийі .
Бұл барлық таңдамалы жиынтықтардың көлемдері бірдей болғанда қолданылады: n
1
=n
2
=……= n
k
. Алдымен таңдамалы дисперсиялар есептеледі
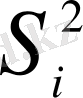 , содан кейін Кохран критерийін ең үлкен дисперсияның барлық таңдамалық дисперсиялардың ортақ қосындысына қатынасы ретінде анықтайды:
, содан кейін Кохран критерийін ең үлкен дисперсияның барлық таңдамалық дисперсиялардың ортақ қосындысына қатынасы ретінде анықтайды:
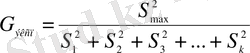 .
.
Кестеде G кесте ( f, β ) мәндері беріледі, f =k-1 - еркіндік дәрежесінің сандары, β - маңыздылық деңгейі 0, 05 немесе 0, 01.
Егер G эксп <G кесте ( f, β ) болса, онда барлық дисперсиялар біртекті болып келеді және олар бір бас дисперсияның ғана бағасын көрсетеді. Бұл жағдайда бас дисперсияның ең көрнекті бағасы ретінде таңдамалық дисперсиялардың орта арифметикалық мәнін алуға болады:
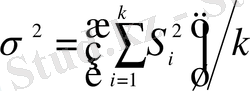 , k=30÷50.
, k=30÷50.
Сонымен анализ нәтижелері қайталанымдылығының стандартты ауытқуы бір ғана сынаманың әртүрлі жағдайларда (әртүрлі орындаушылар, әртүрлі зертханалар, әртүрлі уақытта және т. б. ) жасалған анализдерінің нәтижелерінен алынған көлемі жеткілікті болатын таңдамалар бойынша бағаланады. Әртүрлі зертханалардың анализді өткізу жағдайларының айырмашылығынан туындаған анализдің кездейсоқ қателігінің үлесі, ал дәлірек айтқанда, осы үлеспен байланысты нәтижелердің стандарттық ауытқуының құраушысы, дисперсиялардың қосылу заңы негізінде немесе дисперсиялық анализ сұлбасы негізінде бағаланады.
3 - Дәріс. Гравиметрлік талдау әдісі, жіктелуі: бөлу, айдау, тұндыру әдістері. Қатты фаза түзілу механизмі. Кристалды, аморфты тұнба алу жағдайлары.
Заттың сандық мөлшерін оны тұндырып, бөлінген тұнбаның массасын анықтауға негізделген әдісті гравиметриялық әдіс дейді. Гравиметриялық әдісте анықтайтын компонентті үлгіден газ түрінде шығарып та анықтайды - айдау әдісі. Бұл әдісте не айдалған заттың массасын, не қалған қалдықтың массасын анықтайтын.
Тұндыру әдісінде анализдейтін заттың белгілі бір мөлшерін өлшеп ерітеді, содан кейін анықтайтын элементті жаман еритін қосылыс түрінде тұндырады. Түскен тұнбаны фильтрлеп бөледі, мұқият жуады, қыздырады, содан кейін оны үлкен дәлдікпен өлшейді. Тұнбаның массасы мен оның формуласын пайдаланып анықтайтын элементтің мөлшерін табады.
Кристалды тұнбаларды мүмкіншілігі болғанда ірі кристалды түрінде алған жөн. Мұндай тұнбалар тез тұнады, сондықтан ерітіндіден фильтрлеп бөліп алу жеңіл болады, сонымен қатар беткі қабаты кіші болғандықтан ерітіндіден бөгде иондарды аз адсорбциялайды.
Жоғарыда келтірілгендей ірі кристалды тұнба алу үшін тұнбаның пайда пайда болу жағдайында салыстырмалы аса қанығу мәні мүмкіншілігі болғанша аз болуы керек.
(Q-ε) /ε формуласынан тұнбаның ерігіштігі неғұрлым көп болса және тұнба түзетін реактивтердің концентрациялары неғұрлым аз болса, соғұрлым салыстырмалы аса қанығу мәні аз, соған сәйкес алғашқы кристалдар аз пайда болады да, кристалдар ірі болып түседі. Сондықтан ірі кристалды тұнба алу үшін тұндыру процесінде тұнбаның ерігіштігін арттыру және раективтердің концентрациясын азайту азайту қажет. Тұнба түзілуде реакцияласатын иондардың концентрациясын азайтудың (Q-ды азайту) бірнеше жолы бар. Оның ең жабайы жолы: 1) тұнба түсірер алдында ерітінділерді сұйылту; 2) тұньаға түсіргішті тамшылап қосу; 3) ерітіндіні үнемі араластыру. Сұйытылғн ерітінділерді пайдалану және араластырып ептеп тұндыру бір жерде пайда болатын аса қанығуды, соған сәйкес тұнбаның біркелкі түспеуін түгел жоя алмайды. Сондықтан тұнбату - ерігіштің концентрациясын азайтудың және оны біркелкі, үздіксіз, баяу алудың бір әсерлі жолы - пайда болатын реагент әдісін пайдалану (гомогенді тұндыру) . Бұл әдісте ерітіндіге тікелей тұнба түсіргіш құйылмай оның орнына ерітіндіде баяу жүретін реакция нәтижесінде тұнба түсіргіш беретін зат қосылады. Тұнбатүсіргіш ион зерттейтін ерітіндіде ептеп аз мөлшерде пайда болады, бұл салыстырмалы аса қанығу мәнін азайтуға мүмкіншілік береді. Мысалы, барий ионын BaSO 4 түрінде тікелей күкірт қышқылын құйып тұндырудың орнына диметилсульфат, не сульфаамин қышқылын қосып тұндыруға болады. Бұл жағдайда ерітіндіде жүретін протолитикалық реакцияның нәтижесінде тұнбаға түсіргіш алынады:
(CH 3 ) 2 SO 4 + 4H 2 O ↔︎ 2H 3 O + + SO 4 2- + 2CH 3 OH
HSO 3 NH 2 + 2H 2 O ↔︎ H 3 O + + SO 4 2- + NH 4 +
Тұнбаға түсіргіштің ерітіндінің бар көлемінде біркелкі, үздіксіз аз жылдамдықпен пайда болуы бір жерде асақанығуды түгелдей жояды, сонымен қатар системадағы кристалдану орталығының санын азайтады, бұл ірікристалды таза тұнба алуға мүмкіншілік береді.
Көптеген қышқылдық ортада еритін гидроксидтерді, не әлсіз қышқылдардың тұздарын (карбонаттар, оксалаттар, кейбір сульфидтер т. б. ) гомогенді ерітіндіден түсіру ыңғайлы. Бұл жағдайда тұндыратын зат пен тұнбаға түсіргішті қышқыл ортада араластырады. Қышқыл ортада тұнба түзілмейді. Содан кейін ерітіндіге системадағы протондарды байланыстыратын зат қосады. Нәтижесінде ерітіндінің бар көлемінде қышқылдық біркелкі, ептеп азаяды, бұл ірікристалды тұнбалар алуға жағдай жасайды.
Мысалы, кальций иондарын қышқылда еритін оксалат түрінде тұндырады. Егер Са 2+ және C 2 O 4 2- иондарын қышқыл ортада араластырса тұнба түзілмейді. Енді осы ерітіндіге карбамид құйып қыздырса мынадай реакция жүреді:
CO(NH 2 ) 2 + H 2 O ↔︎ 2NH 3 + CO 2
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz