Глютамат алмасуындағы глютаматдегидрогеназаның (ГДГ) биохимиялық қасиеттеріне цитокинин медиаторының әсері


әл-Фараби атындағы Қазақ ұлттық университеті
Биология факультеті Биотехнология, биохимия, өсімдіктер физиология кафедрасыБІТІРУ ЖҰМЫСЫ
ГЛЮТАМАТТЫҢ АЛМАСУЫНДАҒЫ НЕГІЗГІ БЕЛСЕНДІ ФЕРМЕНТКЕ ЦИТОКИНИН МЕДИАТОРЫНЫҢ ӘСЕРІ
Орындаған: Алашбаева Л. Ж. (қолы, күні)
Ғылыми жетекшілері :
ҚР ҰҒА-ның академигі Гильманов М. Қ.
(қолы, күні)
б. ғ. к., доцентДжокебаева С. Ә.
(қолы, күні)
Норма бақылаушы: Акимбекова А. Б.
(қолы, күні)
Қорғауға жіберілді:
Кафедра меңгерушісі,б. ғ. д., профессор Иващенко А. Т.
(қолы, күні)
Алматы, 2008РЕФЕРАТ
Бітіру жұмысы: 32-беттен, 35-әдебиеттен, 1-кесте, 7-суреттен тұрады. Бітіру жұмысы Алашбаева Лилия Жанабаевнаның М. А. Айтхожин атындағы биохимия және молекулальқ биология институтыньң ферменттердің құрылымы мен реттелу лабораториясы мен ҚазҰУ-дың биология факультетінің биотехнология, биохимия және өсімдіктер физиологиясы кафедрасында өткізілді.
Өзектілігі: Глютамат айналымындағы негізгі белсенді фермент-ГДГ-ның биохимиялық қасиеттерін анықтап, оларға цитокинин медиаторының әсерін зерттеу және ферменттердің белсенділігін арттырып, ауылшаруашылығы дақылдарының өнімділігін аттырады.
Негізгі сөздер: бидай дәні, ұрық бөлігі, алейрон қабаты, НАДФ- глютаматдегидрогеназа, глутамат, цитокинин, цитокинин медиаторы
Алдына қойылған мақсаты: Глютамат айналымындағы негізгі ферменттердің биохимиялық қасиеттерін анықтау және оларға цитокинин медиаторының әcepi мен оның физиологиялық, биохимиялық қасиеттерін сипаттап, биотехнологияда қолдану жолдарын қарастыру.
МАЗМҰНЫЗерттеу барысында: Жүргізілген зерттеу тәжірибелерімде бидай дәндерінің үш түрлі сортын (Қазақстан-10, Арай, Дауыл) алдым. Себебі басқа дәнді дақылдармен салыстырғанда, бұларда глутамин қышқылының айналымы анығырақ жүреді, әрі активтілігі жоғары. Бидай дәнінен цитокинин медиаторын, сферасоманы бөліп алуды үйрендім. Бөліп алынған цитокинин медиаторын глютамат айналымындағы негізгі ферменттерге әсер ете отырып, оның белсенділігін, биохимиялық қасиеттерін анықтадым.
Қолданылған әдістер : Октил сефароза (CL-4B) гидрофобты хроматографиясы жэне RP-18 колонкада жасалынатын жоғары кысымды кepi фазалы хроматография, гомогенизациялау, центрифугалау.
1. 2 Цитокининді байланыстырушы белоктар және
цитокинин медиаторы. ……… . . . ….
ҚЫСҚАРТЫЛҒАН ТЕРМИНДЕР
АТФ - аденозин трифосфат
ГДГ - глютаматдегидрогеназа
ДНҚ - дезоксирибонуклеин қышқылы
РНҚ - рибонуклеин қышқылы
МДГ - малатдегидрогеназа
[МДГ+ГОАТ] - малатдегидрогеназа трансфераза
МСГ-1 - сигналды гормон медиаторы
ФК - ферменттік комплекс
НАД-ГДГ - - глютаматдегирогеназа
НАД(Ф) -ГДГ--глютаматдегидрогеназа
НАДН 2 - тотықсызданған
ҚСҚ - қымыздық сірке қышқылы
Трис - 2 амино -2 (гидроксиметил) - 1, 3-пропиондиол.
КІРІСПЕ
Әрбір өсімдіктің физиологиялық қалпы оларда жүретін биохимиялық процесстердің қарқындылығымен сипатталады. Өсімдік клеткасының метаболизмінде ең маңызды орын алатын - глутаматтың алмасу процестері. Осы амин қышқылының алмасуы негізінен азоттың, көмірсулардың және энергетикалық процестердің қиылысу нүктесі болып табылады. Сол себептен қандай да болмасын стресс глутамат алмасуына зиян келтірсе, бүкіл өсімдіктің өсу және даму процестері тежеледі.
Глутаматтың алмасуы түрлі белсенді ферменттердің қатысуымен жүретіні белгілі. Осы амин қышқылының алмасуының негізгі жолы ГДГ- мен глутаматтың ыдырау жолы М. А. Айтхожин атындағы молекулалық биология және биохимия институтының ферменттердің құрылымы мен реттелуі лабораториясында алғаш рет ашылды.
Глютамат айналымындағы негізгі ферменттердің активтенуі белгілі бір сигналдық трансдукция механизімімен іске асады. Сигналды трансдукция механизімін зерттеу қзіргі кздегі биологияның ең өзекті мәселелерінің бірі. Трансдукция дегеніміз-сигналдың сигналға қатарымен берілуі. Трансдукцияның өзіндік ерекшеліктері бар. Трансдукция сигналды эстафета тәріздес өткізеді, басқаша айтқанда жоғары сигнал тек қана көршіге әсер етеді. Сигналды трансдукция механизімінде медиатордың ролі өте жоғары. Осы клеткадағы сигналды трансдукцияда маңызды рол атқаратындығы анықталынды. Медиатор екінші сатыдағы сигналды беретін зат. Себебі гормон тікелей өзі емес медиаторлар арқылы клеткаға әсер ете алады. Сол себептен цитокинин медиаторын зерттеу ғалымдардың қызығушылығын тудырады. Себебі осы цитокинин медиаторы клетка ішіндегі мембранамен байланысқан фементтерге әсері өте жоғары. Инозиттік сигналдың клеткадағы берілуінің малекулалық механизімі жақсы зерттелген, бірақ оның субклеткалық аспектілері толық зерттелмеген. Осылайша субклеткалы ранеллалардың инозитті сигналдық трансдукция процесіне қатысатыны әлі толық белгілі емес /1/.
М. А. Айтхожин атындағы молекулалық биология және биохимия институтында cубклеткалық органелла-сферосома, липидтің тек бір түрі -фосфатидилинозиттен және глютаматдегидрогеназа деген бірғана ферменттен тұратыны белгілі болған /2/.
Бұл жұмыстың мақсаты: Глютамат айналымындағы негізгі ферменттердің биохимиялық қасиеттерін анықтау және оларға цитокинин медиаторының әcepi мен оның физиологиялық, биохимиялық қасиеттерін сипаттап, биотехнологияда қолдану жолдарын қарастыру.
Осы мақсатқа жету үшін алға қойылған міндеттер:
- Цитокинин медиаторын бөліп алу;
- Бөліп алынған цитокинин медиаторын глютамат айналымындағы негізгі ферментке - ГДГ-ға әсерін қарастыру;
- ГДГ-ның белсенділігін анықтап, олардың клетка ішіндегі ролін зерттеу;
- Клетка ішілік сигналдық трансдукцияның субклкткалық аспектілерін зерттеу;
1. ӘДЕБИЕТКЕ ШОЛУ
1. 1. Глютамат айналымы және оған қатысатын негізгі ферменттер
Белоктар өздерінің көп түрлілігі және атқаратын қызметтерінің маңыздылығына байланысты тірі организмдерде елеулі рол атқарады. Қалыптасып келе жатқан өскіндерді кейін белок синтезі үшін қолданылатын азот айналымы өнімдерімен қамтамассыз ету қорлық белоктардың гидролизі нәтижесінде пайда болатын амин қышқылдары мен амидтердің кей жағдайда пептидтердің көмегімен жүзеге асады. Қазіргі кезде астық тұқымдастардың проламиндер мен глютелиндердің қорға жиналатындығына еш күмән келтірілмейді. Олар эндосперімде жинақталған.
Барлық белоктардың түріне тән ерекшелік - олардың құрамында глютамин қышқылының қалдығының біраз мөлшерінің болуы. Астық тұқымдастардың дәніндегі проламиндерде глютамин қышқылының мөлшері орташа есеппен 100г белоктың ішінде тарыда 13, 7г, ал бидайда 43, 3г дейінгі аралықта болады, ал амега проламиндер фракцияларында белоктың құрғақ салмағына есптегенде 53, 2%-ін глютамин қышқылы құрайды. Бидайдың глютениндегі оның мөлшері 37%-ке жуық болады. Қорлық белоктың құрамындағы, әсіресе бидайдағы глиадинде глютамин қышқылы қалдықтарының көпшілігі амидтенген. Үпілмәліктен алынған альбумин фракциясының құрамында глютамин қышқылының мөлшері жоғары (30 моль %- ке дейін) болған. Ол пісіп жетілу кезінде жинақталып, өскін өсуі кезінде тез жұмсалған. Соның негізінде ол бірінші тез мобилденетін белок резервісі болып табылады деген қорытынды жасалған. Тұқымдардағы қорлық белоктарда глютамин қышқылдарының мөлшерінің жоғары болуы немен байланысты болады деген сұрақ туады? Бұның ең дұрыс шындыққа жақын жауабы, осы амин қышқылы тұқымының енуі кезіндегі метоболиттік процестердің тез жүруіне ерекше маңызды роль атқаратындығында деп түсіндіріледі.
Бидай дәнінде глутамин мөлшерінің көп екені белгілі, себебі бидайдың қор ретінде жиналатын белоктарының құрамында глутамин және оның туындысы - пролиннің жалпы мөлшері 60%-дан астам болса, басқа амин қышқылдары 35-38%-ын ғана құрайды /3/. Өсімдіктердің метаблизімінде ең маңызды рол атқаратын глютамат алмасу процесі. Глютамат өсімдіктерде барлық амин қышқылдарының арасында ең маңызды және орталық амин қышқылы екендігі жалпыға мәлім /4/. Сондықтан жоғары сатыдағы өсімдіктердегі глютамат айналымының негізгі жолдарын үлкен қызығушылық тудырды. М. Ә. Айтхожин атындағы молекулалық биология және биохимия институтының ферменттердің құрылымы және реттелуі лабораториясында ондаған жылдар бойы осы айналымындағы амин қышқылдарының, яғни, глютамат айналымының ферменттік механизімін зерттеу үстінде. Бұнда минералдық азоттың сіңіру реакциясын атқаратын НАДФ спецификалық ГДГ анықталғаннан бастап жоғары сатыдағы қсімдіктердегі гютаматтың ыдырауының жалғыз ғана жолы белгілі болатын. Ол глютаматдегидрогеназа (ГДГ) арқылы глютаматты тотықтыру жолы. Метоболиттік процес күшейген кезде бұл амид глютамин қышқылына айналады, ол айналымында маңызды роль атқарады. Глютамат өсімдік өсуі үшін өте қажетті НАДН және 2-оксоглютарат субстраттарының негізгі көзі ретінде қызмет етеді. Глютамин қышқылымен тотығып дезаминденуі глтаматдегидрогеназа ферментінің қатысуымен жүзеге асады, нәтижесінде оксоглютарат түзіледі. Метоболизімнің осы сатысында клетканың азотпен қуат алмасуының негізгі жолдарын туғызады. Яғни, глутамат алмасуының сапалы деректерін негізге ала отырып, өсімдіктердің әртүрлі стресс жағдайларына төзімділігіне биохимиялық баға беруге болады /5/. Осы бағытта Гильманов М. К. басқаруымен глютаматтың қайтымсыз ыдырау нәтижесінде маңызды метоболиттер - L-кетоглутарат, аспартат, НАДН түзілетін реакцияны жүзеге асыратын МДГ-ГОАТ комплексті ферментті зерттеуде. Бұл фермен ттік комплекс мынадай реакциялар реттілігін жүзеге асырады. Бірінші атқаратын реакциясы малатдегидрогеназа арқылы алма қышқылы кофермент НАД қатысуымен қымыздық сірке қышқылына дейін тотығады және осы кезде НАД коферменті НАДН-қа дейін тотықсызданады. Содан кейін қатысуымен оксалоацетат глютаматпен трансаминизациялық реакцияға түседі. Осы реакция нәтижесінде глютамат 2-оксалоглютаратқа, ал оксалоацетат аспартатқа айналады. өсімдіктердің өнуі мен өсуі процестерінде тұздың әсерінен туатын өзгерістердің болуын осы ферменттік комплекс арқылы сипаттауға болады, яғни, комплексті ферменттің активтілігімен өсімдіктердің өмір сүруге қабілеттілігі, әртүрлі факторларға төтеп беруі, тіпті иондық қызметтерінің арасында байланыстық болуы мүмкін /6/.
Глютамин азоттың минералдық формаларымен қатар, өсімдіктерде азоттың тасымалданушы формасы болып табылады және де пісіп келе жатқан тұқымдарға келіп түсетін осы элементтің негізгі бөлігін құрайды. Сонымен қатар өсімдіктің өсуінде де органикалық азоттың тасымалдануында оның елеулі оль атқаруы мүмкін. Бидайдың жапырақтарына радиоктивті С глютаматты ендірген, мынадай маин қышқылдары, органикалық қышқылдар СО және қант фосфаттары сияқты радиоактивті құраған. Глютамат және глютамин фототыныс алу кезінде түзілетін аммонидің реассимиляциясына жауап беретін ГОГАТ цикілге тікелей қосылатын екі қосылыс.
Сонымен, глютамин және глютамин қышқылы арқылы азоттың әртүрлі өсімдіктерге тән өзіндік бағыттағы көмірсу алмасуын қарқынды өндіретін көміртегі ізашарлармен түйісуі жүреді. Тек осы амин қышқылдарының алмасуы арқылы көмірсу және азот алмасуы арасында өзара қарым қатынас болады. Сонымен қатар глютамин қышқылы және глютаминнің қатысуымен жүретін реакциялар амин қышқылдарының синтезі мен катаболизімін трансаминдік реакциялармен үйлестіру жолымен бір жерде шоғырландыруға мүмкіндік береді. Нәтижесінде протеингенді амин қышқылдарының әрбіреуінде дегидрогеназалары болатындығындай эффект береді.
Әртүрлі амин қышқылдарынан транс аминазалар көмегімен жинақталған амин топтары соңында L-глтамин қышқылының а-топтарына айналады, ал ол глютаматдегидрогеназа ферментінің әсерінен тотыға дезаминденеді. Бұл ферменттің бидай дәнінен анықталуына 50 жылдан астам уақыт өтті.
Глютаматдегидрогеназа 2-оксоглютар және глютамин қышқылдарының өзара бір біріне айналуын катализдейді, сол кезде аммони неорганикалық азот және а-аминдік азоттың өзара бір - бірімен айналуы қатар жүреді. Глютаматдегидрогеназа жануарларда, өсімдіктерде және микроорганизмдерде ең көп тараған ферменттердің бірі болып саналады. Қазіргі кезде бұл ферменттің кездеспейтін организм жоқ дерлік.
Көптеген зерттеулер арқылы ферменттің активтілігі митохондрия бөлшектерінің фракцияларымен байланысты ғана емес, көбінесе сол жерде жинақталатындығы көрсетілген. Бұршақтың өскіндеріндегі митахондрияларында ГДГ-ның клеткадағы 70%-ке дейінгі барлық активтілігі анықталған. ГДГ аспартаттрансаминаза және малатдегидрогеназа секілді, митахондриялардың мембраналарында емес, матриксте шоғырланатындығы анықталды.
Митахондрияға тән өзіндік қасиеті, ол глютаматтың тотығуы парацесіне активті түрде қатысады. Соның нәтижесінде, ондағы ГДГ тек аминденуші бағытта ғана емес, сонымен қатар дезаминденуші бағытта да активті болады және ГДГ-ның осы қызметтерін зерттеу жаңаша ерекше қызыметтерін тудырады. Осы мақсатпен бұршақтың өскіндерінің гипокотильдеріндегі митахондрияларында зерттеулер жүргізілді. Митахондрияда болған немесе жаңадан түзілетін әртүрлі субстраттар, сонымен бірге Кребс цикылының қышқылдары да концентрцияларына байланысты аминденуші немесе дезаминденуші бағыттарында ГДГ активтілігін аса реттегіш болып табылады. Кребс цикылының субстраттары ( цитрат, изоцитрат, фумарат, сукцинат) төменгі концентрацияда дезаминдену активтілігін, ал жоғарғы концентрацияда 2-оксоглютараттың а-амтиндену тежеген. Амин қышқылдары және амидтер ( аспартат, аспарагин, глютамин, аланин ) глютаматтың дезаминденуін тежеген, аминденуіне еш әсер етпеген. Митахондриядағы НАДН төменгі концентрацияда ГДГның дезаминденуші активтілігін тежеген.
Дэй және басқада авторлар сояның жапырағы мен тұқым жарнағындағы митахондрияларындағы глютаматтың тотығуын зерттеген. Тұқым жарнағындағының пайда болған кезінен бастап (4-5 тәуілік) және 24-күндік кезіне дейін тұқым жарнақтары мен жапырақтарындағы ГДГ ның тотықтырғыш активтілігін тазартылған митахондриялардан анықтаған. Глютаматтың тотығуы реакциясын О тұтынуына байланысты болған. Сояның тұқым жарнақтарының оқшауланған митахондрияларында глтаматтың тотыға дезаминденуі реакциясында ГДГ-ның активтілігінің динамикасы өзгеше болды: тұқымды сепкеннен кейінгі 2-ші күнінде активтілігі жоғары, 7-ші күнге дейін максимумға жеткен, содан кейін тұқым жарнағының қаратюы кезінде бір төмендеп, бір өсіп отырған. Авторлар тотығуы өскіндерінің өсуі кезеңінде қорлық қосылыстардың мобилизациялануына және амин қышқылдарының метоболизәмәне әсер етеді деген болжау айтқан. Жапырақтар мен қартайып келе жатқан тұқым жарнақтарының митахондрияларында басқа субстраттардың тез тотығуымен салыстырғанда (малат), глютаматтың тотығу жылдамдығы онша емес екендігі көрсетілген.
Қазіргі кезде өсімдік клеткасындағы изоферменттері бар екендігі, сонымен қатар олардың аммонидің әсеріне жауап ретінде іріктеліп индукциялануы жайлы материалдар жинақталған. Бірақта бұл изоферменттердің клетка ішінде таралуы жайлы арнаулы зерттеулер әлі күнге дейін аз, сондықтан клетка құрылымдары мен цитазольдағы ГДГ-ның қызыметтері мен қасиеттерін түсіндіріп, талдау жасау қиынға соғады.
Алайда өсімдіктердің түрлік спецификалығын ескере отырып, бұл сұрақты шешу аса қажет. Себебі әртүрлі өсімдіктердегі ферменттердің локализациялануы мен қасиеттерінің өз ерекшеліктері болады. Мысалы балық отында (ряска) ГДГ бір изоферментпен, ал бұршақта жеті изоферментпен болатындығы көрсетілген. Бір қатар көрсеткіштерге байланысты ферменттер ұқсас болып келген: бірдей молекулалық (23000) массасы 58500 болатын төрт бірдей суббірліктер, ұқсас амин қышқылдар құрамы және активтіліктілігін анықтау үшін Са ионының міндетті түрде болуы қажет.
Бидай дәнінің өсу кезі мен пісіп жетілу кезіндегі тура реакцияның (глютаматтың тотыға дезаминденуі) және кері реакцияның (2-оксаглютараттың тотықсыздана дезаминденуі) ара қатынасы зерттелген. Эндоспермде ферменттің, оң екі бағытта катализдейтін реакцияларының активтілігі сумен бөрттіріп қойған алғашқы күндерінде ең жоғарғы, екінші күні екі есе төмендеген, одан кейін төмендеуін жалғастырғаны анықталды. бидай өне бастаған кезде тура және кері реакциялардың ара қатынасы эндоспермде, сонымен қатар қабығында 1:2 ал өскіндерде 1:1 тең ол кейін глютамин қышқылының синтезделуі жағына қарай өзгереді (өскіндері 1:12) . Пісіп жетіле бастаған кезде, гүлденгеннен кейін ГДГның тура және кері реакцияларының жылдамдығының өсуі дәннің 68% -ден 58% -ке дейінгі ылғалдылығында, яғни сүт пісіп жетілу кезеңінде максимумға жеткендігі байқалған. Глютамин қышқылының қатысуымен алмасуының негізгі процестері оның жинақталатын жерінде, яғни бидай дәнінің эндоспермінде жүретіндігі байқалған
Бидай өсімдігінің тамырынан алынған ГДГ-ның гомогенді препораттарындағы тотыға дезаминденуі және 2-оксаглутараттың тотықсыздана аминденуі реакциялардың жылдамдығының қатынасы 1:14 құрған кезде, ал бидайдың тазартылмаған экстракттарындағы глютаматтың тотыға дезаминденуі реакцияларының жоғары діңгейде жүретіндігі ерекше еөңіл аудартады. Мүмкін тазарту процесі кезінде ГДГ-дан жоғары глютаматты ыдырату активтілігі бар басқа фермент бәліп шығаруы мүмкін және ол шынымен де біздің зерттеулерімізде анықталған.
Tsukamoto және Welander бұрынғы жұмыстарында алғаш рет бидайда глютамат тотықтыратын ферменттің бар екендігі көрсетілген, мысал ретінде Welander электрофорез кезінде гелде активтілікті айқындау үшін НАД қажет етпейтін фермент аймағын анықтаған. Өкінішке орай бұл тәжірибе басқа зерттеушілер жағынандұрыс көңіл аударылмауына байланысты ары қарай тәжірибе қойылы, дамытылмай қалды.
Зерттеулер жасау негізінде, біз глютаматтың қайтымсыз ыдырауны жүзеге асыратын ферменттің жаңа түрін анықтадық. Жаңадан ашылған ферменттің түрі жақсы зертелген физико химиялық жағынан ерекшеленеді. Сол арқылы өсімдік органиімінде әсер ету механизімін ашуға мүмкіндік берді.
МДГ-ГОАТ ферменттік комплексінің өсімдіктің метоболиттік процестеріне атқаратын үлкен ролін ескере отырып, өсімдіктердің тұзға төзімділігін осы ферменттің активтілігінің өзгеруімен анықтауға болатындығы дәлелденді /7/.
1. 1. 1. ГДГ-ның глютамат айналымындағы маңызы.
М. Ә. Айтхожин атындағы молекулалық биология және биохимия институтының ферменттердің құрылымы және реттелуі лабораториясында глютаматтың айналымы және оның айналымына қатысатын негізгі белсенді ферменттер жөнінде ондаған жылдар бойы зерттеу жұмыстарын жүргізу үстінде бұл лабораторияның ең үлкен жетісіктерінің бірі болып жоғарғы сатыдағы өсімдіктерде минералды азоттың сіңірілу реакциясын атқаратын НАДФ спецификалық ГДГ-ны алғаш рет бидай дәніне тәжірибе жүргізу нәтижесінде спецификалық субклеткалық құрлымда, шамамен 1мкм мөлшерлі және 1, 07-1, 1 г/см3 жылжымалы тығыздықты -сферасомада анықталды. Сферасома тек бір ғана белоктан - ГДГ-дан, және бір ғана липидтен- фосфотидилинозидтен тұратыны анықталынды /8/. Бидай дәніндегі глютаматдегидрогеназа кофермент ретінде тек НАД-ты ғана спецификалығын таныта алады. Бұл ГДГ аммони иондарына күшті сезімтал фосфорланған фермент түріне жататыны бекітілді. ГДГ өнімінің қалыптасу кезеңіндегі бейорганикалық азоттың қақпаға түсу қызметін атқарады. НАДФ-ГДГ активтенуі цитокининнің бақылауымен жүреді /8/. Бірақта бидай дәнінің ұрықсыз бөлігіне әсер еткенде НАДФ-ГДГ-ның активтілігі байқалмаған. Осыған орай цитокининді ұрықтық бөлімге әсер еткенімізде НАДФ-ГДГ активтенген, яғни, цитокинин ұрықтық бөлімінде екіншілік гормон- цитокинин медиаторды түзген, ол алейрон қабатындағы НАДФ-ГДГ-ны активтейді /9/.
Өсімдіктерде аммонидің ассимиляциянуының негізгі жолы глютаматдегидрогеназа ферментінің қатысуымен а-кетоглутар қышқылының тотықсызданып аминденуінен, глютамин қышқылының пайда болу реакциялары болып есептелінеді /10/.
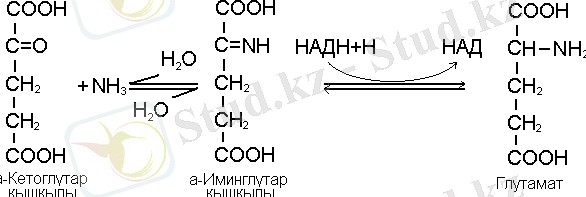
Реакцияның бірінші сатысында субстраттың байланысуынан имин қышқылы пайда болып, екінші сатысында оның тотықсыздануынан НАДФН-тың қатысуымен, глутамин қышқылы түзіледі.
Глутаматдегидрогеназа (ГДГ) барлық өсімдіктердің жапырақтарымен тамырларында болатын фермент. Ол негізінен митахондрияларда, цитоплазма матриксінде, хлоропластарда да кездеседі.
1974 жылы Р. Ли және Б. Мифли аммонидің ассимиляциялануының екі реакция арқылы жүзеге асатын негізгі жолы ашты. Ол реакцияның біреуі глютаминсинтетаза (ГС), екіншісі глютаматсинтетаза (ГТС) ферменттерімен катализденеді /11/.
Сонымен клеткаларда глютамин қышқылымен қатар аминді глутамин де пайда болады. Глютаминсинтетаза глютамин қышқылы аммиакты қабылдап алып глютамин амидті синтезделінетін реакцияны катализдейді.
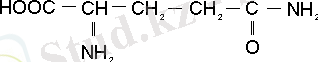
Бұл реакцияның жүруіне АТФ қажет. Глютаматсинтетаза болса глютаминнің амид тобын а-кетоглутар қышқылына ауыстырып, ферредоксиннің қатысуымен, глутамин қышқылының екі молекуласы пайда болатын реакцияны катализдейді. Өсімдікке енген аммиак а-кетоглутар қышқылынан басқа да органикалық қышқылдарға байланысып, тиісті ферменттердің қатысуымен алғашқы амин қышқылдардан түзіледі. Олардың қатарына қымыздық, сірке, пирожүзім, глиоксил және т. б. қышқылдар жатады. Олардың тотықсызданып аминдену (трансаминдену) нәтижесінде, тиісінше аспарагин, серин, глицин амин қышқылдары синтезделінеді.
Глютамин қышқылының амин тобының трансаминдену арқылы басқа қышқылдарға ауыса алатындығы А. Е. Браунштейн жіне М. Г. Крицман зерттеулері нәтижесінде анықталды. Бұл реакцияны катализдейтін ферменттер аминотрансферазалар деп аталады. Мысалы ретінде глутамин қышқылының пайда болуын келтіруге болады /12/.
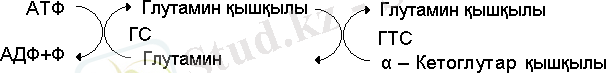
Өсімдіктер аммонимен өте қамтамассыз етілгенде олардың ұлпаларында глутамин және аспарагин сияқты амидтер жиналады /13/.
Жаңа ферменттік әдістәің ашылуы суқоймаларының антропогендік ластануының экологиялық маниторингі бола алады. Одан басқа бұл әдіс клиникалық биохимияда организімнің патологиялық күйін анықтау үшін-бауыр және бүйрек ауруларын, қандағы және зәрдегі аммиак деңгейін анықтау арқылы қолданылады /14/. Лабораториямен аз зерттелген өсімдік клеткаларының органелласы сферасоманы ашуға қол жеткізді.
Қолданылған фермент номенклатурасы бойынша окси-ферментке арнайылығына қарай үш түрі бар:
- НАД- қа арнайы ГДГ (1. 4. 1. 2. ) ;
- НАД-қа да, НАДФ-қа да активтілігін бірдей көрсететіy ГДГ(1. 4. 1. 3. ) ;
- НАДФ- қа арнайы ГДГ.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz