Fusarium solani-мен зақымдану кезіндегі картоптың (Тамаша және Санта) супероксидсинтазалық сигналдық жүйе ферменттерінің қорғаныс реакциялары


ӘЛ-ФАРАБИ АТЫНДАҒЫ ҚАЗАҚ ҰЛТТЫҚ УНИВЕРСИТЕТІ
БИОЛОГИЯ ФАКУЛЬТЕТІ
МАГИСТРАТУРАСЫ
Биотехнология, биохимия, өсімдіктер физиологиясы кафедрасы
МАГИСТРЛІК ДИССЕРТАЦИЯ
СУПЕРОКСИДСИНТАЗАЛЫҚ СИГНАЛДЫҚ ЖҮЙЕ ФЕРМЕНТТЕРІНІҢ КАРТОПТЫҢ F. SOLANI САҢЫРАУҚҰЛАҒЫМЕН ЗАҚЫМДАНУ КЕЗІНДЕГІ ҚОРҒАНЫС РЕАКЦИЯЛАРЫН ЗЕРТТЕУ
Орындаған:
2-курс магистранты Байқара Б. Т.
Ғылыми жетекшісі:
б. ғ. к., ЖҒҚ Сапко О. А.
“__” 2010 жыл
б. ғ. д., профессор Бейсембаева Р. У.
“__” 2010 жыл
Қорғауға жіберілді:
Кафедра меңгерушісі:
б. ғ. д., профессор Карпенюк Т. А.
“__” 2010 жыл
Алматы, 2010
РЕФЕРАТ
Магистрлік диссертация 44 бет, 12 сурет, 1 кесте, 1 сызбанұсқа, 53 әдебиет тізімінен тұрады.
Негізгі сөздер: оттегінің белсенді формалары, F. solani саңырауқұлағы, картоп, Тамаша және Санта сұрыптары, патогенез, супероксидсинтазалық сигнальды жүйе, супероксид-дисмутаза, аскорбат-пероксидаза, каталаза, пероксидаза.
Зерттеу объектісі: Республикалық микроорганизмдер коллекциясынан алынған F. solani саңырауқұлағының F-RKM 0166 (патогенді) және F-RKM 0167 (патогенсіз) штаммдары және Тамаша (төзімді сұрып) және Санта (сезімтал сұрып) картобының түйнектері мен суспензиясы.
Жұмыстың мақсаты: картоптың саңырауқұлақпен зақымданғандағы оттегінің белсенді формаларын реттеуге қатысатын антиоксидантты ферменттердің қызмет ету механизмдерін зерттеу.
Міндеті: картоптың саңырауқұлақпен зақымдану кезіндегі қорғаныс жауабындағы антиоксидантты жүйе ферменттерінің қызметін зерттеу. Fusarium solani - Solanum tuberosum жүйесіндегі паразит-қожайынның өзара әсерлесуі кезіндегі Н 2 О 2 сигнальді қызметінің іске асуын анықтау. Fusarium solani саңырауқұлағының патогенді және патогенсіз штаммдарыдағы SOD функциясына экзогенді Н 2 О 2 әсерін зерттеу.
Нәтижелер: картоптың төзімді (Тамаша) және сезімтал (Санта) сұрыптарының F. solani саңырауқұлағының патогенді және патогенсіз штаммдарымен зақымдану кезіндегі супероксидсинтазалық сигнальды жүйе ферменттерінің корғаныс реакциялары зерттелді.
F. solani-S. tuberosum жүйесіндегі өзара әсерлесуінің іске асуында тотығу-тотықсыздану процестері маңызды роль атқаратынын дәлелдейді. Картоптың Fusarium solani зақымданған кездегі каталаза реактивтілігін талдау биохимиялық маркері ретінде пайдалауға болады.
Саңырауқұлақпен зақымдану кезіндегі Н 2 О 2 эндогенді деңгейінің өзгеруі қожайынның төзімділігі мен саңырауқұлақтың патогенділігіне тәуелді.
SOD ферментінің активтілігінің реттелуі штамм патогенділігі мен оның орналасуына тәуелді болады.
Зерттеу жұмысы Айтхожин атындағы молекулалық биология және биохимия институтының табиғи қосылыстар зат алмасу энзимологиясы лабораториясында жүргізілді.
Мазмұны
Белгілеулер мен қысқартылған сөздер
ОБФ - оттегінің белсенді формалары
NADPH - (тотықсызданған формасы)
NOX - NADPH-оксидаза
SOD - супероксид-дисмуаза
APOX - аскорбат-пероксидаза
As - аскробат
GSH - глутатионның тотықсызданған формасы
GSSG - глутатионнның тотыққан формасы
GR - глутатион-редуктаза
NADH - (тотықсызданған формасы)
NADP - (тотыққан формасы)
NAD - (тотыққан формасы)
FAD -
GR - глутатион-редуктаза
САТ - каталаза
КІРІСПЕ
Өсімдіктердің стрестік жағдайларға бейімделу механизмдерін зерттеу қазіргі заманғы биологиялық зерттеулердің перспективті бағыттарының бірі. Зерттеушілердің назары көбінесе өсімдіктердің патогендердің әсеріне биохимиялық және молекулалық жауап механизмдерінің өзекті мәселелеріне, солардың ішінде қорғаныс жауабына сигналдық жүйелердің қатысу ерекшеліктерін анықтауға бағытталуда.
Өсімдіктердің қорғаныс механизмдерін идентификациялау - негізгі ауыл шаруашылық дақылдарының өнімділігін арттыру мақсатында төзімділік табиғатын түсіну өте маңызды.
Клеткалардың сигналдық жүйелері өсімдіктердің патогендерге қарсы иммунитеттің қалыптасуында үлкен роль атқаратыны көрсетілген [1] .
Өсімдіктерді әр түрлі ауру қоздырғыштармен зақымдау мультикомпонентті жауап ретінде қарастырылатын, әдетте метаболитикалық өзгерістердің каскадын шақыратын кең тараған стрестік әсер болып табылады. Олар биосинтезге қатысатын полисахаридтер, фенолдар, лигнин, суберин, фитоалексиндер, фитонцидтер мен ферменттердің, гидроксипролинге бай белоктардың жинақталуы, “pathogensis-related” (PR) -белоктарының, атап айтқанда, хитиназа, глюканаза, протеиназа ингибиторлары, басқа да стрестік белоктардың (пероксидаза және т. б. ) синтезін индукциялауды және деңгейін жоғарлатуды жүзеге асырады. Патогендермен зақымдалған кезде өсімдік клеткаларында ген экспрессиясының қайта программалануы жүреді, ол бір белоктардың синтезінің төмендеп, басқасының түзілуі немесе зақымданбаған өсімдіктердің ұлпаларында кездеспейтін белоктардың пайда болуында көрінеді. Бұл сигналдық қосылыстар - элиситорлардың көмегімен жүзеге асатыны анықталған [1] .
Өсімдік клеткаларының сигналдық жүйесін зерттеу, олар стрестің молекулалық механизмдерінің негізін құраушы ретінде ғана үлкен теориялық маңыздылыққа ие емес, сонымен қатар сигналдық жүйелердің табиғи элиситорлар мен интермедиатор негізінде эффективті антипатогенді препараттар жасап шығаруда практикалық маңыздылығы да бар.
Картоп - құнды ауыл шаруашылық дақылы. Ал оның өнімділігінің төмендеуі әр түрлі фитопатогенді саңырауқұлақтар мен вирустар тудыратын аурулар. Біздің ел үшін ең өзектісі, картоптың құрғақ фузариозды шіруі. Картоптың құрғақ фузариозды шірігі ауруының қоздырғышы - фузариум туысының әр түрлі саңырауқұлақтары ( Fusarium solani ) .
Келесі бөлім - әдебиетке шолуда сигналдық жүйелердің негізгі ферменттерінің патогенге қарсы қызмет ету механизмдері көрсетілген.
- НЕГІЗГІ БӨЛІМСтрестік әсер кезіндегі оттегінің белсенді формаларының қызметі
Н. А. Бах биологиялық тотығудың асқын тотық теориясын ашқаннан бері 100 жылдам астам уақыт өтті (1897 ж. ) . Биологиялық тотығу теориясының негізінде биологиялық жүйелердегі оттегі молекуласын алдын ала активтендіру қажеттілігі жатты. Бах өз жұмыстарында өсімдіктер мен саңырауқұлақтар клеткасында оттегінің асқын тотығын (H 2 O 2 ) тауып, оны эксперимет жүзінде дәлелдеді.
Оттегінің белсенді формалары (ОБФ) саңырауқұлақтарда метаболиттік белсенділік процесінде түзіледі. ОБФ түзілуі әр түрлі стресстік факторлар әсерімен, сонымен қатар ашығу, жарық, механикалық зақымдалу, басқа тірі объектермен әсерлесу кезінде өсіп отырады [2] .
Бос радикал дегеніміз ішкі қабатында бір немесе бірнеше жұптаспаған электрондар бар бөлшектер (атом немесе молекула) . Бұл жағдай радикалдарды химиялық тұрақсыз және өте белсенді етеді, өйткені олар өздеріне жеткіліксіз электронды қоршаған молекулалардан алуға немесе артық электроннан құтылуға тырысады. Соның нәтижесінде биологиялық құрылымдарды бұзатын басқарылмайтын тізбектік реакция дамуы мүмкін [3] .

Сурет 1 - Кейбір молекулалар мен радикалдардың электрондық құрылымы
Әдетте бос радикалдар организмде аз мөлшерде кездеседі және сау организм оларды бақылайды. Кейбір бос радикалдарды иммундық жүйе өндіреді. Олар вирустар мен бактерияларды бұзады. Басқа бос радикалдар маңызды гормондар синтезіне және тіршілік етуге қажетті ферменттерді белсендетуге қатысады. Бос радикалдар организмге қажетті энергия және әр түрлі субстанциялар өндіру үшін керек.
Көптеген бос радикалдардың түзілуі олардың одан да көп мөлшерінің түзілуін ырықтандырады, ол организмді үлкен шығынға ұшыратады. Нәтижесінде бос радикалдардың қауіпті мөлшері бар ортада генетикалық мәліметтің клеткамен кодталу әдісі өзгеріп, белок құрылымы бұзылуы мүмкін. Иммундық жүйе бөтен белоктарды танып, оларды жоюға тырысады. Соңында мутацияға ұшыраған белоктар иммундық жүйені бұзады. Ол лейкемия және ісіктің басқа түрлеріне, жүрек және басқа ауруларға шалдықтыруы мүмкін.
Бос радикалдар қорғаушы клетка мембранасын бұзуға қабілетті, организмде сұйықтықтың жинақталуына әкелуі мүмкін, ол организмнің жылдам қартаюына ықпал етеді. Сонымен қатар, осы кезде организмдегі кальций деңгейі бұзылып, бұл да әр түрлі ауруларға душар еткізеді.
Бос радикалдардың түзілуіне әр түрлі факторлар, атап айтқанда: радиациялық сәулелену, күнде үзақ сәулелендіру, қоршаған ортаны ластаушы заттар - темекі түтіні, көлік пайдаланған газдар, майға бай диета әсер етеді.
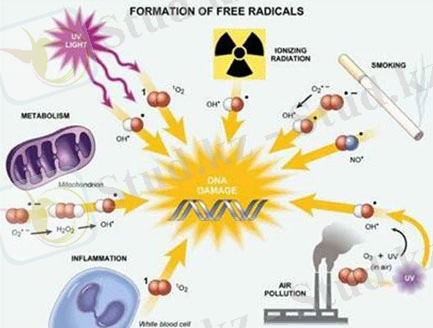
Сурет 2 - Бос радикалдардың қалыптасу механизмдері және олардың ДНҚ тізбегін шабуылдау жолдары.
Тотығу стрессінің дамуының алғашқы сатысы - активтілігі жоғары оттегінің бос радикалды формаларының шектен тыс түзілуі болып табылады. Бұның себебі, митохондрия қызметінің бұзылуы мүмкін. Түзілген оттегінің бос радикалды формалары фосфолипидтерге, атап айтқанда олардың құрамына енетін және фосфолипидтердің ыдырауы кезінде босап шыққан қанықпаған май қышқылдарына әсер етеді де, оларды асқын тотықты тотығуға ұшыратады. Осы тотығу кезінде белгілі қышқылдардың зақымдаушы қасиеті мен тотығудың токсинді өнімінің бос радикалды формалары түзіледі. Нәтижесінде клетка құрылымының бұзылуы мен тіпті клетка өлімге де ұшырауы мүмкін. Бос радикалды тотығудың бірізді реакциясы сызбанұсқада көрсетілген [4] .
O
2
O
2
-
H
2
O
2
OH
-
H
2
O
супероксид- оттегінің гидроксилді
анионрадикал асқын тотығы радикал
Фосфолипидтер
(қанықпаған май қышқылдары)
Аралық өнімдер
(алкильді, алкоксильді, пероксильді радикалдар)
Біріншілік өнімдер
(липидтердің гидро асқын тотығы, диенді конъюгаттар және т. б. )
Екіншілік өнімдер
(малонды диальдегид, триенді конъюгаттар және т. б. )
Соңғы өнім
(Шифф негіздері және газ тәріздес қоспалар)
Сызбанұсқа 1 - Бос радикалды тотығудың бірізді реакциясы
Оттегінің белсенді формасы (ОБФ) - өте күшті тотықтыру қабілеті бар оттегі туындыларының бос радикалды молекулалардың тобы. Олар әдетте тыныс алу тізбегі жұмысының жанама өнімдері болып табылады.
Қазіргі уақытта өсімдіктерге көптеген стресстік факторлармен әсер ету кезіндегі ең ерте пайда болатын стрестік реакция - оттегінің белсенді формаларының (ОБФ) түзілуі: супероксидті анион (O 2 - ), сутегінің асқын тотығы (H 2 O 2 ), гидроксильді радикал (OH - ) және т. б [5] .
Тірі организмдердің метаболиттік жолына оттегінің қатысуы оның активтілігі мен бірқатар реакцияға түсуге қабілетті молекулалардың түзілуімен байланысты: клеткада ішкі және сыртқы факторлардың әсерінен оттегі қозған синглетті ( 1 O 2 ), супероксид радикалы (O 2 − ), гидроксильді радикал (OH • ), асқын тотықты радикал (HO • 2 ), асқын тотықты ион (HO 2 − ), оттегінің асқын тотығы (H 2 O 2 ), азот оксиді (NO • ) күйінде болады.
Қазіргі уақытта O 2 − клеткадағы негізгі көзі тыныс алу процесі нәтижесінде оттегінің суға дейін толық тотықсызданбауы болып табылады. Сонымен қатар, реакцияларда супероксиданион-радикал (O 2 − ) ксантиноксидаза, микросомалық монооксигеназа, липоксигеназа, циклогексеназалардың қатысуымен және де тиолдар, флавиндер, хинондар, катехоламиндер, ксенобиотиктердің тотықсызданған айналымының өздігінен тотығуы нәтижесінде пайда болады.
ОБФ клеткаішілік деңгейінің жоғарылауы өсудің тоқталуымен және клеткаішілік оксиданттардың түзілуінің төмендеуі және клетканың өзгерген тіршілік ету жағдайына бейімделуіне бағытталған морфологиялық өзгерістерді тудырады [6] . Н 2 О 2 барлық тыныс алатын клеткалардағы ең маңызды метаболиттердің бірі болып табылады. Сутегінің асқын тотығы ОБФ маңызды компоненті және клетка активтілігін реттейді. Н 2 О 2 антиоксидантты қорғаныстың гендер экспрессиясын индуцирлей отырып, Aspergillus nidulans транскрипцияның біршама өзгеруін тудырады [7], сонымен қатар, склероция Sclerotium rolfsii дифференцирленуін ырықтандырады [8], Neurospora crassa картиногенезінің гендер экспрессиясының деңгейін жоғарлатады, және Ustuilago maydis филаментті өсуге өтуіне және оның патогенділігінің пайда болуына ықпал ететіні көрсетілді [9] . S. rolfsii дифференцирленуі клетка ішінде Н 2 О 2 түзілуімен байланысты, оның концентрациясы жарық пен темір иондарының әсерімен жоғарлап отырды. Осылайша, саңырауқұлақтарда, миксомицеттерде және балдырларда ОБФ түзілуі дифференцирлену факторы үшін өте қажетті [8] .
ОБФ биохимиялық эффекттерінің кең спектрі және олардың клетканың функциялық активтілігіне әсері, зерттеудің осы бағытына қызығушылық артып отырғанын түсіндіреді. ОБФ реакциялық қабілеті жоғары болғандықтан, ол кез келген макромолекулаларды зақымдай алады. Липидтердің асқын тотығуы, белоктар мен нуклеин қышқылының тотыға модификациялануы - оттегі радикалдарының токсинді әсерінің нәтижесі. ОБФ төмен концентрациясы эукариоттардың әр түрлі клеткалық қызметтерін, атап айтқанда пролиферация, гормондар синтезі, тотығу “жарылысы”, апоптоз және басқаларын реттеуге қатысуға қабілетті. Токсиндік әсерінен басқа ОБФ реттеуші активтілігі бірқатар патологиялық күйлердің ажырамас бөлігі болып табылады. Эукариот клеткаларында ОБФ клетка аралық сигналдық молекулалардан және олардың мембраналық рецепторларынан ген экспрессиясын бақылаушы клетка ішілік реттеуші жүйелерге реттеуші сигналды беру кезінде мессенджерлер ретінде қызмет атқарады [10] .
Тотығу жарылысы - фитопатогенді саңырауқұлақтың өсімдікпен өзара әсерлесуі кезінде ОБФ шамадан тыс бөлініп шығуы. Осы уақытқа дейін ОБФ бірден бір көзі өсімдік деп есептелген болатын [11] . Бірақ Док әріптестерімен өз жұмыстарының бірінде Phytophthora infestans саңырауқұлағы Н 2 О 2 көзі болып табылады деген болжам ұсынды [12] . ОБФ спора суспензиясында немесе жапырақ бетінде ғана емес, сонымен қатар, сәйкес клеткасыз диффузаттарда да табылғаны маңызды. Клеткадан бөлініп шыққан Н 2 О 2 диффузатта ондаған минуттар бойы сақтала алады [13] . Осылайша, патогенді саңырауқұлақ клеткаларында кездесетін немесе олармен клеткадан тыс ортаға бөлінетін кейбір элиситорлар немесе токсиндер қожайын организмді және паразитті тотығу стрессіне ұшыратады. Бұл құбылыстың биологиялық әсері әр түрлі жағдайларда тура қарама-қарсы болуы мүмкін, яғни ол инфекцияға ықпал етуі де және де оған қарсы әсер етуі де мүмкін. ОБФ көп жағдайда фитопатогенді саңырауқұлақ пен қожайын өсімдіктің өзара әсерлесуін, сонымен қатар, көптеген жағдайларда - өсімдіктің ауруға төзімділігін жоғарлататын фактор ретінде анықталады [11] .
Тотығу “жарылысы” өсімдіктердің қорғау реакцияларының биологиялық индукторлары - элиситорлармен іске қосылатыны анық. Элиситорлық қасиетке паторгенді саңырауқұлақтардың көптеген метаболиттері ие. Элиситорлардың өздері ОБФ өндірмейді, бірақ олар бар ортада саңырауқұлақ клеткалары өсімдіктер жағынан тотығу стрессіне ұшырайды. Сондай-ақ, ОБФ әсерімен элиситорлық активтілікті индукциялау мүмкін. H 2 O 2 төмен концентрациясы сигналды молекула болып табылады және өсімдік клеткасында қорғаушы метаболиттердің синтезін ырықтандыратыны анықталған. ОБФ генерациялайтын саңырауқұлақтарға арналған кейбір арнайы әдістер токсиндермен байланысқан, олар үшін O 2 - қожайынды улайтын делдал ретінде қызмет атқарады. Соның ішінде, Fusarium туысының саңырауқұлақтарының нафтазарин токсині өсімдік субстраттарымен қараңғыдағы тотығу - тотықсыздану реакцияларында ОБФ генерациясы жүреді. Fusarium туысы саңырауқұлақтарынан бөлініп алынған биаувертицин және Т-2 токсиндері, сонымен қатар қызанақ өсімдігінің аскорбат - глутатионді айналым ферменттерін активтендіреді [11] .
1. 2 Фитопатогенді саңырауқұлақтардың өсімдіктермен өзара әсерлесуі кезіндегі ОБФ түзілуі
Өзара тығыз әсерлесетін әр түрлі организмдерден тұратын жүйеде барлық жағдайда, жаңа өнім пайда болады. Осы жерде олар қай организмге тиесілі деген сұрақ туындайды. Бұл қожайын-паразит жүйесінде көп кездеседі [13] .
ОБФ қатысуымен фитопатогенді саңырауқұлақ пен өсімдіктің өзара әсерлесуінің мысалы ретінде, өсімдіктердің қорғаныс реакцияларының биологиялық индукторлары - элиситорлармен іске қосылатын тотығу жарылысы бола алады. Мұндай қасиетке фитопатогенді микроорганизмдердің, атап айтқанда саңырауқұлақтардың көп метаболиттері ие. Химиялық табиғаты жағынан элиситорлар әр түрлі, бірақ өсімдікке әсер етуі нәтижелері жағынан ұқсас. Элиситорлардың өздері белсенді оттегіні өндірмейді, бірақ олар ортада бар болған жағдайда саңырауқұлақ клеткалары өсімдік тарапынан тотығу стресіне ұшырайды. Элиситин белоктары [14], арахидон қышқылы [15], саңырауқұлақтың клетка қабықшасының көмірсу компоненттері [16] сияқты элиситорлардың әсерінен туындаған тотығу жарылысы жайлы мәліметтер көп жазылған. Бұл құбылыс басқа да қорғаныс реакциядарының маңызды буыны болуы мүмкін, мысалы фитоалексиндердің синтезі [15] .
Тотығу жарылысы кезінде - фитопатогенді саңырауқұлақтың өсімдікпен өзара әсерлесуі кезінде ОБФ шамадан тыс бөлініп шығатыны мәлім. Осы уақытқа дейін ОБФ бірден бір көзі өсімдік деп есептелген болатын [11] . Бұл өнімдердің түзілуіне саңырауқұлақтардың қандай да бір қатысы бар деген сұрақ мүлдем қарастырылмады. Док әріптестерімен өз жұмыстарының бірінде Phytophthora infestans саңырауқұлағы Н 2 О 2 көзі болып табылады деген болжам ұсынды /16/. ОБФ спора суспензиясында немесе жапырақ бетінде ғана емес, сонымен қатар, сәйкес клеткасыз диффузаттарда да табылғаны маңызды. Клеткадан бөлініп шыққан Н 2 О 2 диффузатта ондаған минуттар бойы сақтала алады [13] .
Өсімдіктердің микроорганизмдермен өзара әсерлесуі ОБФ - супероксиданион-радикалы (O 2 - ) және сутегінің асқын тотығының (Н 2 О 2 ) деңгейлері өзгереді. Фитопатогенез кезінде ОБФ деңгейі қожайын өсімдіктің патогенді микроорганизмге төзімділігіне әр түрлі дәрежеде жоғарылайды. ОБФ жоғарылауы олардың өсімдікті қорғау реакцияларына қатысуына байланысты. ОБФ сезімталдығы жоғары реакцияны дамытатын басты фактор екендігі белгілі. Бұл кезде ОБФ тікелей антибактериялық агенттердің, сонымен қатар, қорғаныс механизмдерін қосушы сигнальдық интермедиаторлардың қызметін атқарады және инфекциялану кезінде кедергі механизмі ретінде клетка қабырғасын қатайтуға қатысады [17, 18] .
Өсімдіктердің инфекцияға қарсы реакциясы әдетте патогенді организмдердің элиситорларымен индуцирленеді. Көптеген жағдайларда сәйкес реакциялар өсімдік плазмалеммасында орналасады. Егер саңырауқұлақ элиситоры клетка қабырғасына бекінген болса, онда рецептормен өзара әсерлесу үшін инфекциялық гифтің өсімдіктің клетка қабығын тесуі арқылы енуі қажет болады [5] .
Метлицкий өз әріптестерімен “қос индукция” гипотезасын ұсынды [19] . Ол бойынша, қожайын өсімдік паразит элиситорын байланысқан күйде шығарылуын жүргізіп, осылайша рацепторлармен өзара өсерлесуді тездетуі мүмкін. Бұндай рольді, мысалы, элиситорлік қасиет көрсететін саңырауқұлақтың клетка қабығының фрагменттерінен босап шығатын өсімдіктің литикалық экзоферменттері атқарады [20] .
Соңғы жылдары симбиоздық өзара әсерлесуі кезінде қожайын өсімдік инфекцияға ОБФ деңгейінің өзгеруімен жауап беретіндігі жайлы жұмыстар пайда болды. Бірақ қазіргі мәліметтер бір біріне қарама қайшы, ал симбиоз кезіндегі ОБФ физиологиялық қызметі әлі анық емес [21] .
Sinorhizobium meliloti -мен зақымдалған жоңышқа ( Medicago sativa L. ) тамырын электронды микроскоппен зерттеген кезде бактерияның өзінде емес, бактерияны қоршайтын инфекциялық жіпше матриксінде ОБФ локальды түзілулері болатындығы көрсетілді [22, 23] . Бұл мәліметтер тамырға енген ризобиялар қожайын өсімдіктің бақылауында болатындығын және реттеуге ОБФ қатысатынының дәлелі. Алайда мұндай жұмыстар әлі аз.
Өсімдіктегі басқа да факторлар элиситордың саңырауқұлақтан босап шығуына ықпал етуі мүмкін. Өсімдік мүшелерінің бетінде [5, 20], әдетте, күріш жапырағының инфекциялық тамшыларында [24] ОБФ - сутегінің асқан тотығы және супероксид радикалы табылған. Олардың өнімі инфекцияға жауап ретінде, соның ішінде жапырақтардың және күріш каллустарының пирикуляриоз қоздырғышының ( Magnaporthe grisea ) спораларымен зақымданғанда күшейеді. Сау өсімдіктерде ОБФ клеткадан тыс фондық деңгейі болады [25] .
1. 3 Антиоксиданттар
Антиоксиданттар (гр. anti - қарама-қарсы, қарсы әсер ету деген мағына береді, және oxys - қышқыл) (антитотықтырғыштыр - тотығу ингибиторлары) липид, белок және көмірсутектер сияқты полимерлердің құрылымын бұзатын, тотығу процестерін тежейтін немесе болдырмайтын заттар.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz