Инсулин, интерферон және реттеуші пептидтерді микроорганизмдер көмегімен өндіру: гендік инженерия әдістері


Әл-Фараби атындағы Қазақ ұлттық университеті
Биология факультеті
РЕФЕРАТ
Микроорганизмдер көмегімен инсулин, интерферон және реттеуші пептидтерді өндіру
Орындаған: І курс магистранты
Арбаканова Д. С.
Тексерген: б. ғ. д., профессор
Кенжебаева С. С.
Алматы 2008
Жоспар:
Кіріспе
Гендік инженерияның мүмкіндіктері . . . 2
Негізгі бөлім
- Инсулин өндірісі . . . 4
А) лейцин-энкефалин мен брадикинин синтезі . . . 6
Ә) Соматостатинді алу . . . 8
- Соматотропин синтезі . . . 9
- Интерферонды алу . . . 11
Қорытынды . . . 15
Қосымша мәліметтер . . . 17
Пайдаланған әдебиеттер тізімі . . . 24
Гендік инженерия биотехнологияның маңызды құрамдас бөлігі болып табылады. 70-жылдары пайда болған бұл ғылым қазіргі күні үлкен жетістіктерге жетіп отыр. Гендік инженерия әдістерінің көмегімен бактериялар, ашытқылар, өсімдік және жануарлар клеткалары емдік белокты кең көлемде өндіретін «фабрикаларға» айналды. Бұл белоктардың құрылысы мен қызметін терең зерттеп, оларды емдік қосылыстар ретінде қолдануға мүмкіндік береді. Рекомбинантты ДНҚ технологиясының дамуының нәтижесінде эукариот гендерін бөліп алып, гетерологиялық жүйелерде экспрессиялауға болады. Қазіргі күні гендік инженерия әдістерінің көмегімен прокариот және эукариот клеткаларында қызмет етуге қабілетті генетикалық жүйелер құрастырылады. Бұл мүмкіндік жаңа құнды қасиеттері бар, мысалы эукариот белоктарын синтездеу, организмдерді құрастыруға жағдай жасады. Белокты өнімдердің арасында гормондар сияқты биологиялық активті қосылыстар үлкен қызушылық туғызуда. Олардың ішінде белокты және пептидті гормондар маңызды орын алады. Медицинаға өте қажет бұл қосылыстар жануарлар ұлпаларынан экстрациялау арқылы алынған. Салыстырмалы түрде қысқа пептидтерді химиялық синтезбен алуға тырысқан. Алайда бұл әдіс өте тиімсіз болып шықты. Жоғары түрлік спецификасы бар кейбір гормондар өліктерден алынылды.
Гендік инженерияның мүмкіндіктері маңызды гормондарды микроб клеткаларында синтездеп, көп мөлшерде алуға үміт берді. Қазіргі күнге дейін көптеген пептидті гормондар рекомбинантты ДНҚ технологиясы көмегімен өндіріледі (1-сурет) .
Емдік қосылыстар болып табылатын түрлі адам белоктарының 400 астам гендері (негізінен кДНҚ түрде) клондалды (1-кесте) . Алайда олардың көбі клиникалық тексерулер үстінде. Мамандардың есептеуінше, адам белогы негізіндегі емдік қосылыстардың көлемі шамамен 150 млрд. АҚШ долларын құрайды және бұл сан үнемі артып отыр.
1-кесте. Гендік инженерия әдістерінің көмегімен алынған кейбір белоктар
Адренокортикотропты гормон
α 1 -Антитрипсин
Бактериоцидті/өткішгіштікті жоғарлатушы белок
Гемоглобин
Өсу гормоны (соматотропин)
Инсулин
Инсулинтекті өсу факторы
Интерлейкиндер
Интерферондар
Кальцитонин
Лимфотоксин
Мида түзілетін нейротропты фактор
Релаксин
Интерлейкин-1 рецепторы
Соматолиберин
Соматомедин С
Сарысу альбумині
Тиреотропты гормон
Плазмогеннің ұлпалы активаторы
Өсудің тромбоцитарлы факторы
Урагострон
Урокиназа
Макрофагтарды активтендіретін фактор
Ісік некрозының факторы
Жүйкенің өсу факторы
Эпидермистің өсу факторы
VIII факторы
IX факторы
В-лимфоциттердің өсу факторлары
Колониестимулдеуші факторлар
Хорионды гонадотропин
Эндорфиндер мен энкефалиндер
Эритропоэтин
Ревматизм
Эмфизема
Әр түрлі инфекциялар
Анемия
Өсудің бәсеңдеуі
Қант диабеті
Қант диабеті, бүйректік жеткіліксіздік
Ісікті түзілімдер, иммунды аурулар
Вирусты аурулар, ісікті түзілімдер, рассеянный склероз
Остеомаляция
Ісікті түзілімдер
Бүйірлі амиотрофты склероз
Босану
Астма, ревматоидты артрид
Өсудің бәсеңдеуі
Өсудің бәсеңдеуі
Плазма белоктарының жеткіліксіздігі
Қалқанша бездің ісігі
Тромб түзілу
Атеросклероз
Язва
Тромб түзілу
Ісікті түзілімдер
Ісікті түзілімдер
Жүйке ұлпасының зақымдануы
Күйіктер
Гемофилия
Гемофилия
Иммунды аурулар
Ісікті түзілімдер
Әйел ұрпақсыздығы
Ауру
Анемия, бүйрек аурулары
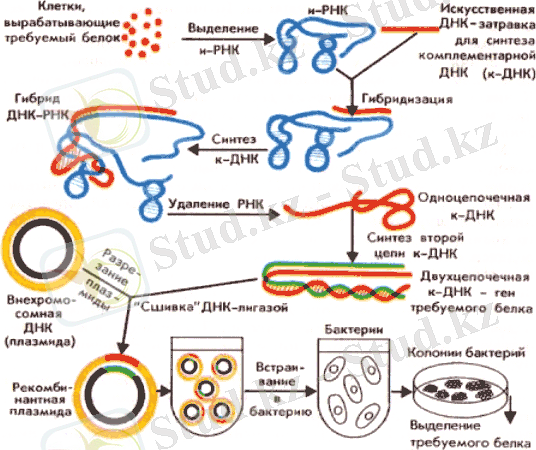
1-сурет. Рекомбинантты белокты алу технологиясының схемасы
Инсулин өндірісі. Инсулин - қарын үсті безінің гормоны, көмірсулардың алмасуын және қандағы қанттың қалыпты деңгейін ұстап отырады (2-сурет) . Гормонның жетіспеушілігінен қант диабеті пайда болады, бұл ауру көп таралған дерттердің арасынан жүрек тамырлары мен ісік ауруларынан кейінгі үшінді орынға ие. Инсулин - 51 амин қышқылының қалдығынан тұратын және бір-бірімен қос дисульфидті байланыспен байланысқан екі полипептидті тізбектен құралған глобулярлы белок. Ол бір тізбекті алғы заты - препроинсулин түрінде синтезделеді, препроинсулинде соңғы сигналды пептид (23 амин қышқылды қалдық) және 35-звенода қосатын пептид бар (С-пептид) . Сигналды бөлікті бөлген кезде клеткада 86 амин қышқылды қалдығы бар проинсулин түзіледі, онда инсулиннің А және В тізбектері өзара С-пептидпен байланысады. С-пептидін алып тастағанда инсулин түзіледі.
Қант диабетінің бірнеше түрлері белгілі. Ең ауыры инсулинге тәуелді (науқасты емдеуге инсулин қажет) формасы болып табылады. Бұл аурудың себебі - осы гормонды синтездейтін клеткалардың (қарын үсті безіндегі Лангерганс аралшықтарының клеткалары) өлімі. Инсулинді қажет етпейтін (инсулинген тәуелсіз) диабеттің түрі арнайы диетамен, белгілі бір тамақтану тәртібімен емделінеді. Көн жағдайда ірі қара мен шошқалардың қарын үсті бездері ет өндірісінде қолданылмайды және рефрижеторлық вагондарда фармацевтикалық өнеркәсіптерге жіберіледі, мұнда гормонның экстрациясы өтеді. Алайда ірі қараның қарын үсті безінің салмағы небарі 200-250 г, ал 100 г кристалды инсулинді алу үшін 800-1000 кг шикізат керек.
2-сурет. Инсулин түзетін қарын үсті бездердің В-клеткалары (жасыл және қызыл-сары түсті)
1922 жылы Фредерик Бантинг және Чарльз Бест қарын үсті безі экстрактынан инсулинді бөліп алып, оны қанға енгізгенде, глюкозаның мөлшерін төмендететінін көрсетті. 1923 жылы Бантинг және МакЛеод инсулинді ашуы үшін Нобель сыйлығын алды. 1963 және 1965 жылдары АҚШ, Қытай мен ФРГ елдерінің зерттеушілері бірігіп, инсулинді алу үшін екі тізбекті синтездеп, оларды дисульфидтік байланыстармен қосу жұмыстарын жүргізді. 1980 жылы «Ново индастри» дания компаниясы шошқа инсулинін адам инсулиніне В тізбегіндегі 30-шы аланин қалдығын треонин қалдығына ауыстыру арқылы өзгерті. Инсулиннің екі түрі активтілігі және әсер ету уақыты бойынша бір-бірінен айырмашылықтары жоқ. 1955 жылы Сэнгер инсулиннің амин қышқылдық қатарын ашқан болатын. Екі тізбектің синтезі үшін 170 реакция қажет, сондықтан оны химиялық жолмен алу тиімсіз еді.
Инсулинді гендік инженерия әдістерімен алу жұмыстары 30 жыл бұрын басталды. 1978 жылы тышқан проинсулинін синтездейтін ішек таяқшасыштамы ның құрастырылғаны туралы мәліметтер ақпарат құралдарында кездесе бастады (АҚШ) . Сол жылы E. coli клеткаларында синтетикалық гендерді экспрессиялау арқылы адам инсулинінің жеке тізбектері синтезделді. Синтетикалық гендердің әрқайсысы β-галакзидаза ферменті генінің 3'-соңына тігіліп, векторлы плазмидаға (рВR322) енгізілді (3-сурет) . Рекомбинантты плазмидалармен трансформацияланған E. coli клеткалары β-галакзидаза және оған метионин қалдығы арқылы байланысқан инсулиннің А немесе В пептидінен тұратын химерлі белокты синтездейді. Химерлі белокты бромцианмен өңдегенде, пептид босап шығады. Алайда түзілген инсулин тізбектерінің арасында дисульфиттік көпіршіктердің түзілуі қиын өтеді.
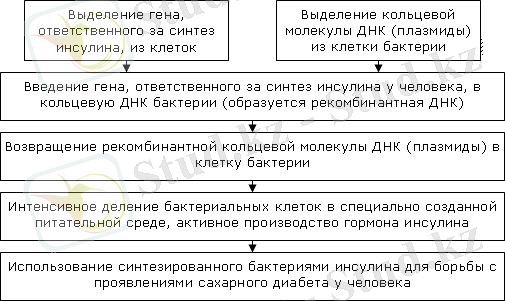
2-кесте. Инсулинді алудың негізгі сатылары
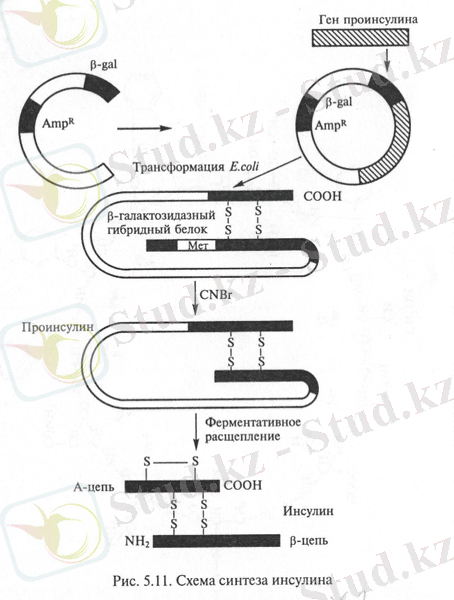
3-сурет. Инсулин синтезінің схемасы
1981 жылы проинсулиннің ген-аналогы - мини-С-проинсулин алынды, оның 35-ші звеносында С-пептиді 6 аминқышқылды (арг-арг-гли-сер-лиз-арг) бөліммен ауыстырылды және E. coli -де экспрессиясы жүргізілді.
1980 жылы У. Гилберт әріптестерімен тышқан қарын үсті безіндегі ісікке шалдыққан β-клеткаларынан түзілетін инсулиннің мРНҚ-сын бөліп алып, кері транскриптаза көмегімен кДНҚ синтездейді. Түзілген кДНҚ-ны рВR322 E. coli плазмидасына, пенициллиназа генінің ортасына тігеді. Рекомбинантты плазмидада проинсулин құрылымы туралы ақпарат жазылған. Клеткаларда мРНҚ тарнсляциясы нәтижесінде пенициллиназа және проинсулин қатары бар (біріншісі трипсин көмегімен ыдыратылады) гибридті белок түзіледі.
Гендік инженерия әдістерінің жетелдірілуі гормонды жоғары мөлшерде, 200 мг/ культураның мл. алуға мүмкіндік берді. Көптеген клиникалық зерттеулерден кейін 1982 жылдан бастап өндірістік масштабта алына басталды.
1978 жылы Биоорганикалық химия институтында Ю. А. Овчиниковтың бастауымен нейропептидтердің синтезін кодтайтын екі құрылымдық гендердің - лейцинэнкефалин мен брадикинин синтезі жүзеге асырылды. Синтезделген лейцинэнкефалин генінің екі «жабысқақ» соңы бар:
5'3'
EcoRI
«жабысқақ» соңы
ААТТ
ГТАЦАТАЦЦАЦЦГАААГАЦАТ ТЦТАГ
BamHI «жабысқақ» соңы
3'5'
Алынған ген промоторы және E. coli клеткасының β-галакзидаза гені бар табиғи ДНҚ-мен рВR322 плазмидасына енгізеді және рестриктазалар - EcoRI мен BamHI қоспасымен өңделеді. Құрастырылған рекомбинантты рЕк плазмидазы E. coli клеткаларына трансформацияланады. Экспрессия нәтижесінде бактерия N-соңында β-галакзидаза, ал С-соңында нейропептидтің қатары бар гибридті (химерлі) белокты өндіре бастады. In vitro жағдайында химерлі белокты бромцианмен ыдыратып, активті лейцинэнкефалин алды. 4-суретте лейцинэнкефалиннің синтетикалық генін клондау және оның ішек таяқшасындағы экспрессиясы көрсетілген.
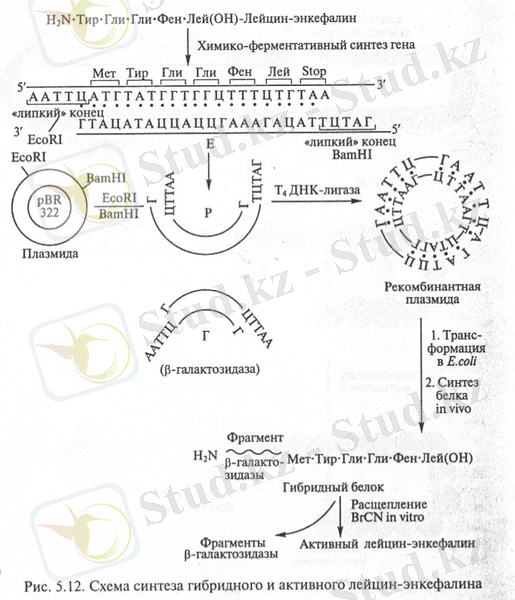
4-сурет. Гибридті және активті лейцин-энкефалин синтезінің схемасы
Ұқсас жолмен гипоталамустың гормоны - соматостатин синтезделді. Соматостатиннің молекуласы 14 амин қышқылды қалдықтан тұрады. Инсулин мен адам өсуінің гормондарының бөлінуін тежейді. «Хоуп» (Калифорния) Ұлттық медициналық орталықта соматостатинді кодтауға қабілетті ұзындығы 42 нуклеотидті геннің синтезі жүргізілді. Соматостатин гормонын кодтайтын ДНҚ бөлігі тринуклеотидті қосу арқылы алынды. Синтетикалық геннің 52 н. ж. 42 жұбы гормонның құрылымдық гені болып табылады, ал қалғандары рВR322 плазмидасына, сонымен қатар E. coli геномындағы лактозды оперонына немесе β-галакзидаза геніне енгізілді.
Соматостатин синтезінің ген-инженериялық жолдары 5-суретте көрсетілген. Соматостатиннің синтетикалық гені E. coli рВR322 плазмидасына β-галакзидаза ферментін кодтайтын геннің қасына тігеді. Екі геннің арасына метионин кодоны енгізіледі. Рекомбинантты плазмиданы бактериялық клеткаға тасымалдағанда ішек таяқшасы гибридті белокты синтездей бастады. Соматостатинді β-галакзидазадан BrCN көмегімен ыдыратады. Химерлі белоктарды қолдану себебі - клетканың протеазалары бос күйінде синтезделген соматостатин молекулаларын тез ыдыратып жібереді. Соматостатинді гендік инженериялық жолмен ең алғаш рет 1977 жылы Бойер алды. Гормонның шығымы 1 клеткаға 1 молекула. 100 г E. coli биомассасынан 5 мг соматостатинді алуға болады, мұндай мөлшерді 100 г қой миысынан алынады.
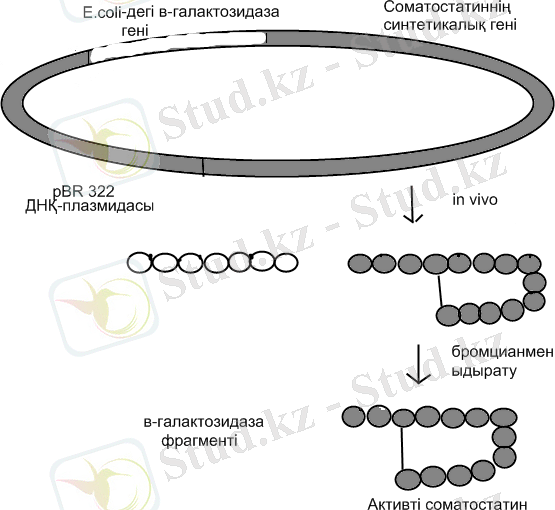
5-сурет. Бактериялық жүйеде соматостатин синтезінің схемасы
Соматотропин синтезі. Соматотропин (немесе адамның өсу гормоны АӨГ) гипофиздың алдынғы бөлігінде секрециялайды. 1963 жылы ең алғаш рет гипофизден бөлініп және тазаланып алынды. Оның жетіспеушілігінен гипофиздік ергедейлік пайда болады (5000 адамға бір адам) . Гормонның түрлік спецификасы бар. Негізінен оны өліктерден алады, бірақ аз мөлшерде. Гормон дамыған елдерде кездесетін гипофиздік ергежейліктің тек 1/3 жағдайларына жетеді. Негізгі өндірушілері - АҚШ, Швеция, Италия, Швецария. Соматотропин гормоны 191 аминқышқылдар қалдығынан тұрады.
Өлік материалынан алынған препарат бірнеше формалы қоспадан тұрады, олардың бесеуінің салмағы 22 кДа, басқалары димерлер, ал қалғандары протеолизде пайда болатын фрагменттер. Сондықтан науқастардың 30%-да гормонға қарсы антигендер түзіліп, оның биологиялық активтілігін жояды.
Осыған байланысты қазіргі кезде самотропин арнайы құрастырылған бактериялар клеткаларында гендік инженерия әдістерімен алынады. E. coli клеткаларында синтезделген АӨГ молекуласының NH2 соңынында метионин қосымша қалдығы бар. 1979 жылы Д. Гедделль әріптестерімен 191 аминқышқыл қалдығынан тұратын АӨГ биосинтезін жүргізді. Алдымен екі тізбекті кДНҚ клондады, одан кейін ыдырату нәтижесінде алғашқы 23 аминқышқылы - фенилаланиннен (-NH2) лейцинге дейін (23), басқа гормонның аминқышқылдық қатарын кодтайтын тізбегі және басында АТG старт-кодоны бар 1-23 аминқышқылдарынан тұратын синтетикалық полинуклеотид алынды. Осыдан кейін екі фрагментті қосып, lac-промотор мен рибосомамен байланысатын бөліктен түзілген жұпқа біріктіреді. Гормонның соңғы шығысы 1 мл культурадан 2, 4 мкг тең болды, яғни бір клетка гормонның 1 молекуласын түзеді. Пайда болған гормонның полипептидті тізбегінің соңында метиониннің қосымша қалдығы бар, биологиялық активтілігі жоғарырақ болды. 1984 жылдан бастап көптеген клиникалық зерттеулерден кейін «Генентек» (Сан-Франциско) компаниясы бактериялды соматотропиннің кең масштабтя өндірісі жүргізіле басталды.
Соматотропинді гендік инженерия әдістерімен алу схемасы 6-суретте берілген. Алдымен гипофиздің клеткаларынан сәйкес мРНҚ бөліп алынады. Одан кейін кДНҚ синтезі жүргізіліп, оның сигналды пептидті кодтайтын бөлігін ыдыратып орнына АТG триплетін орналастырады. Бұл триплет метионинді кодтайды және белоксинтездеуші клеткалық жүйедегі трансляцияның басталу сигналы болып табылады. Осылай құрастырылған геннің дұрыс экспрессиясы үшін оған реттеуші элементтер (промотор мен мРНҚ-ның рибосомаға байланысуын қамтамасыз ететін лидерлі тізбекті қатар) қосылады. Құрастырылған құрылымды плазмидаға енгізіп, векторды алады. Одан кейін векторды клеткаға трансформациялап, АӨГ синтездейді.
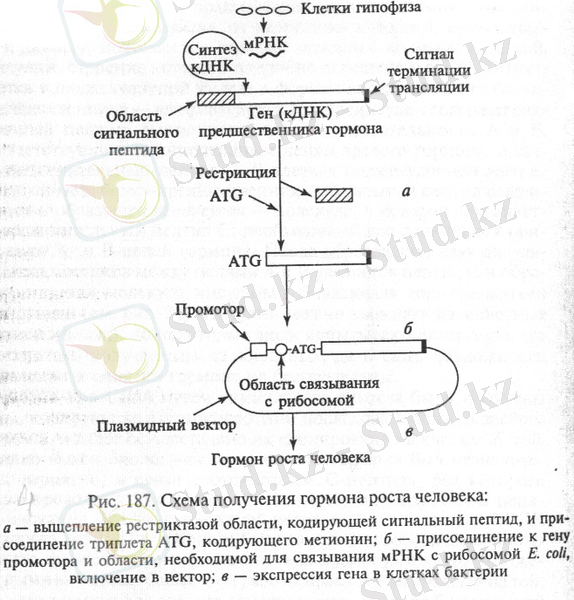
6-сурет. Соматотропинді алу схемасы
1982 жылы бір уақытта Пастер институтында (Париж) және Молекулалы биология институтында (Мәскеу) АӨГ E. coli клеткаларынан және жануарлардың клеткалар культураларынан алынды.
Соматотропиннің гипоталамусты рилизинг-фактордың (СТГ-РФ) биологиялық активтілігі бар полипептидті бөліп алу және синтездеу үлкен қызушылық тудыруда. Бұл факторды енгізу соматотропин жетіспеушілігін орын басуға болады. Сөйтіп, гендік құрастырулар нәтижесінде бактериялық клеткалардан бөлініп алынған СТГ-РФ мен гормонның өзін ергейжейлікпен және диабеттің кейбір формалары, күйіктен кейінгі ұлпалардың регенерациясы, т. с. с. ауруларды емдеуде үлкен маңызға ие болып отыр.
β-Эндорфин - 31 амин қышқылының қалдығынан тұратын ми опиаты, оны 1980 жылы Австралия және АҚШ ғалымдарының тобы гендік құрастырылған клеткаларда синтездеп алған. E. coli клеткаларынан β-Эндорфин β-галакзидаза белокпен бірге химерлі белок түрінде бөіп алынған. β-Эндорфиннің синтезі келесі сатылардан тұрды: кері транскрипция арқылы мРНҚ-дан кДНҚ алу; β-Эндорфиннен басқа оның құрамында кейін ыдыратылатын АКТГ және β-липотропин қатарлары бар. Гибридті белоктан түзілген және тазаланып алынған β-Эндорфиннің жоғары биологиялық активтілігі бар. Ол β-Эндорфинге қарсы антисарысумен өзара әрекеттеседі. Адам β-Эндорфиннің гендік инженерия әдісімен алынған β-Эндорфиннен 2 амин қышқылы бойынша айырмашылығы бар және бұл ерекшеліктер бактериялық плазмиданың ДНҚ-сында 2 кодонды өзгерту арқылы нуклеотидтің деңгейде жөндеуге болады.
Интерферондарды алу. Интерферондар вирусты инфекцияларға тұрақтылық факторлары ретінде 1957 жылы Лондондағы Медициналық зерттеулердің ұлттық институтында ашылған. Вируспен зақымданған жануарлар клеткалары ортаға вирусқа төзімділікті жас клеткаларға беретін факторды бөлетінін анқтаған. Ол клеткаларда вирустардың таралуын алдын алған және интерферон деген атқа ие болды.
Интерферондардың 3 түрі белгілі: α-интерферондар (α-И), вирустың әсерінен лейкоциттерде түзілетін; фибробластарда синтезделетін β-интерферондар (β-И) ; бактериялар мен вирустардың антигендеріне жауап ретінде лимфоциттерде түзілетін γ-интерферондар (γ-И) .
α-интерфероннан басқа интерферондар гликопротендер; глобулярлы белоктар. α-интерферонда екі дисульфидтік байланысы бар. Интерферондар - 146-166 амин қышқыл қалдықтардан құралған төмен молекулалық белоктар; түрспецификалық.
Интерферондардың ішінде α-интерферондар жақсы зерттелегн; оларды шамамен 20 гендер кодтайды. α-интерферондардың гетерогенді қатарларымен салыстырғанда γ-интерферондар бір генмен кодталатын тек бір белок болып табылады. Адамның β-интерферонына сәйкес келетін тек бір белок - β1-интерферон бөлініп алынды. Геномда әр түрлі β-интерферондарды кодтайтын бірқатар гендер бар деген болжам бар. Интерферондар - инфекцияға қарсы қорғаныстың бірінші қамалы болып табылады.
Интерферондар әр түрлі ауруларды - вирусты гепатит, рассеянный склероз, остеосаркома, миелома және лимфоманың кейбір түрлері емдеуде пайдаланылады. Сонымен қатар, меландарға, тамақ, өкпе, ми ісіктеріне қарсы қолданылады.
Емдік мақсатта пайдаланылатын интерферондардың жоғары спецификасын ескере отырып, адам клеткаларынан алынатын препараттар қажет. Дәстүрлі әдіспен оларды адам қанынан алады (1 л қаннан тек 1 мкг интерферон шығады) . Көп уақыт бойы интерферонның дүние жүзілік өндірісінің үлкен бөлігі Финляндияда (Хельсинки) жүргізілді, кейін Францияда. 1980 жылдан бастап жапондық бір компания лимфобластоидты клеткалардан лимфобластоидты интерферондарды алу өндірісін жетілдірді. Осындай мақсатпен берілген клеткалардың культураларын сендай вирусымен индукциялайды, одан кейін интерферонды оларға қарсы моноклонды антиденелермен толтырылған хроматографиялық колонкаларда бөліп алады. Швецияда көлемі 2000 л ферментерлерде лимфобластарды өсірді, бөлініп алынған интеферондарды моноклонды антиденелер көмегімен тазалап алды.
Интерфенрондардың ішінде дүние жүзілік өндіріс үшін β-интерферондар икемдірек болып келеді. Ұрық ұлпаларынан алынған фибробластарды клеткалар культурасында өсіруге болады. β-интерферондарды алу әдісі Англияда құрастырылған.
Жоғарыда аталып кеткен әдістердің бағасы қымбат, соңғы өнімінің мөлшері төмен және препараттың тазалығы жеткілікті емес. Қазіргі кезде генетикалық құрастырылған микроорганизмдер көмегімен интерферондардың биосинтез әдісі тиімді болып отыр. Алайда адам интерферондарын гендік инженерия әдістерімен алу технологиясы бірқатар қиыншылықтар тап болады. Біріншіден, әр түрлі белоктарды кодтайтын мРНҚ қоспасында интерферондарды кодтайтындарының саны өте аз - шамамен тек 0, 1%. Сонда да кері транскриптаза көмегімен алынған кДНҚ E. coli клеткаларында клондалды, бұл интерферон зерттеулерінде елеулі оқиға еді. Интерферн гені векторлы ДНҚ тігіліп, оған бактериялық клеткада транскрипция және трансляциясын бақылайтын реттеуші элементтер қосылды (7-сурет) .
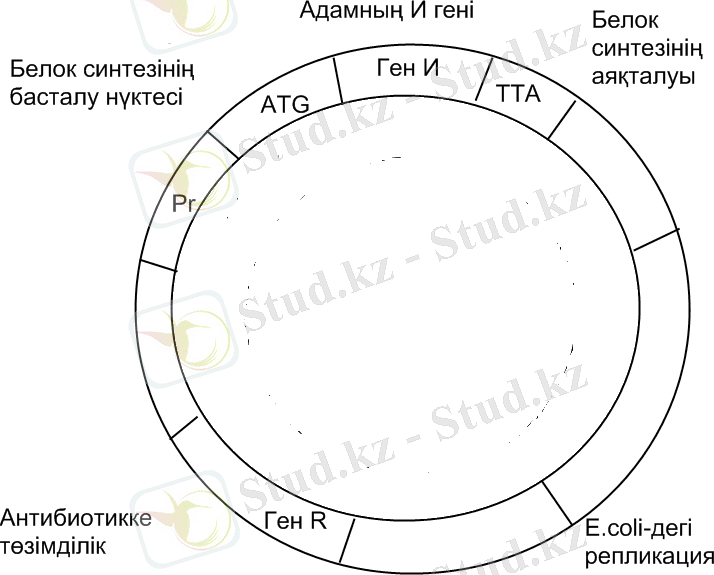
7-сурет. E. coli клеткаларында адам интерферонының синтезін жүргізетін рекомбинантты плазмиданың схемасы
Клеткада интерферондар алдымен сигналды пептиді бар алға заты түрінде түзіледі, одан кейін сигналды бөлігі ыдыратылып, толық биологиялық активтілігі бар нағыз интерферон пайда болады. Бактерияларда сигналды пептидті ыдырататын ферменттері жоқ. Сондықтан бактериялар жетілегн интеферонды синтездеу үшін сигнальді пептидті кодтайтын геннің бөлігін алып тастайды. Берілген жұмыс келесі сатылардан тұрады. Интерферон генінің Sau 3A1 рестриктазасымен ыдыратылатын үш ауданы бар, олардың біреуі сигналды пептидтің қасында орналасқан. Осы ферментпен генді толық емес ыдыратқан кезде, бірінші цистеині жоқ жетілген интерферонды кодтайтын нуклеотидтік қатары бар геннің фрагментін алу мүмкіндік бар. Цистеинді кодтайтын АТГ триплетті фермент сигналды бөлікпен бірге ыдыратады. Геннің толық полинуклеотидті қатарын құрастыру үшін химиялық жолменен берілген триплеті және қосымша АТГ триплеті - белок синтезінің инициациясы нүктесі бар ДНҚ үлкен емес фрагменті синтезделді. Бұл фрагментті бөлектенген геннің орнына орналастырады. Құрастырылған генді плазмидаға тігіп, бактерия клеткасына енгізеді. Плазмидасы бар E. coli клеткаларынан алынған экстрактардың вирусқа қарсы активтіліктері болды.
Гендік инженерия әдістерімен синтезделген интерферондардың физико-химиялық қасиеттері бойынша донорлар қандарынан алынатын интерферондар өте жақын болып келді. 1 л бактериялық суспензиядан 5 мкг интерферон түзетін бактериялық штамдар жасалынды (бұл көрсеткіш 1 л адам қанынан алынатын интерферон мөлшерінен 5000 есе артық) . Гендік инженерия әдістерімен α-, β- және γ-интерферондарын синтейтін бактериялар штамдары құрастырылды. E. coli β- және γ-интерферондарды алу үшін қолданудың кемшілігі - эукариотты белоктардың гликолиздену аппараттарының болмауы. Алайда β- мен γ-интерферондарының вирусқа қарсы қасиеттеріне гликолиздену немесе гликолизденбеудің әсері толық анықталмаған.
Қазіргі кезде интерферон гендері гликолиздек реакцияларын жүргізетін ашытқылар және жоғары эукариот клеткаларында клондалды.
1981 жылы АҚШ-та ең алғаш рет адамдағы лейкоцитті интерферонның синтезін жүргізу үшін гендік өзгертілген Saccharomyces cerevisiae ашытқылардың клеткалары қолданылды. LeIF генінің эффективті экспрессиясы және бактерияларды ашытқы клеткаларымен алмастыру интерферон өндірісін 10 есе жоғарлатты.
Көптеген зерттеулер 166 аминқышқылынан тұратын адамның лейкоцитті белогын кодтайтын геннің химиялық синтезіне арналған. 514 н. ж. тұратын берілген ген синтезделген гендердің ішінде ең ірі, оны 1982 жылы ағылшын зерттеушілері синтездеп алды.
Алайда интерферондарды гендік инженерия жолымен алу технологиясының жетістіктеріне қарамастан, көптеген мәселелері бар. Интерферондардың барлық гендері толығымен ашылмады, мысалы жаңа α L гендері табылды.
Интерферондардың биологиялық әсерлерінің схемасы 8-суретте берілген. Интерферондар клеткалық рецепторлармен байланысып, екі ферментті синтездейді: 2', 5'- және протеинкиназа. 2', 5'- 2', 5'-олигоаденилаттардың синтезін жүргізеді (АТФ-тен), олар клеткалық рибонуклеаза І активтендіреді; протеинкиназа IF 2 трансляция инициациясының факторын фосфорлайды. Осындай жағдайлардың нәтижесінде инфекцияланған клеткадағы вирустың көбеюі және белок биосинтезінің ингибирленуі жүріп, клетка лизиске ұшырайды. Итерферондардың басқа да әсерлері, мысалы тРНҚ инактивациясы, метилдену процестерінің бұзылуы, т. б. болуы мүмкін.
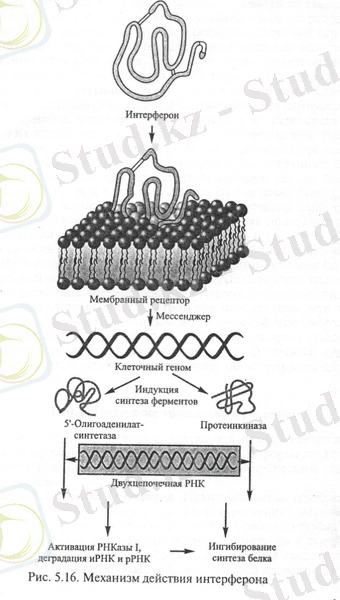
8-сурет. Интерферондардың биологиялық әсерлерінің схемасы
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz