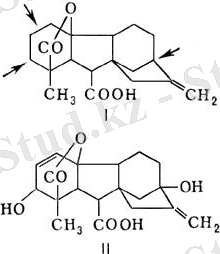
Бидай алейрон клеткаларында АР-эндонуклеазалардың белсенділігіне гиббереллин мен абсциз қышқылының әсері


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
әл-фараби атындағы қазақ ұлттық университеті
Биология факультеті
Генетика және молекулалық биология кафедрасы
Бітіру жұмысы
Бидай алейрон клеткаларында АР-эндонуклеазаларының белсенділігі
Орындаушы 4 курс студенті
Ғылыми жетекшісі Бисенбаев А. Қ.
б. ғ. к., доцент ( қолы, күні)
Норма бақылаушы Сатылған И. А.
( қолы, күні)
Кафедра меңгерушісі Айташева З. Г.
б. ғ. д., профессор ( қолы, күні)
Алматы, 2010
МАЗМҰНЫ
КІРІСПЕ 3
1 Әдебиетке шолу 4
1. 1 Бидай алейрон клеткаларына жалпы сипаттама 4
1. 2 Гиббериллин және абсциз қышқылдарына сипаттама 6
1. 3 Оттегінің белсенді түрлері 8
1. 4 ДНҚ репарациясына қатысатын ферменттер 13
2 Тәжірибелік бөлім 17
2. 1 Материалдар мен зерттеу әдістері 17
2. 1. 1 Бидай дәнінің жекелеген алейрон ұлпасын бөліп алу мен
инкубациялау шарттары 17
2. 1. 2 Ішек таяқшасы клеткасын өсіру жағдайлары 17
2. 1. 3 p. Bluescript-Alk A плазмидасын бөліп алу 19
2. 1. 4 ДНҚ репарация ферменттерін экстракциялау және белсінділігін анықтау 20
3 Зерттеу нәтижелері және оны талдау 21
ҚОРЫТЫНДЫ 28
ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР ТІЗІМІ 29
КІРІСПЕ
Алейрон ұлпасы, бидай дамуының өсiп-өну сатысында, синтетикалық және секреторлық қызмет атқаратын күрделi ұлпа. Яғни бидай дәнінің өсіп-өну барысында алейрон қабаттары бірқатар гидролитикалық ферменттерді синтездеп, оны крахмалды эндоспермге секрециялайды [1, 2] . Онтогенездің соңғы сатысында алейрон клеткалары элиминацияланады. Алейрон қабаттарының бұл өлімі программаланған (апоптоз), яғни генетикалық детерминацияланған деген болжам бар [3, 4, 5] .
Оттегiнiң белсендi түрлері (ОБТ) - супероксид ( . О), сутектiң асқын тотығы (Н 2 О 2 ), гидроксид радикалы ( . ОН) өсімдіктер клеткаларының программаланған өлімі барысында маңызды роль атқаратындығы белгілі [6, 7, 8] . ОБТ клеткалық метаболизмнің өнімдері болып табылады, олардың ішкі клеткалық мөлшерін бірқатар антиоксидантты ферменттер (супероксиддисмутаза, аспартат пероксидаза, глутатионредуктаза, каталаза және т. б. ) реттейді. Өсімдік клеткаларында ОБТ-нің митохондрияларда, хлоропласттарда, плазмалық мембраналарда, пероксисомаларда және апопластық кеңістіктерде синтезделетіні анықталған. Сонымен қатар, ОБТ қысқа толқынды сәулелердің (ультракүлгін және иондаушы сәулелер) және химиялық агенттердің әсерінен де пайда болуы мүмкін. ОБТ белоктар, липидтер, ДНҚ және т. б. сияқты клеткалық биомолекулалармен қарым-қатынасқа түсіп, оларды тотықтыру арқылы зақымдайды [9] .
Клеткадағы бұндай процестер әсерінен болатын ДНҚ-ның зақымдалуы, ДНҚ-дағы генетикалық информацияны өзгертіп, клетканың тіршілігі үшін қауіп тудыруы мүмкін.
Сондықтан клеткада осындай зақымданулардан сақтайтын, тікелей зақымдалған негіздерді алмастыратын, DNР пулдарын тазартатын, мисмэтч, BER-, NER- және NIR-репарация секілді көптеген механизмдері дамыған. Осы ДНҚ репарациялау жүйелерінің ішінде маңызды қызметті ДНҚ-гликозилаза ферменті атқарады. Бұл фермент негіздер мен қант қалдығы арасындағы N-гликозидтік байланысты үзіп, зақымдалған негізді аластатады.
Осыған орай, бұл жұмыстың мақсаты ДНҚ репарациясының басты ферменттерінің бірі АР эндонуклеаза ферменттерiнiң белсендiлiгiне гиббереллин (ГҚ) және абсциз (АБҚ) қышқылдарының әсерiн зерттеу болып табылады.
1 Әдебиетке шолу
1. 1 Бидай алейрон клеткаларына жалпы сипаттама
Астық тұқымдастардың алейрон қабаты біртекті жоғары дифференияланған клеткалардың бір немесе бірнеше қабаттарынан тұратын ұлпа. Алейрон ұлпасы, бидай дамуының өсiп-өну сатысында, синтетикалық және секреторлық қызмет атқаратын күрделi ұлпа [1, 2] . Онтогенездің келесi сатысында алейрон клеткалары элеминацияланады. Алейрон қабатының онтогенетикалық программаланған клеткалар өлiмi апоптотикалық сипатта жүзеге асады деген болжам бар [3, 4] .
Алейрон қабатының клеткалары ұзынынан және көлденеңінен кесіндісінде төртбұрышты немесе сәл созылған пішінде болады. Көптеген мәліметтер бойынша, алейрондық қабаттың қалыңдығы шамамен 65-70 μ болады (1 сурет) . Алейрон қабатының клетка қабырғасы негізінен клетчаткадан тұрады [10] .
Бидай дәнінің эндоспермі тозаң қапшығында, орталық клетканың аталық жыныс клеткасымен ұрықтану нәтижесінде пайда болатын, триплоидты ұлпа. Тозаңдану процесінен кейін шамамен 8-10 тәуліктен соң, дән эндоспермі крахмалды эндоспермге және алейрон қабатына дифференциацияланады [7] . Алайда, ұрықтанған бір клеткадан пайда болатынына қарамастан, алейрон ұлпасы мен крахмалды эндосперм клеткаларының өлуі әртүрлі уақытта жүзеге асады. Крахмалды эндосперм клеткалары бидай дәнінің пісіп-жетілу барысында өліп, дән қуысын белокты және крахмалды гранулалар түрінде толтырып тұрады деген болжам бар. Ал алейрон клеткалары, дәннің пісіп-жетілу сатысында еш өзгеріссіз сақталып, тек қана оның өніп-өсу сатысын, гидролитикалық ферменттерді синтездеп, секрециялау арқылы индукциялағаннан кейін ғана элиминацияланады [11] .
Алейрон клеткаларының ультра құрылымы олардың қызметін көрсетеді. Дәндегі алейронның көптеген көрсеткіштері оның ерекше және жан-жақты тәжірибелік жүйе болуын қамтамассыз етеді. Астық тұқымдастарының алейрон қабаты біртекті, жоғары дифференциалданған клеткалардың бір қабатынан (сұлы, жүгері, қара бидай, бидай) немесе бірнеше қабатынан (күріш, арпа) тұрады [12] . Пісіп-жетілген құрғақ алейрон клеткалары қалың геммицеллюлозалық қабырғамен қоршалған және олар ешқандай да клеткалық бөлінуге ұшырамайды. Алейрон қабаттарын жабысып қалған өлі крахмалды эндоспермнен ажыратып алуға болады және ажыратып алынған алейрон ұлпасынан ферменттердің көмегімен протопластардың біртекті популяциясын дайындауға да болады [13] .
Алейрон клеткаларының цитоплазмасына белоктар қорынан тұратын көптеген вакуольдер тән, оларды көбінесе алейрондық түйіршіктер деп те атайды, олар бүкіл клеткаларды алып жатады. Бұл органелла алейронның гормондар әсеріне қайтаратын реакциясында негізгі қызмет атқарады.

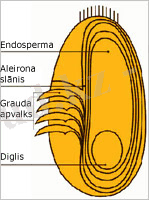
1 сурет. Бидай дәнінің алейрон қабатының құрылысы
Протеиндердің қоры бар вакуольде гиббереллинмен өңделгеннен кейін гидролизге ұшыраған протеиндерді секреторлық белоктардың түзілуіне қажетті аминқышқылдармен қамтамасыз ету үшін қор ретінде сақтай бастайды [14] . Протеиндердің қоры бар вакуольдер, сондай-ақ, астық тұқымдастардың дәндеріндегі минералдардың негізгі қоймасы болып табылады. Олардың құрамынан минералдар фитин түрінде бөлініп алынған. Фитин К + , Mg 2+ , және Ca 2+ иондары мен фитинді қышқылынан (гексофосфат) түзілген кристалды, ерімейтін комплекс болып табылады. Бұл кристалды қосынды, глобоид деп те аталады. Рентгендік микроанализ нәтижелері бойынша дән құрамындағы РО 4 3+ , К + , Mg 2+ және Ca 2+ иондарының шамамен 75% алейрон қабаттарында сақталады [15] . Алейрон немесе протопластардың инкубациялық кезеңінде вакуольдер көлемдері ұлғайып, бір-бірімен орталық үлкен бір вакуоль түзілгенше қосыла бастайды. Инкубациялық ортада гиббереллин болған жағдайда клеткалар мен протопластардағы алейрон қабаттарының вакуольдену процесі жылдамдай түседі. Бейтарап майларды сақтайтын липидтік қосындылар немесе олеосомдар да алейрон клеткаларының маңызды органеллалары болып табылады, олар клетканың бүкіл кеңістігінің 30% алып жатқан үшглицеридтік негізден тұрады [16] .
Алейрон қабатының құрамына белок (альбумин, глобулин және т. б. ), майлар, қант, клетчатка, күлдер (золы), суда еритін витаминдер, гемицеллюлозалар, пентозалар кіреді. Алейрондық қабатта тиамин мен рибофлавин өте көп мөлшерде болады. Олар флуоресцентті зерттеулер негізінде анықталған (2 сурет) .
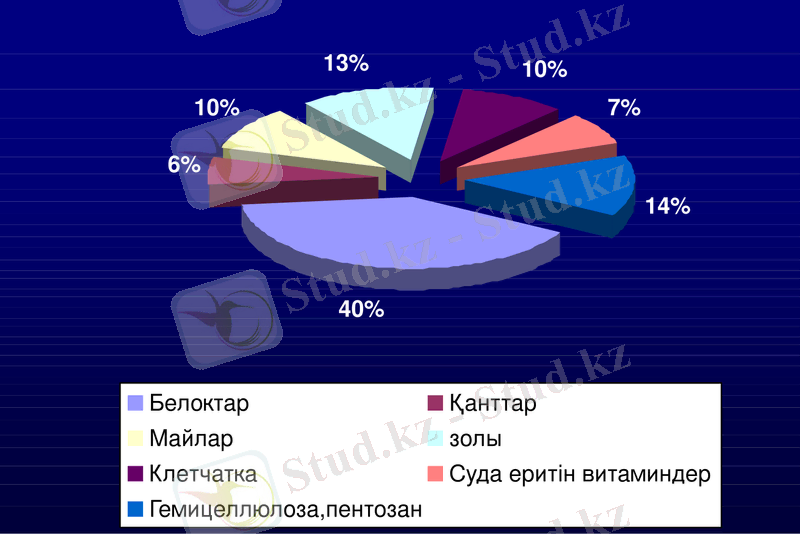
2 сурет. Бидай дәнінің алейрон қабатының құрамы
1. 2 Гиббериллин және абсциз қышқылдарына сипаттама
Гиббереллиндер 1926 жылы Gibberella fujikuroi Sow саңырауқұлағында табылған, күріш ауруын зерттеу кезінде атақты жапон ғалымы Е. Куросавамен ашылған болатын. 1935 жылы жапон ғалымы Т. Ябута гиббереллинді осы саңырауқұлақтардан кристалды түрде бөліп алып, оған өзіне тән атау береді.
Гиббереллиндер-бұл саңырауқұлақ гиббереллаларынан алынатын органикалық қышқылдарға ұқсас заттар класы. Өсімдіктердің өнуінің стимуляторы болып табылады және дәнектердің пісіп-жетілуі мен жапырақтардың дамуын жылдамдатады. Гиббереллиндердің 27 түрі анықталды; олардың барлығы тетрациклдік дитерпеноидтарға жатады және карбонатты қышқылдар болып табылады. ГК 9 гиббереллині гиббереллиндердің ең негізгі құрылымына жатқызылады; ал қалған гиббереллиндер оның туындысы ретінде қарастырылады. Гиббереллиндер тұрақты емес және ол ерітінді мен қышқылдық ортада тез бұзылады. ГК 9 -дан көміртекте гидроқышқылдарының және екі байланыс : 233-235 0 C пен молярлы массаның болуымен ерекшеленетін гиббереллоидты қышқыл (ГК 3 ) биологиялық белсенділікті қамтиды [17] . Гиббереллиндер өсімдіктер өсімін жүйелейтін жүйенің компоненті болып табылады. Гиббереллиндерге сәйкес, оны “жасыл жапырақтардың гормондары” деп атауға болады. Гиббереллиндер негізінен фотосинтезделген ұлпаларда өңделеді, бірақ олардың тамырларында да қалыптасуы мүмкін.
Гиббереллиндер ең алдымен жапырақтар бекітілетін түйіншіктер жақын орналасқан интеркалярлы меристемаларға әсер етеді (Мысалы фотосинтездейтін жапырақ неғұрлым көп болса, соғұрлым оның алаңы үлкен болады және олардың арасындағы түйіншік ұзынырақ бола бастайды, үлкен жапырақ гиббереллинді көп өндіреді және интеркалярлы меристемаға күшті сигнал береді) .
Гиббереллиндер және дәндердің(зерна) өсіп-өнуі
Гиббереллиндермен пайда болатын ең басты нәтиженің бірі дәнектердің өніп-өсуі кезіндегі қосымша қоректік заттардың мобилизациясы. Бұл процесс арпада, бидайда жақсы зерттелген, сыра өндіріп шығаруда оның практикалық мәні өте зор. Дәнді дақылдар ұрықтан, эндоспермнен және тұқым қабығынан құралады. Қосымша қоректік заттар крахмал түрінде эндоспермде жинақталады. Дәннің пісіп жетілуінде крахмалдық қабат тірі жасушалардан құрылмайды. Эндоспермнің перифериясында тек қосымша ақуыздарға алейронды қабатқа бай тірі жасушалардың жұқа қабаты ғана қалады. Дәннің тұқымы эндосперм қалқаншасымен жабысады. Қалқанша өніп-өскен кезде, ол гиббереллиндерді бөліп шығарады. Бұл дәннің оянғанын көрсетеді және оған қоректік заттардың қажет екенін білдіреді. Гиббереллиндер эндоспермнің алейрондық қабатын крахмалды дәндермен бірге зона арқылы диффундияцияланады. Алейрондық қабаттың тірі жасушаларында крахмал- амилазды жоятын ферменттер үшін РНҚ ұясы синтезделе бастайды [18] .
Абсциз қышқылы
Абсциз қышқылы(AБҚ), абсцизин, дормин - өсімдіктердің гормоны. Алғашқыда абсциз қышқыл үшін жапырақтардың түсуіндегі рөлі ұсынылды, бірақ қазір мұндай рөл өсімдіктердің біршама түріне ғана арналады. Өсімдіктерде стресс пен патогенге жауапты абсциз қышқылымен байланысты сигналдық жолдар жазылған. АБҚ-ның биосинтезіне белсенді қатысатын өнімдер мен гендер қарастырылды. АБҚ бірнеше патогендік саңырауқұлақтармен өсімдіктерге қарағанда басқа жолмен синтезделеді. Жапырақтардың түсуінде абсциз қышқылының рөлі көрсетілген. Қысқа дайындалу кезінде АБҚ өсімдіктердің соңғы бүршіктерінде синтезделеді. Бұл оның баяулап өсуіне алып келеді. АБҚ камбий қышқылының бөлінуіне алып келеді және бірінші-екінші реттілік өсуін тоқтатады [19] .
АБҚ сонымен қатар су потенциалын төмендетуге байланысты өсімдіктердің тамырларында, стресстік жағдайлар кезінде қалыптасады. Кейін АБҚ жапыраққа келіп түседі, онда осмотикалық потенциал жапырақ саңылауларындағы жасушаларды өзгертеді және жапырақ саңылауларының жабылуына алып келеді. Жапырақ саңылауларының жабылуы транспирациясын төмендетеді және жапырақтар арқылы судың ағып кетуін тоқтатады [20] .
1. 3 Оттегінің белсенді түрлері
Өсімдіктер өздерінің тіршілік кезеңі барысында қоршаған ортаның әртүрлі қолайсыз ықпалдарына қарсы тұруы тиіс. Осыған байланысты олардың бойында өсімдік организмін биотикалық және абиотикалық қолайсыз жағдайлардан қорғауға бағытталған кең ауқымды бағдарламалар пайда болып, дамыды. Өсімдіктердің потогенді (ауру тудырғыш) бактериялармен, саңырауқұлақтармен және вирустармен зақымдалуы олар үшін ең қауіпті жағдайлардың бірі болып табылады [21] .
Микроорганизмдерді өсімдіктерге ендіргеннен кейін олар патогендердің көбеюін шектеу мен жою мақсатында бір немесе бірнеше қорғаныс механизмдерін іске қосуы мүмкін. Клетка қабырғаларының қалыңдауы, фитоалексиндердің түзілуі және антимикробиотикалық белоктардың жиналуы сияқты жалпы қорғаныстық реакцияларды жүзеге асырады. Бұл реакциялардың уақыт пен кеңістік бойынша реттелуі ие организм мен патоген арасындағы қарым-қатынастың нәтижесін қамтамасыз етуде шешуші фактор болып табылады (организм не микроорганизмнің ықпалына душар болып, беріледі, не оған қарсы әрекет етеді) . Көп жағдайда, бұл реакциялар зақымдалған ошақта бірнеше клеткалардың өлімге ұшырауымен байланысты болады (гиперсезімталды жауап) . Қорғаныстық реакциялардың жүре бастауы үшін не организмге енген патоген арқылы түзілген, не өсімдіктің клеткалық қабырғаларынан босап шыққан белгі бергіш молекулалардың қабылдануы қажет. Мұндай молекулалар "элиситерлер" (ағылш . elicit-қоздырып-шақыру, шығарып алу) деп аталады, олардың кейбі-реулері олигосахаридтер, белоктар және пептидогликандар ретінде иденти-фикацияланады [22] . Бұл элиситерлер ие организм-микроб түріндегі белгілі бір өсімдік жүйесі үшін арнайы түрдегі молекулалар болуы мүмкін, немесе арнайы емес сипаттағы молекулалар түріндегі, мысалы, өсімдіктердің клеткалық қабырғаларының бөліктері немесе өсімдік организміне енген патогеннің клеткалық бөлшектері ретінде болуы мүмкін.
Өсімдіктердің суспензия-культурасы ортасында қорғаныстық реакция-ларды тудыру үшін элиситер молекулаларының қоспасы қолданылған жағдайда, қорғаныс жауабының негізінен клетка қабырғасының бетінде жүзеге асатын, жылдам жүруші процесстерден тұратын жаңа жақтары анықталады. Реакциялардың ішінде мынадай түрлері идентификцияланады : оттегінің белсенді түрлерінің (ОБТ) босатылуы (тотықтырушы қопарылыс) [21] ; клеткадан тыс рН мәнінің, мембрандық потенциалдардың, иондар қозғалысының өзгеріске ұшырауы; белоктарды фосфарлау моделінің өзгеруі [22] ; клеткалық қабырғаның белоктық бөліктерінің тотыға иммобилизациялануы.
Клеткалардың көпшілігі ОБТ-рін өндіруге және бейтараптауға қабілетті келеді. Қалыпты жағдайда ОБТ клеткада молекулалық оттегінің (О 2 ) бір электрондық тотықсыздануы нәтижесінде міндетті түрде түзіліп отыратын қосымша өнім ретінде кездеседі. Сонымен қатар, клеткадағы ОБТ деңгейінің мүмкіндігінше ең төмен болуын қамтамассыз ету үшін көптеген клеткаларда арнайы қорғаныстық механизмдер болады.
Сүтқоректілерде ОБТ өндіру реакциясы жүретіні бізге 30 жылдан астам уақыттан бері белгілі (фагоциттердегі респираторлық жарылу), өсімдіктерде бұл құбылыс едәуір кеш анықталады [23] . Жуық арада жарияланған жұмыстардың нәтижесі бойынша ОБТ тек организмдерге енген патогенге қарсы қорғаныс құралы ретінде ғана қызмет атқарып қоймай, өсімдіктердің бұдан кейінгі қорғаныстық реакцияларын, сонымен бірге, зақымдалған клеткалардың гиперсезімталды жауабын белсендіруші сигнал болып табылады [24] .
ОБТ молекулалық оттегінің белгілі бір ретпен тотықсыздануы барысында түзелетін (1- cызба) : супероксид (О 2 * ), сутегінің асқын тотығы (Н 2 О 2 ), және гидроксил радикалы (ОН * ) өнімдері.
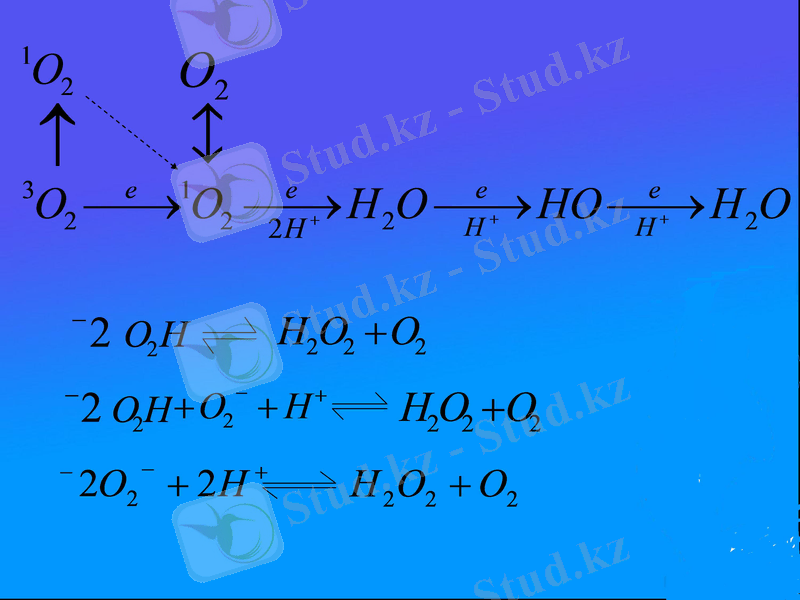
1 сызба. ОБТ молекулалық оттегінің белгілі бір ретпен тотықсыздану барысында түзілетін өнімдер.
Бұл қосылыстар стреске ұшырамаған клеткалардың митохондриялары мен хлоропластарындағы жүретін тотығу-тотықсыздану реакциялары нәтижесінде аз мөлшерде түзіледі.
О 2 * түзілу үшін энергия аз мөлшерде жұмсалады. Тірі клеткалардағы супероксидтің мөлшері оның протондалған түрі гидропероксил радикалдың (О 2 Н * ) мөлшерімен бірдей болады. Гидропероксил радикалы супероксидке қарағанда анағұрлым гидрофобты келеді және мембраналардың липидті қабаттары арқылы оңай енеді. рН-мәні физиологиялық болған жағдайда супероксид клетканың макромолекулаларымен әлсіз түрде әрекеттеседі. рН мәні бейтарап немесе әлсіз сілтілі болған жағдайда супероксид те, гидропероксил радикалы да Н 2 О 2 және О 2 ыдырайды. Бұл реакция кенеттен жүруі мүмкін, сондай-ақ (СОД) қатысуыменде жүреді.
Н 2 О 2 салыстырмалы түрде алғанда тұрақты ОБТ болып табылады. Н 2 О 2 реакцияға түсу қабілеті жоғары емес. Ол электрлік тұрғыдан алғанда бейтарап бола отырып, клеткалық мембраналар арқылы еніп, Н 2 О 2 түзілген аймақтан алшақ жатқан жерлерге жетуге қабілетті келеді. Өсімдік клеткаларында жаңадан түзілген Н 2 О 2 мынадай өзгерістерге ұшырауы мүмкін: 1) өздігінше кенеттен немесе каталазаның қатысуымен су және оттегіге ыдырайды; 2) әртүрлі пероксидазалар үшін субстрат ретінде болуы мүмкін, мысалы, лигниннің түзілуін құрлымдық тұрғыдан тежейтін феноксил радикалдарының түзілуі үшін субстрат болып келеді; 3) және глутатион-редуктазамен бірлесіп әсер ететін аскорбат пероксидаза көмегімен зияндылығы жойылуы мүмкін. Белгі бір жағдайда, тотықсыздандырғыш болған кезде, Н 2 О 2 пероксидазалар арқылы Compound III түзілуін қамтамассыз ететін реакциялардың ретті тізбегіне айналуы мүмкін.
Гидроксил радикалы бұл жұмыста аталған ОБТ ішінде реакцияға түсу қабілеті ең жоғары болып келетін түрін құрайды. Ол Н 2 О 2 мен О 2 * өзара әрекеттесуі нәтижесінде пайда болуы мүмкін. Қалыпты клеткаларда бұл реакция баяу жүреді және ОН * көп мөлшерде өндірілуі үшін тиімсіз болып табылады [25] . Бірақ, Fe 2+ немесе Cu + сияқты транзиттік металлдардың тотығуынан (Фентон реакциясы) және бұл тотыққан иондардың супероксидтің қатысуымен тотықсызданған түрлеріне дейін регенерациялануынан тұратын реакциялар циклы барысында ОН * айтарлықтай көп мөлшерде түзіледі. ОН * радикалдық тізбекті реакцияларды бастауға қабілетті болғандықтан, ол клеткалық макромолекулалардың қайтымсыз өзгерістерге (модификацияға) ұшырауына және органеллалардың зақымдалуына жауапты болып келетін негізгі ОБТ ретінде саналады [26] . ОН * бос күйінде болуы шамамен 0, 2 сек тең болғандықтан оны көзбен көру және оның патоген-өсімдік қарым-қатынасындағы рөлін анықтау сәтсіз аяқталды. N-ацетилхит-олигосахаридті элиситермен өңделген күріштің ( Oryza sativa ) суспензиялық культура клеткаларына жақында ғана жүргізілген тәжірибелер нәтижесінде, бұл модельдік жүйеде ОН * түзілетіні анықталды [25] .
Өсімдік клеткаларының көптеген жануар жүйелерінен ерекшелігі, олар ОБТ негізінен алғанда Н 2 О 2 түрі үнемі, айтарлықтай көп мөлшерде өндіруге қабілетті келеді, бұл процесс әдетте клетканың экстрацеллюларлық компарт-ментімен байланысты болады және ол гормондар жарық сәулесі, механикалық зақымданулар сияқты әртүрлі фактолар арқылы реттеледі. Н 2 О 2 лигнификация процесіне ұшырайтын клеткаларда кездеседі, мысалы, трахеялық (түтікше) элементтерден және флоэма талшықтарынан көруге болады, ал тез ұзарушы клеткалардың клеткалық қабырғаларында әдетте болмайды; механикалық стреске шалдығып зақымдалған клеткаларда Н 2 О 2 қарқынды түрде өндіріледі.
Сырттан түрткі болған факторларға жауап ретінде ОБТ көп мөлшерде, жылдам өндірілуі тотықтырушы қопарылыс болып табылады [23, 27, 28] . ОБТ өндірілу жайында алғашқы мәліметтер 1983 жылы пайда болды, бұл мәліметтер бойынша картоп түйіндеріне ( Solanum tuberosum ) өзімен сәйкес келмейтін Phytophthora infestans тұқымын өндіріп өсірген (инокуляциялаған) жағдайда картоп түйіндері супероксид түзе бастайды [27] . Бұл реакция сондай-ақ потогенді микроорганизмдермен зақымдалған өсімдіктерде және элиситерлік препараттармен, қоздырғыштың бөліктерімен өңделіп немесе механикалық стреске ұшыратылып өсірілген клеткаларда да байқалады. Көптеген мәліметтер бойынша, тотықтырушы қопарылысқа қатысатын негізгі ОБТ - Н 2 О 2 болып табылады, О 2 * қатысуы да мүмкін. Н 2 О 2 мен О 2 * түзілуі химиялық тұрғыдан алғанда ұқсас келеді, сондықтан тотықтырушы қопарылыстағы СОД (NN-диэтилдитиокарбамат) ингибиторының әсерінен бұзылатындықтан, Н 2 О 2 СОД қатысуымен О 2 * -нен түзіледі деген болжам бар [25] .
ОБТ өнімдерінің кенеттен жоғарлауы әдетте жылдам түрде өтеді, сондай-ақ, әр-түрлі зиянды факторларды пайдаланған жағдайда зерттеліп жатқан түрлі жүйелерде өзгеше болады. Суспензиялық-культура клеткаларында реакция әдетте, ортаға элиситерлерді қосқаннан кейін 1-2 минут өткен соң басталып, бірнеше минуттан кейін ең жоғарғы шегіне жетеді де элиситер-леудің басталғанына 30-60 минут болғанда аяқталады [27, 28] . Тотықтырушы қопарылысты зерттеу үшін өсімдіктің бөліктерін пайдаланған кезде реакция айтарлықтай кеш байқалды: элиситерлеуден кейін 8-12 сағатта басталып [29, 30], 2-4 сағаттан соң ОБТ түзілуінің айқын белгілері көрінді [31] . Мұны салат-латук өсімдігіне тән келмейтін Pseudomonas syringеae тұқымын инокуляциялағаннан кейін 5 сағат өткен соң салат-латук өсімдігі in-vivo жағдайында Н 2 О 2 өндіретіндігінің анықталғандығы растай түседі [27] . Басқа мәліметтердің хабарлауынша, қиярдың ( Cucumis sativus ) кутикуласын алып тастап, гипокотиль аймағын не салицил қышқылымен(СҚ) не 2, 6-дихлороизоникотин қышқылымен(ИНҚ) өңдеу арқылы қиярдың гипоко-тилінде жылдам жүретін реакцияны тудыруға болады, салицил қышқылы мен 2, 6-дихлороизоникотин қышқылы тіршілік ету барысында пайда болатын жүйелі төзімділіктің индукторлары болып табылады [32] . Мұндай гипокотильдерде Н 2 О 2 өндірілуі элиситерлеуден кейін 20 минут өткеннен соң аяқталады, бұл суспензиялық культура клеткаларында байқалатын өзгеріске ұқсас келеді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz