Қой қанының мононуклеарлы жасушасының иммобилденген простагландинсинтаза жүйесіндегі PGH-синтазаның пероксидазды белсенділігін зерттеу


ӘЛ-ФАРАБИ АТЫНДАҒЫ
ҚАЗАҚ ҰЛТТЫҚ УНИВЕРСИТЕТI
БИОЛОГИЯ ФАКУЛЬТЕТІНІҢ МАГИСТРАТУРАСЫ
Биотехнология, биохимия, өсiмдiктер физиология кафедрасы
Магистрлік диссертация
ҚОЙ ҚАНЫНЫҢ МОНОНУКЛЕАРЛЫ ЖАСУШАСЫНЫҢ ИММОБИЛДЕНГЕН ПРОСТАГЛАНДИНСИНТАЗА ЖҮЙЕСІНДЕГІ PGH-СИНТАЗАНЫҢ ПЕРОКСИДАЗДЫ БЕЛСЕНДІЛІГІН ЗЕРТТЕУ
Орындаған:
2 курс магистранты Лукпекова И. Л.
Ғылыми жетекшiлерi:
1. Б. ғ. д., профессорБейсембаева Р. У.
“”2007 ж.
2. Аспирант:Бедарева Т. Е.
“”2007 ж.
Норма бақылаушы: Әкімбекова Ә. Б.
“”2007 ж.
Қорғауға жiберiлдi:
кафедра меңгерушiсi,
профессор Иващенко А. Т.
“”2007 ж.
Алматы 2007
РЕФЕРАТ
Магистрлік диссертация жұмысы: кiрiспеден, негiзгi бөлiмнен, оның iшiнде әдебиетке шолу, зертеудегi материалдар мен әдiстемелер, анықтама, оны түйiндеу мен талқылау және қорытынды, қолданылған әдебиеттер тiзiмiнен тұрады. Жұмыс 40 беттен, бұнда 2 кесте, 17 сурет, қолданылған әдебиеттер саны 39, соның iшiнде 30 шет тiл әдебиеттерi.
Кiлт сөздер : простагландиндер, простагландинсинтаза жүйесi, PGH-син-таза, иммобилденген простагландин жүйесі, пероксидазды белсендiлiк.
Магистрлік диссертация жұмысының тақырыбы: Қой қанының мононуклеарлы жасушасының иммобилденген простагландинсинтаза жүйесiндегi PGH-синтазаның пероксидазды белсенділігін зерттеу.
Өзектiлiгi: Простагландинсинтаза жүйесi (PGSS) өзара байланысқан екi ферменттен тұрады: простагландин-Н-синтаза және простагландин-Н-конвертаза. Простагландин-Н-синтаза - лабильдi фермент болып табылады, ол реакция кезiнде инактивтелінеді. PGH-синтазаның лабильдi құрылымы in vitro жағдайындағы көптеген қасиеттерiн зерттеуге қиындық туғызады. Сол себептен, PGH-синтаза тұрақты болу үшiн, фермент препараттарын қатты үлгiдегi таратушыларда иммобилдейді.
Мақсаты:
- Мембрана фракциясындағы PGH-синтазаның пероксидазды белсенділігінің оптимальді мөлшерлерін зерттеу.
- Иммобилденген мембрана фракциясындағы PGH-синтазаның пероксидазды белсенділігінің оптимальді мөлшерлерін анықтау.
- Мембранамен байланысқан және иммобилденген мембрана фракциясындағы PGH-синтазаның пероксидазды белсенділігінің оптимальді мөлшерлеріне және олардың тұрақтылығына салыстырмалы анализ жүргізу.
Негiзгi мiндеттерi:
- Мембранамен байланысқан және иммобилденген PGH-синтазаның субстраттың және электрон қабылдағыштың мөлшерiне тәуелдiлiгiн зерттеу.
- Мембранамен байланысқан және иммобилденген PGH-синтазаның кофактордын мөлшерiне тәуелдiлiгiн анықтау.
- Мембранамен байланысқан және иммобилденген PGH-синтазаның пероксидазды белсендiлiгiнiң температура мен рН оптимум мағыналарын табу.
- Мембранамен байланысқан және иммобилденген PGH-синтазаның уақытқа тәуелдiлiгiн анықтау.
- Мембранамен байланысқан және иммобилденген PGH-синтазаның реакция барысына байланысты тәуелділігін анықтау.
Зерттелiнетiн әдiстер мен құрылғылар: биферменттi простагландинсинтаза жүйесінің мембрана фракцияларының препаратын алу, простагландин-Н-синтазаның белсендiлiгiн анықтау, иммобилденген мембрана фракциясындағы PGH-синтаза препаратын жасау, иммобилденген простагландиндер биосинтезiн жүзеге асыру. Спектрофотометр Specord UV VIS және VSU2-P, центрифуга К-24, MPW-330, -331, жарық микроскопы (Poland) .
Алынған нәтижелер: Мембранамен байланысқан және иммобилденген простагландин-Н-синтазаның пероксидазды белсендiлiгi гемин (кофактор), адреналин, гваякол (электрон қабылдағыштар), сутегiнiң қос тотығының (субстраттың бiреуi) оптимальдi мөлшерлерi және температурасы мен рН-оптимумы, уақытқа және реакция барысына байланысты тәуелділігі анықталды.
Тәжiрибелiк практикада қолданылуы: жұмыстың нәтижелерi ғылыми негiз ретiнде иммобилденген простагландинсинтаза препаратын in vitro алуда эффективтi әдiстер ретiнде, тұрақты және белсендi простагландинсинтаза жүйесiнiң әдiстерiнiң негiзi ретiнде қолдануға болады.
МАЗМҰНЫ
Қысқартылған сөздер тiзiмi 5
Кiрiспе 6
1 Әдебиетке шолу 7
1. 1 Простагландиндер физиологиялық қызметi және оның биосинтезi 7
1. 2 Простагландин Н синтазаның сипаттамасы 11
1. 3 Иммобилденген ферменттер 13
2 Зерттелiнген әдiстер мен материалдар 17
3 Алынған нәтижелер және оны талқылау 20
3. 1 Мембрана фракциясындағы PGH-синтазаның
пероксидазды белсенділігінің оптимальді мөлшерлерін зерттеу 20
3. 2 Иммобилденген мембрана фракциясындағы
PGH-синтазаның пероксидазды белсенділігінің
оптимальді мөлшерлерін анықтау 27
3. 3 Мембранамен байланысқан және иммобилденген
мембрана фракциясындағы PGH-синтазаның
пероксидазды белсенділігінің оптимальді мөлшерлеріне
және олардың тұрақтылығына салыстырмалы анализ жүргізу 34
Қорытынды 36
Пайдаланған дерек көздер тізімі 37
ҚЫСҚАРТЫЛҒАН СӨЗДЕР ТIЗIМI
PG - простагландиндер
PGSS - простагландинсинтаза жүйесі
PGН-синтаза - простагландин-Н-синтаза
сPLA 2 - цитозоль фосфолипаза А 2
PGВ 2 - простагландин В 2
PGD 2 - простагландин D 2
PGE 2 - простагландин E 2
PGF 2 - простагландин F 2
PGG 2 - простагландин G 2
PGН 2 - простагландин Н 2
PGI 2 - простациклин
TxA 2 - тромбоксан A 2
КIРIСПЕ
Простагландиндер (PG) - адам мен жануарлардың мүшелерiндегi әртүрлi физиологиялық процесстерге жан-жақты әсер етедi. Сүтқоректiлердiң организмiнде жүретiн көптеген процесстерiне простагландинсинтаза жүйесiнiң атқаратын қызметi зор. Простагландиндер клиникалық емдеулерде кең қолданылады. Мысалы: жараны, қан тамырларының қабынуын, демiкпенiң, қан қысымының көтерiлуiн емдейдi. Сондықтан простагландиндердi алу проблемасы актуальдi болып табылады.
Өзектiлiгi:
Простагландинсинтаза жүйесi (PGSS) екi ферменттiң өзара байланысуынан тұрады: простагландин - Н - синтаза және простагландин - Н - конвертаза. Простагландин-Н-синтаза - лабильдi фермент болып табылады, ол реакция кезiнде инактивацияланады. PGH-синтазаның лабильдi құрылымы in vitro жағдайындағы көптеген детальдi қасиеттерiн зерттеуді қиынға соқтырады. Сол себептен бұл PGH-синтаза тұрақты болу үшiн, фермент препараттарын иммобилдейді қатты үлгiдегi таратушыларда қолданады.
Мақсаты:
- Мембрана фракциясындағы PGH-синтазаның пероксидазды белсенділігінің оптимальді мөлшерлерін зерттеу.
- Иммобилденген мембрана фракциясындағы PGH-синтазаның пероксидазды белсенділігінің оптимальді мөлшерлерін анықтау.
- Мембранамен байланысқан және иммобилденген мембрана фракциясындағы PGH-синтазаның пероксидазды белсенділігінің оптимальді мөлшерлеріне және олардың тұрақтылығына салыстырмалы анализ жасау.
Негiзгi мiндеттерi:
- Мембранамен байланысқан және иммобилденген PGH-синтазаның субстраттың және электрон қабылдағыштың мөлшерiне тәуелдiлiгiн зерттеу.
- Мембранамен байланысқан және иммобилденген PGH-синтазаның кофактордын мөлшерiне тәуелдiлiгiн анықтау.
- Мембранамен байланысқан және иммобилденген PGH-синтазаның пероксидазды белсендiлiгiнiң температура мен рН оптимум мағыналарын табу.
- Мембранамен байланысқан және иммобилденген PGH-синтазаның уақытқа тәуелдiлiгiн анықтау.
- Мембранамен байланысқан және иммобилденген PGH-синтазаның реакция барысына байланысты тәуелділігін анықтау.
1. ӘДЕБИЕТКЕ ШОЛУ
1. 1. Простагландиндер және оның биосинтезі
Простагландиндер (PG) - әртүрлі организмдердің көптеген физиологиялық процестеріне әсер етеді, олар жасуша аралық ішкі медиаторларының туысы болып табылады. Простагландиндер адам мен жануарларда жүрек, қан тамырларда, жүйке, иммунды және репродуктивтi жүйелерде маңызды қызмет атқарады /1-5/. Ал, өсiмдiктерде олар қалыпты физиологиялық және биохимиялық процесстердi тыныштық күйiнде сақтайды және басқа биологиялық белсендi қосылыстардың әсер етуiн реттеп отырады /6/.
«Простагландин» терминін алғаш рет 1932 жылы Х. Эйлер күлдіреуік бездерден (Prostate-тобынан) биологиялық белсенді заттар деп бөліп алған. Ұлпа құрамына байланысты олардың жасушаларында бiрнеше простагландин түрi синтезделiп қызмет атқарады. Простагландиндерді мына топтарға жіктеуге болады: A, B, C, D, E, F, I. Кейбiр жағдайдайларда физиологиялық әсерлердің нәтижелерінің арасында қарама-қайшылық жағдай туады. Мысалы: TxA 2 - тромбоциттердiң агрегациясын көбейтедi, ал PGI 2 тромбоциттердiң агрегациясын тежейдi, ми ұлпасында PGD 2 ұйқыға әсер етедi, ал PGE 2 , керi әсер етеді, тыныс алу ұлпаларында PGE 2 өкпе бұлшық етiн босатады, ал PGF 2 α оның жиырылуына әкеп соғады /4, 5/.
Физиологиялық функциялардың барлық сатыдағы реттелуi простагландин әсерiне байланысты. Олар физиологиялық белсендiлiгтерді өзгертедi, гормондардың синтезiне әсер етедi.
Простагландиннің ерекше сипаттамалары мынандай:
- Бір простагландин бір жасуша типінде синтезделеді.
- Мүшелерде немесе ұлпаларда жұп простагландин - антагонист немесе антагонист ретінде арахидон қышқылының басқа туындысы - простагландин емес құрылымы болады.
- Простагландиндердің мөлшеріне, белсенділігіне, өзгергiштiгiне әртүрлі патология жауап береді.
- Простагландин әсерi жасуша аралық немесе мүше аралық деңгейде циклдық АМР пен байланысты болып келедi.
Сүтқоректiлер ағзаларындағы простагландиндер синтезiне простагландинсинтаза жүйесі жауапты. Адам және жануар ағзасындағы iшкi жасушаның реттелуіне, әртүрлi физиологиялық процестерде, простагландиндер жан-жақты әсер етедi.
Простагландиндер - адам және жануарлар жасушаларында қанықпаған май қышқылдарынан синтезделінеді, көбінесе арахидон қышқылынан алмаспайтын С 20 қанықпаған май қышқылында. Простагландинерді табиғи простан қышқылдарының туындылары деп қарастырады. Простагландиндердің биосинтезі екі сатыда жүреді. Алғашқы сатыда арахидон қышқылы мембранды фосфолипидтерден босап шығады /8/. Нәтижесінде арахидон қышқылы жасушада толығымен этерифицирленеді. Арахидон қышқылы мембранды құрамына кіріп, глицериннің екінші көміртек атомымен байланысады. Құрамында арахидон қышқылы бар фосфолипидтерге: фосфотидилхолин, фосфотидилсерин, фосфотидилэтаноламин және фосфотидилинозиттерді жатқызуға болады (1-сурет) /9, 10/.
Мембранды фосфолипидтер - арахидон қышқылының көзі
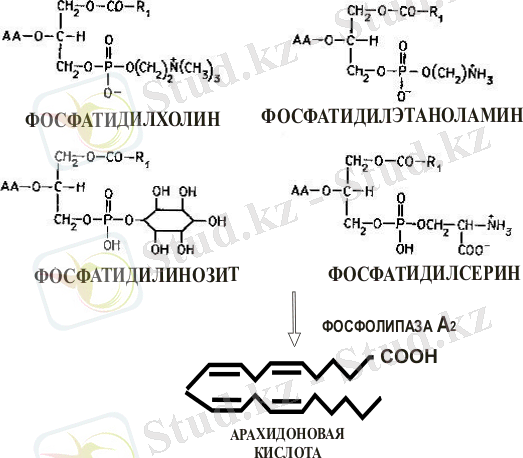
Қысқартылған сөздер: АА - арахидон қышқылы, R 1 - май қышқылының бөлігі
Сурет 1
Арахидон қышқылының фосфолипидтерден босап шығуы - Са 2+ тәуелді цитоплазматикалық фосфолипаза А 2 мен панкреатті Са 2+ тәуелді А 2s ІІ фосфолипазалар көмегімен жүзеге асады. Бірінші фермент - арахидон қышқылы фосфолипидтерінің эндоплазматикалық ретикулум мен ядролы қабықшасынан босап шығады. Ал, екінші ферменті - фосфолипидтердің плазматикалық мембранасынан босап шығады /7/.
Келесі сатыда арахидон қышқылы белгілі бір простагландиндер типіне өзгеруі ферменттердің кезектесуінен жүзеге асады. Барлық простагландин түрлерінің синтезіне простагландинсинтаза жүйесі жауапты. Ол екі ферменттен тұрады: простагландин-H-синтаза (PGH-синтаза) және простагландин-H-конвертаза (PGH-конвертаза) . Простагландинсинтаза жүйесінің негізгі ферменті - PGH-синтаза (К. Ф. 1. 14. 99. 1) простагландин биосинтезінің жылдамдығын реттейді. Бұл фермент арахидон қышқылының конверсиясын катализдеп, оны простагландин H 2 -ге айналдырады.
Содан кейін PGH-конвертазаның әсерінен PGH 2 белгілі бір простагландин түріне айналады. Бұл фермент простагландин түрін белгілейді /4, 7, 8/.
Простагландиндер биосинтезінің реттелуі in vivo кезінде субстрат деңгейінде жүзеге асады. Жасушадағы арахидон қышқылының концентрациясы фосфолипаза көмегімен мембранды фосфолипидтердің босап шығуына тәуелді /7/. Кейбір заттар фосфолипаза синтезіне және белсенділігіне әсер етіп, простагландиндердің концентрациясын өзгереді. Бұл заттарға циклді АМФ, форбол эфирі, өсу факторлары, цитокиндер, гормондар, кальций иондары, стронций, мырыш, кальций тасымалдаушы ионоформалар жатады /4/.
Простагландиндер синтезі PGH-синтаза белсенділігінің регуляциясы арқылы бақыланады. PGH-синтазаның ген экспрессиясы өсу факторларымен және гормондармен (прогестерон, эстрадиол, глюкокортикоид, брадикинин) стимульденеді /4/. Нәтижесінде фермент de novo синтезделеді. PGH-синтазаның de novo синтезделуі үшін, эндогенді радикалдар қажет. Эндогенді радикалдар ретінде азот оксидін алуға болады. Олар пероксинитритті тудырады, холоферментті жол арқылы тирозил радикалын пайда болуын активтендіріп, PGH-синтазаның каталитикалық белсенділігіне жауап береді. Арахидон қышқылының биферментті жүйесі әсерінен простагландиндерге айналуы 2-ші суретте көрсетілген.
АРАХИДОН ҚЫШҚЫЛЫНЫҢ БИФЕРМЕНТТІ ЖҮЙЕСІ ӘСЕРІНЕН ПРОСТАГЛАНДИНДЕРГЕ АЙНАЛУЫ
Сурет 2
1. 2. Простагландин Н синтазаның сипаттамасы
PGH-синтаза - интегралды мембраналы белок, молекуласы 587 аминқышқыл қалдығынан құралады, молекулярлы салмағы 13-ға тең. Фермент молекуласы екi суббөліктен құралған. Олардың әр-қайсысының молекулярлы салмағы 7-ға тең. PGH-синтаза - гликопротеин тәрiздес. Оның құрамында 3, 4 % қант, 1 моль белокқа 12 моль манноза және 5 моль N-ацетилглюкозамин кіреді /11, 12/.
PGH-синтаза - субстрат ретінде қанықпаған май қышқылын (мысалы, арахидон қышқылы), екi молекулалы оттегi мен электрон қабылдағышын қолданатын үш субстратты фермент.
PGH-синтаза молекуласы үш доменнен құрылған. Бiрiншi компакты доменді 34-72 аминқышқыл қалдықтары құрады. Нәтижесінде белоктар арақатынасы түзіледі. Екiншi домен құрамына 13-116 амин қышқыл қалдықтары кiретiн амфипатикалық оңға бұрылған α-спиральдан тұрады. Оның негiзгi қызметі - PGH-синтазаны мембранамен байланыстыру. Үшiншi домен, 117-587 аминқышқылы қалдықтары негiзгi орталықтарынан табылады /13, 14/.
Циклооксигеназды белсендi орталық - арахидон қышқылы көмiртек қаңқасының циклденуiне және оттегiнiң екi молекуласының сутегінің қос тотығына айналуына жауапты. Реакция нәтижесiнде арахидон қышқылы PGG 2 -ге дейін өзгередi. PGH-синтаза пероксидазды белсендi орталығы екi қызмет атқарады: циклогеназды реакция нәтижесiнде алынған PGG 2 -нi PGH 2 -ге айналдырады және циклооксигеназды реакциясын катализдейдi. Ол - екi электронды тасымалдау арқылы субстратты қайта қалпына келтiретiн және сутегінің қос тотығы көмегiмен әр түрлi субстраттар - электрон қабылдағыштардың тотығуын катализдейтiн гем тәуелдi пероксидаза /15/.
Қой күлдіреуік безiнен бөлініп алынған PGH-синтазаның циклооксигеназды белсендi орталығы - ұзын және жiңiшке каналдан құралады. Ол екінші доменнiң сыртқы жағында орналасады. Пероксидазды белсендi орталық PGH-синтазаның үлкен және кiшi бөлiктерiнiң арасында каталитикалық доменде орналасқан. Оның құрамына Fe (III), протопорфирин IХ кіреді /16, 17/.
Инициация кезiнде циклооксигеназды белсенділік сутегінің қос тотығын қажет етеді /19/.
Осы уақытқа дейін қойдың жатырынан, күлдіреуік безінен және қанның бір ядролы жасушаларынан алынған простагландин-Н-синтазаның циклооксигеназды белсенділігі жан-жақты зерттелінген болатын. Нәтижесінде ферменттердің айырмашылықтары мен ұқсастытығы сипатталған.
Қойдың күлдіреуік безінен бөлініп алынған PGH-синтазаның пероксидаздық белсенділігі зерттелініп, қойдың перифериялық қанынан алынған мононуклеарлы жасушаларындағы иммобилденген мембраналық фракциясының PGH-синтазаның пероксидаздық белсенділігі анықталмаған болатын. Сол себепті біздің мақсатымыз - пероксидазды белсенділікті анықтау /19, 20, 21/.
Простагландин-Н-синтазаның изоформалары
PGH-синтаза барлық жасушаларда экспрессияланып физиологиялық функцияларды бiр қалыпта ұстап тұрады. Қазiргi кезде простагландин-Н-синтаза ферментiнiң 4 изоформасы белгiлi. Олардың үшеуi (PGH-синтаза-1, PGH-синтаза-2а және PGH-синтаза-3) конституционды, ал бір изоформасы (PGH-синтаза-2) индуцирлі синтезделеді /22, 23/.
PGH-синтаза-1 PGE 2 мен PGI 2 простагландиндердiң синтезiне жауапты. Ол фермент асқазан сөлiнде қорғаныс қызметiн атқарады. PGH-синтаза-2а асқазан сөлiнiң қан айналымына байланысты бүйректің сұйықтық балансын реттеп отырады. PGH-синтаза-3 орталық жүйке жүйесінде пайда болған ауырғыш рецепцияны реттейді. Егер осы ферменттердiң белсенділігi мен концентрациясы төмендесе, организмде әртүрлi патологиялық өзгерiстер пайда болады.
PGH-синтазаның конституционды және индуцирленген изоформаларын синтездеуге екi ген (Сох-1 және Сох-2) жауапты /24, 25/. Бұл гендер жасушада үнемі кездесiп отырады да, патологиялық өзгерiсте цитокин мен эндотоксин әсерінен моноциттер мен макрофагтарда Сох-2 генiнiң экспрессиясын жоғарлатады /26, 27/.
Chandrasekharan N. V. және т. б. /23/ PGH-синтаза-1 және PGH-синтаза-3 ферменттерiнің Сох-1 генімен кодталатынын дәлелдеген. Бiрақ PGH-синтаза-3 өзiнiң мРНК-да бір интронын сақтайды, нәтижесінде гидрофобты PGH-синтаза-1 пептидiнiң сигналы эндоплазматикалық ретикулумның аузына қарай бағытталып, енедi. Ол сүтқоректiлердiң түрiне байланысты болып келеді.
Индуцирленген PGH-синтаза-2 және конституционды PGH-синтаза-2а Сох-2 генiмен кодталады. Iсiк агенттерiнiң (интерлейкин, цитокин, эндотоксин және т. б. ) индуцирленген PGH-синтаза-2 синтезіне әсерін зерттеген кезде олардың мРНК-сын стимульдейтіні және өзiнiң мөлшерiн жасушада көбейтетіндігі анықталған /28/.
Барлық PGH-синтазаның изоформалары субстрат ретiнде арахидон қышқылын қолданады. Бұл изоформалар жасушада өзінің әртүрлi орналасуымен өзгешеленедi. PGH-синтаза-1 эндоплазматикалық ретикулумда, ал PGH-синтаза-2 мен PGH-синтаза-3 эндоплазматикалық ретикулумда орналасады /23, 29/.
PGH-синтаза-1, PGH-синтаза-2, PGH-синтаза-3 изоформаларының құрылымдары жақсы зерттелінген, ал PGH-синтаза-2а-ның құрылымы әлi анықталмаған.
1. 3. Иммобилденген ферменттер
Простагландиндi алудың негiзгi үш жолы бар. Олар - табиғи нысанадан бөліп алу, химиялық синтез арқылы алу және биотехнологиялық әдіс арқылы биокатализатор ретінде простагландинсинтаза жүйесін қолдана отырып алу.
Табиғи нысанадан бөлiп алу: Простагландиндер алғаш рет 1969 жылы горгониев кораллынан ( Plexaura homomalla) бөлініп алынған. Олардың құрамында PGA 2 -нің метилацетат эфирі бар. Upjohn фирмасының зерттеушілері простагландиндерді бөліп алу және PGE 2 және PGF 2 -ті өзгерту туралы әдістеме жасап шығарды. Алайда бұл әдiс өте қымбатқа түстi, себебi простагландин жасушада өте аз мөлшерде синтезделiп, жинақталмайтындықтан тиiмсiз болып келедi /30/.
Химиялық синтез арқылы алу: 60-жылдардың соңында Гарвард университетінде простагландиндердің химиялық синтез арқылы бөліп алу әдістемесі анықталды. Осы әдістемені көптеген фармацевтикалық фирмалар қолданған /30/. Бірақ бұл әдіс тиімсіз. Себебі, белсендi аналогтарды алу үшiн энергияға бай реакциялар қажет болды. Бұл әдіс көмегімен простагландиннiң биологиялық белсендi аналогтарын алады.
Қазіргі кезде простагландиндерді алудың перспективті әдісі ретінде биотехнологиялық әдiсті алуға болады /31/. Алғаш рет 1964 жылы қойдың перифериялық қанынан алынған бір ядролы жасушаларындағы PGE 2 -нің ферментативті синтезі, арахидон қышқылынан іске асырылған. Бұл жаңалықты Швеция (Bergstrwm., Danielsson, Samuelsson) мен Голландия (Van Dorp. Beerthuis et al. ) зерттеушілері паралельді жүргізген. Upjohn (АҚШ) фирмасы, қанықпаған май қышқылы туындыларынан тазартылмаған қойдың перифериялық қанынан алынған бір ядролы жасушалардан, простагландиндерді бөліп алған. Бұндағы өндірістегі қиындықтың бірі реакциялық ортадан мембрана фракциясын бөліп алу және ферменттің жоғарғы лабильділігі, сондықтан мембрана фракциясын қайта қолдануға мүмкіншілік жоқ /9/.
Жоғарғы аталған қайшылықтардың бәрі гетерогенді биокатализаторларды қолдану барысында шешіледі, ол простагландинсинтаза жүйесін қатты тасушыларда иммобилдеу арқылы жүзеге асады.
Ферменттерді иммобилдеу - бұл (биокатализатор молекуласын) бос ерітінді фазасынан бөлінген, бірақ онымен субстрат, эффектор немесе ингибитор молекулаларымен алмасуға қабілеті бар қандай да бір фазаға биокатализатор молекуласын қосатын әдістеме.
Иммобилденген ферменттерді нативті ферменттермен салыстырғанда елеулі артықшылықтары бар /32/. Мысалы, олар реакциялық ортадан оңай бөлінеді. Бұл реакцияны кез-келген уақытта тоқтатып, катализатормен ластанбаған өнімдерді алуға және фермент препаратын бір немесе бірнеше рет пайдалануға мүмкіндік береді. Иммобилденген ферменттерді пайдаланған технологиясы сондай-ақ, биотехнологиялық процестерді үздіксіз жүргізу, катализдейтін реакцияның жылдамдығын реттеу, ағынның жылдамдығын өзгерту жолымен өнімді шығару мүмкіншілігімен сипатталады. Иммобилизация әдістерімен, сәйкес тасымалдаушыларды іріктеп алу, ферменттердің арнайылығын көрсететін рН-, температураға тәуелділік, сондай-ақ денатурациялаушы әсерлерге тұрақтылық сияқты қасиеттерді мақсатты түрде өзгертуге болады /32/.
Иммобилденген ферменттердің тасымалдаушылары ретінде табиғи және синтетикалық, органикалық және бейорганикалық, жоғарғы және төмен молекулалы әртүрлі заттарды пайдалануға болады.
Органикалық тасымалдаушылар шығу тегіне байланысты екі класқа бөлінеді:
- Табиғи полимерлер
- Синтетикалық полимерлер
Табиғи полимерлер химиялық табиғатына байланысты белоктық, полисахаридтік және липидтік болып бөлінеді. Целлюлоза, декстран, агароза және олардың туындылары сияқты полисахаридтерді тасымалдаушы ретінде кеңірек пайдаланады. Олар қолайлы, әртүрлі функциональді топтарының болуы, жоғарғы деңгейдегі гидрофильділігі мен ерекшеленеді, ал кемшіліктері - микроорганизмдер әсеріне сезімтал және бағасы жоғары.
Синтетикалық полимер тасымалдаушылар негізінде жасалады: стирол, дивинилбензол, акрил қышқылы, поливинил спирті, полиуретан.
Органикалық төмен молекулалы тасымалдаушылар - бұл табиғи липидтер немесе олардың синтетикалық аналогтары. In vivo-да ферментативті реакциялар жасуша ішілік немесе жасушалық мембрананың беткі жағында жүретіні белгілі, сондықтан липид - фермент моделі энзимнің жасушада қызмет ететін жағдайына жақындатылып жасалған. Липидтік тасымалдаушылар әртүрлі беткейлерде моноқабат түрінде немесе сфера пішінді биқабат (липасома) түрінде пайдаланады. Липасомаларды алғаш рет 1964 жылы А. Вэнгем сипаттаған. Оларды дайындау үшін негізінен фосфолипидтерді пайдаланады. Липасомалардың көлемі және пішіні бастапқы субстраттың табиғатына, дайындалу тәсіліне, ортаның қышқылдығы және бейорганикалық заттардың болуына тәуелді. Иммобилденген катализаторлар қарапайым жолмен алынуы және оңай регенерациялануы есебінен, оның осындай табиғи биомембраналарға жақын болуынан оны in vivo-да қолдану мүмкінділігі липасоманы ферменттің тасымалдаушысы ретінде кең қолдануға себепкер болады.
Қазіргі кезде тасушы ретінде липидтердің синтетикалық аналогтары - беттік белсенді заттарды енгізіп жатыр. Құрамында полярсыз көмірсутектік бөлігі, полярлы басы бар. Полярлы басында әртүрлі функциональді топтардың болуына байланысты беттік белсенді заттардың төрт типін ажыратады: аниондық, катиондық, иондық емес және цвиттериондық. Белгілі беттік белсенді заттардың көбісі көп тоннажды өндірістің өнімі болып табылады, мысалы, «Serva» фирмасынан құрылымы әртүрлі беттік белсенді заттардыдың тек иондық түрі SO атпен шығарылады. Құрамында беттік белсенді заттардың қоспасы бар «Ока», «Био» тәрізді синтетикалық жуғыш заттар липидтердің синтетикалық аналогтарын иммобилизация тасымалдаушысы ретінде пайдаланудың мысалы болып табылады.
Органикалық емес тасымалдаушылар - силикагель, сазбалшық, керамика, табиғи минералдар және олардың оксидтері негізіндегі матрицалар. Олар саңылаулы және саңылаусыз болуы мүмкін және түйіршікті немесе монолиттік түрінде пайдаланылады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz