Ақтөбе хром қосындылар зауытының өндірістік қалдықтарының қоршаған ортаға әсері және қалдықтарды азайту жолдары


Жұмыс түрі: Дипломдық жұмыс
Тегін: Антиплагиат
Көлемі: 67 бет
Таңдаулыға:
Кіріспе
Тақырыптың өзектілігі. Ақтөбе облысы Қазақстандағы ең үлкен индустриялды облыстардың бірі. Облыс аумағында мұнай-газ саласындағы, химиялық және тау-кен саласындағы көптеген үлкен өнеркәсіптер орналасқан. Ақтөбе облысы бойынша 9923 табиғат пайдаланушы кәсіпорындар тіркелген оның ішінде 96 объект стратегиялық, 59-экологиялық қауіпті, 4-транс шекаралық облыс бойынша, 170 кәсіпорын қауіптілік дәрежесі бойынша 1-ші қауіптілік класына жатады.
2007 жылы облыстың экологиялық жағдайы былтырғы жылмен салыстырғанда айтарлықтай өзгерген жоқ. Өндіріс объектілерін экологизациялау іс-шараларын қолдануға қарамастан облыстық экологиялық жағдайы күрделенуде. «АХҚЗ» АҚ еліміздегі негізгі химиялық кәсіпорындардың бірі өз жұмысын 1958 жылдан бері жалғастырып келеді. «АХҚЗ» АҚ іс-әрекеті нәтижесінде атмосфералық ауа, гидросфера және литосфера ластанады. «АХҚЗ» АҚ гидросфера тигізетін зиянды әсеріне дәлел ретінде Орал өзенінің саласы трансшекаралық Елек өзенінің алтывалентті хроммен ластануын атап көрсетуге болады. 2007 жылдан бастап Бестамақ с. Бордың мөлшері нормадан 40, 0 есе асты. Елек өзенінің суының сапасы 6-шы сыныпқа яғни өте ластанған суға жатады. Георгиевка с. алтывалентті хром 7, 65 ШРК құрады. Судың сапасы 4 класқа жатады. Бестамақ селосындағы Елек өзенінің су сапасы 7 класқа жатады яғни төтенше ластану дәрежесіне жатады.
«АХҚЗ» АҚ өндірістік процесс нәтижесінде түзілген шлам қалдықтары шлам жинақтағыш - тоғандардан сүзіліп немесе желмен ұшуы салдарынан гидросфера және литосфера ластанады . Жалпы облыс аумағында үлкен кәсіпорынның айналасында миллиондаған тонна өндірістік қалдықтар жинақталған, «АХҚЗ» АҚ (12, 3 млн. тн. монохромат, натрий сульфаты, күкіртті натрий шламдары жинақталған) . «АХҚЗ» АҚ - (11, 0 млн. тн. феррохром шланктары), ДКБК-(752 млн. тн. ашылған жыныстар, 13, 0 млн. тн. байыту шламдары) Ақтөбе ЖЭО-(2, 26млн. тн. күлдішлак түріндегі қалдық) . Осы жинақталған қалдықтардың әсерінен қоршаған орта ластануда. Сондықтанда осы дипломдық жобаның басты мақсаты «АХҚЗ» АҚ қоршаған ортаға тасталатын өндірістік қалдықтарының мөлшерін азайту жолдарын қарастыру болып табылады.
Бұл дипломдық жобаның мақсаты - «АХҚЗ» АҚ қоршаған табиғи ортаға тигізетін антропогенді әсерін анықтау.
-шлам құрамындағы ауыр металдардың физико-химиялық сипаттамасын және олардың адам организміне тигізетін әсерін талдау;
-қоршаған орта компоненттерінің күйін мониторингтік зерттеу;
-өндірістік процесс нәтижесінде түзілген қалдықтардың мөлшерін азайтуда қолданылатын тиімді әдістерді қарастыру;
- «АХҚЗ» АҚ зиянды ластағыш заттарының қоршаған ортаға тигізген экономикалық шығынын анықтау.
Дипломдық жобада «АХҚЗ» АҚ өндірістік қалдықтарының қоршаған ортаға, тигізетін әсері және ауыр металдардың адам организіміне тигізетін әсері қарастырылған. Сондай-ақ қоршаған орта компонентерін мониторингтік зерттеу жұмыстарының мәліметтері келтірілген.
1«АХҚЗ» АҚ өндірістік қалдықтарының және шығарындыларының аймақтың қоршаған орта компоненттеріне тигізетін антропогендік әсері
1. 1 Ақтөбе хром қосындылар зауытының негізгі мәліметтері
1. 1. 1 Кәсіпорын орналасқан аймақтың физико-географиялық сипаттамасы
Ақтөбе хром қосындылар зауыты Ақтөбе қаласының солтүстік-шығысында, тұрғылықты жерден 1000м арақашықтықта орналасқан. Содан 700 м арақашықтықта қала тұрғындарының саяжайлары қоныстанған. Кәсіпорын тереториясының жалпы ауданы 630 га. АХҚЗ АҚ шығыс жағынан Елек өзені және оның сол жақ саласы жағынан Жіңішке өзені ағып жатыр. АХҚЗ АҚ іргелес 300 м ара қашықтықта еліміздегі ең үлкен металлургиялық кешендердің бірі «Казхром» транс ұлттық компаниясының бөлімшесі «Ақтөбе ферроқорытпа зауыты», сондай - ақ осы кәсіпорынның шығысында ЖЭО орналасқан. Сонымен қатар өнеркәсіптік аумақта тағы да басқа көптеген кәсіпорындар шоғырланған (1. 1сурет) .
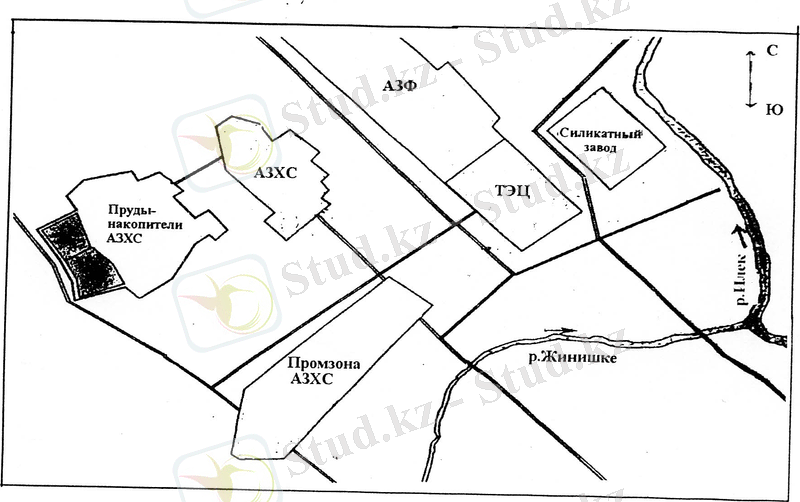
1. 1-сурет кәсіпорынның орналасу аймағы.
Ақтөбе облысының климаты құбылмалы, тез континентальды болып келеді. «Казгидромет» метеорологиялық бақылауларының мәліметтері бойынша қыс айларында максимальды минустық температура 47-52, 5ºС, ал жаз айларындағы максимальды қалыпты температура +32, 9ºС көрсеткішті көрсетеді. Ең салқын айлардағы орташа айлық температура -18, 2 ºС, тең жылы айлардағы орташа айлық температура +24, 9ºС жетеді. Жауын-шашынның жылдық мөлшері 95 мм-ден 500 мм аралығында болады. Жылына орта есеппен 420 мм жауын-шашын жауады.
Геологиялық барлау жұмыстарының бақылаулары бойынша облыс аумағында топырақтың қату тереңдігі 250 мм. Ал, жер асты сулары 8-17 м тереңдікте орналасқан. Ақтөбе облысында қыс айларында қатты бұрқасын боран соғуы ықтимал, ал жаз айларында дауыл тұрып желдің жылдамдығы 75-85км/сағ жетеді. Желдің соғу бағыты шеңберлі, яғни жел бағыты барлық румбалар үшін біркелкі. Бірақта ең көп соғатын жел бағытын жылдық қайталанудың 16%-дық үлесін құрайтын оңтүстік-шығыстан соғатын жел құрайды. Желдің жылдамдығы 75-83 км/сағ аралығында болады. Қар жамылғысының биіктігі 20-35 см, желдің тұрақты түрде соғуына байланысты Елек өзенінің маңайында қардың биіктігі 100-150 см жетеді. Су таситын уақытта Елек өзені арнасынан асып жан-жаққа жайылып, жағалаулық топырақ сүзіледі.
1. 1. 2 АХҚЗ АҚ негізгі атқаратын қызметі және хром қосылыстарын өндіруде қолданатын негізгі технологиялары
АХҚЗ АҚ химиялық хром қосылыстарын шығаратын Қазақстандағы жалғыз кәсіпорын болып табылады. Кәсіпорын өз қызметін 40 жылдам астам уақыт бойы жалғастырып келеді. АХҚЗ АҚ Ресей, Италия, Германия және т. б. дамыған мемлекеттердің кәсіпорындарымен нарықтық бәсекелестікке түсіп өзінің өнімін дүниежүзінің 28 мемлекетіне экспорттайды. Хромды металлургия, мұнай және газ өнеркәсібінде, тамақ өнеркәсібінің салқындатқыш қондырғыларына кеңінен қолданады. Хромды болаттар қатты берік, коррозияға төзімді болады. Барлық тотықпайтын болаттың құрамында хром болады. Әр түрлі металлдардан жасалған автомобиль бөлшектерін, аспап-саймандарды коррозиядан сақтау үшін хроммен қаптайды. Хроматтар мен дихроматтар күшті тотықтырғыштар бұларды машина майларын, балауыздарды ағартуға, қопарғаш заттар жасау үшін пиротехника өнеркәсібінде сондай-ақ жол құрылысында қолданады. Хром тұздары жүннен жасалған заттарды бояудың алдында басытқы ретінде қолданылады. Хром сульфаты илегіштерін (Cr2(SO4) 3∙18H2O) тері өңдеуге және т. б. өнеркәсіптерге қолданады. Хром илегіші ерітіндісімен өңделген тері су сіңірмейді. Қатты әрі төзімді келеді. Хром пигменттерін бояу шығаратын кәсіпорындар көп мөлшерде тұтынады. Қазіргі кезеңде хром қосылыстарын тұтыну қарқыны жылдан-жылға артуда.
Жалпы 630 га ауданды алып жатқан кәсіпорынның өнеркәсіптік аумағында 6 цех және қосалқы өнеркәсіптік обьектілер: қазандық, жөндеу-механикалық цехы, жанар-жағар май қоймасы, дәнекерлеу цехы және т. б. обьектілер орналасқан
«АХҚЗ» АҚ төмендегідей өнімдерді шығарады:
- натрий монохроматы (Na2CrO4) -цех №1 және 2
- натрий бихроматы (Na2Cr2O7) -цех №3
- металлургиялық хром тотығы (Cr2O3) -цех №4
- хром сульфаты илегіші (Cr2(SO4) 3∙18H2O) -цех №4
- калий бихроматы (жаңа өндіріс) -цех №4
- хром ангидриді және илегіші(CrO3) -цех №5
- пигментті хром тотығы -цех №5
- күкіртті натрий(Na2SO3) -цех №6
Хром қосылыстарын өндіруде негізгі шикізат ретінде хромит кендері қолданылады. FeO∙Cr2O3 хромиті текшелі (кубической) жүйенің изоморфты класына жатады, негізгі атауы шпинел, олардың құрамы жалпы формуламен сипатталады: ХО∙У2О3, мұндағы х-көбінесе темір, кальций, магний немесе марганец ионы, У-хром немесе алюминий ионы. Хромиттер табиғатта көбінесе алюминиймен бірге кездеседі. Соның салдарынан хром кендерінде Cr2O3 құрамы 50-55% асуы сирек кездеседі, ал олардың кейбірінің құрамына 20 % Al2 О3 және MgO кіреді.
«АХҚЗ» АҚ хром қосылыстарын өндіру негізгі өнеркәсіптік шикізат ретінде Кемпірсай кенішінің кендерін қолданады. Кемпірсай кенорнының кендерінің негізгі құрамын келесі элементтер құрайды (%) :
Cr2O3 45-65, 5 %
SiO2 0, 5-12 %
FeOжалпы 10-22 %
Al2 О3 8, 5-15 %
MgO 11-18 %
CaO 0, 5-3 %
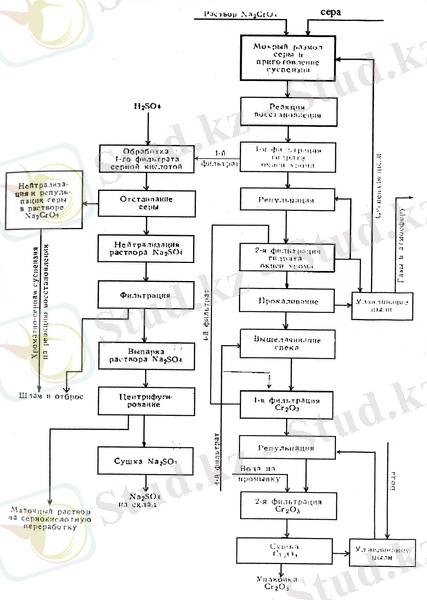
Хромитті өңдеудің алғашқы өніміне «сары» сілті деп аталатын натрий ерітінділері жатады, одан көптеген хром қосылыстарын: натрий бихроматын, хром ангидридін және тағы да басқа көптеген өнімдер алуға болады. Өнеркәсіпте шығаратын негізгі хром қосылыстарының өнімдеріне жататындар: Na2Cr2O7, Cr2O3, Na2Cr2O7, CrO3, К2CrO7. Негізгі хром қосылыстарын өндіру 1. 1. 3 суретте көрсетілген.
Натрий хроматын өндіру. Na2CrO4 хром кенінен, кальциленген содадан, доломиттен тұратын шихтаны жоғарғы температуралық тотықтыру әдісі арқылы алады. Күйдірілген массаны сілтілейді және түзілген Na2CrO4 ерітіндісін ерімейтін тұнбадан бөледі.
1. 3 суретте натрий хроматы ерітіндісін өндірудің технологиялық схемасы, ал 1. 4 суретте шихта даярлау бөлімінің апаратуралы-технологиялық схемасы келтірілген. Na2CrO4 ерітіндісін өндіру кезеңі: шихтаны дайындай, шихтаны тотықтырып күйдіру, спекті шаймалау, шламды қойыртпақты фильтрлеу, монохромат сілтілерін тазарту.
Бастапқы шикізаттарға жататындар: хромит, әктас, известняк, кальциленген сода және т. б. Үгітілген ұнтақты алдын ала анықталған деңгейде араластырады, тотықтыру үшін айналмалы пеште 1000-1200ºс температурада күйдірілуге түседі. Құрамында кремний тотықтары бар хромның ерімейтін тотығын сілтімен тотықтыру арқылы еритін хроматқа айналдырады. Бір жұмыс процесі кезеңінде хром жүзгіндерден бөлінеді. Пештен шыққан хромат спекі сілтіден бөлінеді және айналмалы ылғалды үгіту диірменінде ұнтақталады. Монохроматты қойыртпақ қатты бөліктердің (қалдық) сұйықтардан бөлінуі жүретін барабанды вакум-фильтрде сүзіледі. Натрий хроматын өндіру нәтижесінде монохромат шламы түзіледі. Түзілген монохромат шламын жинақтағыштарға сақтауға жібереді.
Монохромат шламының түзілу мөлшері басқа өндірістік қалдықтармен салыстырғанда өте көп. «АХҚЗ» АҚ 2001 жылдан бастап өнеркәсіпке аз қалдықты технологияны енгізу жолға қойылды, осы аз қалдықты технологияны қолданудың нәтижесінде шлам жинақтағыштарда монохромат шламының жинақталу көлемі төрт есе азайды. Ескі технология бойынша 1тн натрий монохроматын өндіргенде шлам жинақтау тоғандарында 3тн шамасында монохромат шламы жинақталды. 2001 жылы өндіріске жаңа аз қалдықты технология енгізілгеннен бастап 1тн натрий монохроматын өндіргенде монохромат шламының жинақталуы 0, 75 тн құрады. 2007жылы 283, 9 мың тн монохромат шламы түзілді, 215, 8 мың тн (76%) шлам өндіріске қайтарылып қайтадан қолданылды. Сулы қойыртпақ түріндегі 68, 1 мың тн (24%) монохромат шламын капиталды шығындарды талап ететін және ауа сондай-ақ су көздерінің санитарлық жағдайының толықтай қауіпсіз деңгейде сақталуын қамтамасыз ете алмайтын шлам жинақтау тоғандарына орналастырылады. Na2CrO4 өндірісінде кәсіпорын алаңының ауасы құрамында СО2 және су буы бар күйдіру пешінің шығарынды газдарымен ластанады.
Натрий бихроматын өндіру. Жоғарыда алынған натрий хроматының ерітіндісі (150-200г/л) 1. 5 суретте көрсетілген технологиялық схема бойынша қатты натрий бихроматы өнімін алуда қолданады.
Өндіру кезеңі: сары сілтілерді алюминиден тазарту, монохромат ерітінділерін травилдеу (бихроматизация) . Натрий бихроматы ерітіндісін концентрлеу, натрий сульфатын бөлу, Натрий бихроматының дайын өнімін алу. Na2CrO4 ерітіндісін күкірт қышқылымен травилдейді, түзілген алюминий гидроксидін фильтр-прессте бөліп алады. Тұндырылған сілтіні травление жасау багіне жібереді, мұнда Na2CrO4 күкірт қышқылымен Na2Cr2O7 ерітіндісіне айналдырады. Травилденген ерітінді вакуумдық-қайната суалту (выпаривание) қондырғысына түседі. Суалтылған ерітіндіден центрифугалау (центрифугада қойыртпақ және эмульсияларды дисперсті фазаға және дисперсті ортаға бөлу процесі) арқылы Na2SO4 тұнбасын бөледі содан соң натрий бихроматы өнімін алады.
Натрий бихроматын өндіру кезінде алюминий гидро тотығы (хромаль) түзіледі, оны репульпирациялап тұндырғыш-тоғанға насос арқылы айдайды.
Хром ангидридін өндіру. Жоғарыда түзілген концентрленген монохромат ерітіндісі хром ангидридін өндіргенде бастапқы шикізат болып табылады 1. 6 суретте өндіру жолы, 1. 7 суретте CrO3 өндірісінің апаратуралы-технологиялық схемасы келтірілген. Өндіру кезеңі: Na2Cr2O7 ерітіндісін концентрлеу, Na2Cr2O7 күкірт қышқылымен ыдырату, NaНSO4-нан хром ангидридін тұндыру және бөлу, CrO3 өнімін алу, шығарынды газдарды тазарту, хроматты ерітіндіні биосульфатпен травилдеу және Na2Cr2O7 ерітіндісін мөлдірлеу.
Хром ангидридін өндірген кезде түзілген хром сульфатының ерімейтін қышқыл тұнбалары қоршаған ортаны ластайтын заттек болып табылады. Ол репульпацияланғаннан кейін тұндырғыш тоғанға жіберіледі.
Хром оксидін өндіру. Cr2O3 1. 8 суретте көрсетілген хроматты-күкірт әдісімен алады. процесс келесі кезеңдерден тұрады: күкірт қойыртпағын дайындау, натрий хроматын тотықсыздандыру, хром тотығын тиосульфат ерітіндісінен бөлу, хромның гидрат тотығын тотықтырып күйдіру, спекті сілтілеу және хром ангидридінен суда еритін тұздарды бөлу, хром тотығын кептіру.
Хром гидрат тотығын бөліп алғанда және жуғанда түзілген 140-180 г/л мөлшерлі натрий тиосульфаты (Na2S2O3 ) фильтраты және аз мөлшердегі Na2S, Na2SO3 , Na2SO4, Na2S, NaОН және Na2CO3 өндірісте қайтадан қолданылуы қажет. Олар алдын ала хром тотығын күйдіру пештерінің шығарынды газдарынан шаңдарды ұстау үшін қолданылады.
Хром қосылыстарын өндірудің келтірілген технологиясын талдай отырып хром қосылыстарын өндіргенде қатты, қоймалжың және сұйық күйдегі қалдықтар: күкіртті натрий шламы, монохроматты шлам, «сары» натрий сульфаты, натрий биосульфаты, және тиосульфат ерітіндісінің түзілетінін көруге болады. Өндірістік процесс нәтижесінде ұйымдастырылған (мұржа) ластаушы көздерден және ұйымдастырылмаған ластаушы көздерден (шлам жинақтау тоғандары) шығарылатын зиянды заттектер қоршаған ортаның экожүйесіне айтарлықтай залалын тигізеді. Соңғы уақытта өндіріске аз қалдықты технологияны енгізу нәтижесінде «сары» натрий сульфатын қайта өңдеп «ақ» натрий сульфатына айналдыру жұмыстары жүргізіліп жатыр. Сонымен қатар өндіріске аз қалдықты технологияны енгізу нәтижесінде екі қалдық түрін: натрий биосульфаты және тиосульфат ерітіндісін қолданып құрғақ хром илегіштерін өндіру ұйымдастырылды.
2. 1 «АХҚЗ» АҚ өндірістік процесі нәтижесінде түзілген техногендік қалдықтардың қоршаған ортаға тигізетін әсері
Атмосфераға тигізетін әсері. Хром ауыр металдар қатарына жатады. Хром табиғи ортада тау жыныстарынан және топырақ арқылы суға таралып біршама бөлігі қайтадан топыраққа өтеді, бірақ біршама бөлігі су ағындарымен ағып теңіз суларына түседі. Химиялық кәсіпорындардың іс-әрекеті салдарынан ауыр металдар аэрозольдар құрамымен бірге атмосфераға таралады. Зерттеу үшін алынған атмосфералық аэрозольдар сынамасының талдау нәтижелері бойынша ауыр метал атомдары әртүрлі өлшемді бөлшек түрінде таралады. Хром, никель, қорғасын, титан және кадмий аэрозольды бөлшектердің субмикронды (<1мкм) құрамына кіреді, сондықтанда қазіргі кезеңде тәжірибе жүзінде халық тығыз орналасқан аймақтың ауасында осы ауыр металл қосылыстарының мөлшері фондық мөлшерден біршама артық мөлшерде кездеседі. Ауыр металлдардың ауада таралуы кезінде біртіндеп суда еритін күйге айналып, әртүрлі айналымдық күйге ұшырайды. Ауыр металлдардың атмосферада сейілуі нәтижесінде топырақ және өзен-көлдер ауыр металл қосылыстарымен ластанады. Хром және т. б. ауыр металл қосылыстарынан басқа келесі ластағыш заттектер азот диоксиді, күкірт сутегі, неорганикалық шаң (SiO2<20 % құрамды), көміртегі оксиді, күкірт ангидриді және олардың суммациялық топтары мысалы: азот диоксиді+күкірт ангидриді өнеркәсіптік аймақтың жерге жақын орналасқан атмосфералық қабатының ластануына өз әсерін тигізеді. Бұлардың бәрі ұйымдастырылған шығарынды көздерге жатады (мұржа) .
Шлам жинақтағышқа жіберілетін хром қосылыстары өндірісінің қалдықтары атмосфераның ластануына айтарлықтай өз үлестерін қосады. Қалдықтардың шаңдануы сол аймақтың жел режиміне, ауаның ылғалдығына, шламды орналастыру технологиясына, минералдық құрамына, ірілігіне, ылғалдылығына және т. б. факторларға байланысты. Сондай-ақ шылам жинақтағыштардың бөгеттері бұзылған жағдайда шлам жанжаққа жайылып, жаз айларында жылы температураның әсерінен кеуіп шаңдануы мүмкін.
Кесте -2. 1 «АХҚЗ» АҚ атмосфераға шығарған зиянды заттарының көлемі мың. тн.
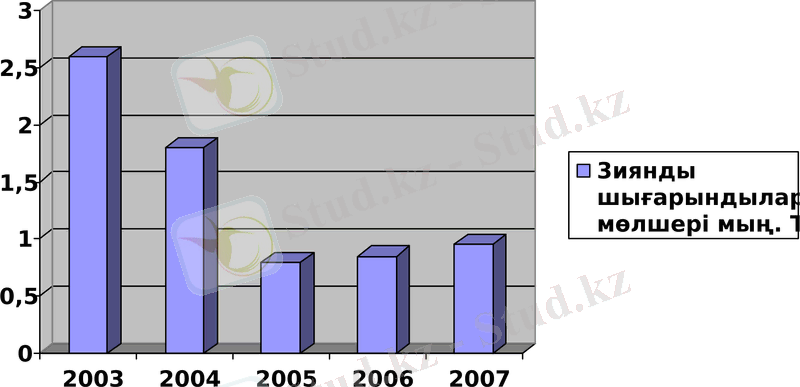 1-сурет «АХҚЗ» АҚ атмосфераға шығарған зиянды заттарының көлемі мың. тн.
1-сурет «АХҚЗ» АҚ атмосфераға шығарған зиянды заттарының көлемі мың. тн.
Гидросфераға әсері. Ауыр металлдар тасыған өзен сулары және жаңбыр сулары химиялық және микробиологиялық шаймалану процесі нәтижесінде топырақтан су экожүйелеріне түседі. Судың химиялық құрамының өзгеруіне қазіргі кезеңдегі атмосфераның жағдайы әсер етеді, оның басты көрсеткішіне «қышқылдық жаңбырдың» жер бетіне жаууы жатады. Тотығу-тотықсыздану потенциялының өзгеруінен жаңбыр сулары топырақ арқылы өтіп жылжығанда жекелеген элементтер марганец, мыс, қорғасын, хром, цинк және т. б. ерітетін қасиетке ие болады.
Атмосфералық ауаның ластануы салдарынан «су-топырақ» жүйесінің физико-химиялық тепе-теңдігінің бұзылуы өзімен бірге жер асты суларының химиялық элементтер концентрациясының айтарлықтай өзгеруіне әкеліп соқтырады. Табиғи суларда ауыр металлдардың атомдары әртүрлі иондық және молекулалық түрде кездеседі. Осындай темір, хром, марганец сияқты элементтер әртүрлі валентті болуы мүмкін. Судағы еріген органикалық фульвоқышқылы, аминқышқылы және гуминді қосылыстар ауыр металлдар атомдарының ығысуына маңызды ықпал жасайды. Ауыр металлдардың иондық формалары ең үлкен биологиялық қол жетімділікке және реакционды қабілеттілікке ие. Сондай-ақ еріген органикалық колойдты заттегімен байланысқан еріген металл формасын бөліп көрсетуге болады. Ауыр металл иондары еріген органикалық заттегілерімен, сонымен қатар тірі организмдер заттегілерімен берік компонентті қосылыстар түзіп байланысады. Осыдан беттік сулардағы ауыр металлдардың иондық формасының концентрациясының аз екенін және өндірістік суларды осы иондардан тазартуда түрлі ботаникалық алаң және биоинженерлік ғимараттарды қолдануға болатындығын көрсетеді.
Желдің әсерінен қалдық жинақтағыш тереториядан қалдықтардың ұсақ дисперсті құрамымен бірге зиянды заттектердің бөлінуінен гидросфера ластанады.
Табиғат қорғау іс-шаралары жүргізілмеген жағдайда хром өндірісінің қалдық жинақтағыш тоғандарының қоршаған ортаға тигізетін әсері келесі түрде болуы мүмкін:
- Шлам жинақтағыштан түссіздендірілмеген өндірістік ағындардың апаттық жағдайда айналаға төгілуі;
- Жинақтағыш плотина қапталы арқылы ұйымдаспаған фильтрация нәтижесінде жергілікті аймаққа инфильтраттың төгілуі;
- Жинақтағыш тоған түбі арқылы өндірістік сулардың сүзілуі салдарынан жер асты суларының ластануы;
- Айналымды сумен жабдықтау және шлам тасымалдайтын гидротранспорт жүйесінен өнеркәсіп ағындарының өндірістік және апаттық жағдайда айналаға төгілуі.
Бұдан көргеніміздей шлам жинақтағыш тоғандардың сүзілуін болдырмау мақсатында шлам жинақтағыш құрылысы жеткілікті түрде тиімді шараларды сақтау негізінде салынуы қажет. Сондай-ақ жіберілген қателіктердің дер кезінде алдын алу қажет. «АХҚЗ» АҚ гидросфера тигізетін зиянды әсеріне дәлел ретінде Орал өзенінің саласы трансшекаралық Елек өзенінің алтывалентті хроммен ластануын атап көрсетуге болады. 2007 жылдан бастап Бестамақ с. Бордың мөлшері нормадан 40, 0 есе асты. Елек өзенінің суының сапасы 6-шы сыныпқа яғни өте ластанған суға жатады. Георгиевка с. алтывалентті хром 7, 65 ШРК құрады. Судың сапасы 4 класқа жатады. Бестамақ селосындағы Елек өзенінің су сапасы 7 класқа жатады яғни төтенше ластану дәрежесіне жатады. 2. 2 суретте Елек өзенінің алтывалентті хроммен ластануы көрсетілген.
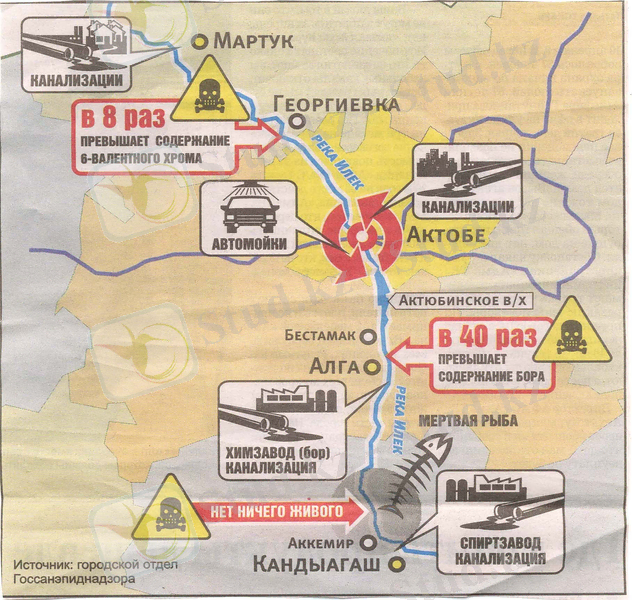
Сурет-2. 2 Елек өзенінің алтывалентті хроммен ластануы.
Литосфераға тигізетін әсері. Жоғарыда айтылғандай ауыр металл қосылыстарының ұйымдастырылған көздердің шығарындыларынан, сонымен қатар шлам жинақтағыштардағы орын алатын апаттық жағдайларда және атмосферадан ауыр металл қосылыстарының сейілуі нәтижесінде топырақ зиянды заттармен ластанады. Топырақ бетіне ластағыш заттардың таралуы ластаушы көздердің, сол аймақтың метероологиялық ерекшелігіне, биохимиялық факторларға және тұтастай алғанда ландшафтық ерекшеліктерге байланысты. Шығарынды зат бөлшектерінің атмосферада болу уақыты олардың массасына және физико-химиялық қасиеттеріне байланысты. Химиялық элементтер және олардың қосылыстары топыраққа түсіп бірнеше айналымға өтеді. Қатты қалдықтардың улы компоненттері атмосфералық жауын-шашын әсерінен шаймалануы (выщелачивание) нәтижесінде топыраққа түсіп, одан беттік және жер асты суларына өтеді. Топырақпен байланысуы және жекелеген компоненттердің адсорбциясы нәтижесінде зиянды заттектердің бастапқы құрамы, сондай-ақ қоспалардың улылық қасиеттері өзгеріске ұшырайды. Ережеге сай топырақтың беткі қабатына түсетін ерітінділермен салыстырғанда зиянды заттектердің концентрациясы топырақ суында аз болады. Ауыр металлдардың суда еритін және ең қозғалғыш формалары грунттық және беттік суларға өтуге бейім келеді. Ауыр металл қоспалары сумен және әлсіз (O, I, N) қышқыл ерітінділерімен әсерлеседі. Кадмий элементімен салыстырғанда хромның көшіп-қону бейімділігі аздау.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz