Жарылыстың физикалық қасиеттері және Н.Н. Семеновтың жылулық жарылыс теориясы


Әл-Фараби атындағы Қазақ Ұлттық Университеті
Химия және химиялық технология факультеті
Реферат
Тақырыбы: Жарылыстың физикалық қасиеттері
Орындаған: Мамбетова М.
БЖ-301 тобы
Қабылдаған: Діністанова Б.
Алматы 2012 жыл
Жоспары:
І. Кіріспе бөлім
ІІ. Негізгі бөлім а) Жарылыстың химиялық қасиеттері
ә) Жарылыстың физикалық қасиеттері
б) Н. Н. Семеновтың жылулық жарылыс теориясы
ІІІ. Қорытынды
Жарылыс - бұл қысқа уақыт аралығында шектеулі көлемде энергияның үлкен санының босауы. Жарылыс қатты ортада төңірегін бұзып, ұсақтайды, ауа мен судың жойқын әсердегі ауалық немесе гидравликалық соққы толқындарын құрайды.

Химиялық реакциялар уақыт бойынша баяу дамитын және жарылыс түзіп, от алу, дыбыстық эффект арқылы өтетін түрлерге бөлінеді. Қарапайым химиялық реакция жүзеге асқанда уақыт өткен сайын бастапқы заттардың концентрациясы мен реакция жылдамдығы азаяды (12-сурет) . Температураны жоғарылатқанда реакция жылдамдығы да біртіндеп жоғарылайды, әрбір 10° сайын реакция жылдамдығы 2-4 есе өседі (Вант-Гофф ережесі) . Жоғарғы температурада реакция жылдамдығы бірқалыпты және жатық өседі. Осындай заңдылықтар иод пен сутегі арасындағы реакцияға сәйкес келеді.
Мысалы, сутегі мен оттегінің қоспасы бөлме температурасында және атмосфералық қысымда көп жылдар бойы әрекеттеспей тұра береді. Температура жоғарылаған кезде реакция жылдамдығы бір шектік мәнге дейін өлшеусіз аз болады. Шектік мән тәжірибені жүргізуге байланысты. Мысалы 2Н 2 + О 2 стехиометриялық қоспасы үшін атмосфералық қысымдағы шектік температура - 550 °С. Т ш мәнінен аз ғана жоғары температурада реакция өте жылдам жүреді (4-cурет), қысым тез жоғарылайды да, реакциялық ыдыс жарылуы мүмкін. Жылдамдық өте үлкен болғандықтан өткен ғасырлардың зерттеушілері оның кинетикасын толық зерттей алмаған.
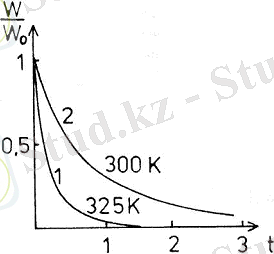
12 - сурет. Жарылыстық емес реакциялардың типтік кинетикалық қисықтары
Кейбір химиялық реакциялар жарқылдап, дыбыстық әсерлермен өтеді. Мұндай жарылыстық реакциялардың ерекшеліктерін ХІХ ғасырдың ортасында Бунзен мен Вант-Гофф байқаған болатын. Температураға байланысты реакция жылдамдығы өте күрт өседі.

Жарылыстық реакцияның негізгі белгісі - химиялық реакцияның жылдамдығы секірмелі түрінде өсетін температураның болуы, бұл - тұтану температурасы деп аталады. Берілген температурада қысымды өзгерту арқылы да реакция жылдамдығының күрт өзгеруін байқауға болады.
Жарылыстық реакцияны бақылағанда шектік шамадан төмен температура мен қысым мәндерінде қоспада ештеңе жоқ немесе ешнәрсе болмайтындай болып көрінеді. Ал шектік параметрлерге жеткенде барлығы бірден кенет әрекеттеседі. Процестің осындай ерекшелігі реакцияны жарылыстық деп атауға негіз берді. Жарылыстық реакция жылдамдығының температураға тәуелділігі 13 - суретте көрсетілген.
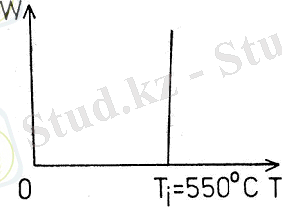
13 - сурет. Жарылыстық реакция жылдамдығының температураға тәуелділігі
14 - суретте изотермиялық жағдайдағы тізбекті жарылыстың болу мүмкіндігін тәжірибе жүзінде көрсеткен Ковальскийдің (1933 ж. ) нәтижелері келтірілген. ∆Р - жүйедегі жалпы қысымның азаюына тең шама. Суреттен көрініп тұрғандай, бастапқы қысымның төменгі мәндерінде жүйедегі жалпы қысым азаю үшін, яғни реакция жылдамдығы жоғарылау үшін белгілі бір уақыт керек. Бұл реакция өте баяу жүретін, эксперимент жүзінде реакцияның жүруі анықталмайтын уақыт аралығы индукция периоды деп аталады. Бұл шама автокатализдік және тізбекті реакцияларға тән.
Т 0 = 485 °С. Бастапқы қысым Р 0 : 1 - қисық - 8, 2 мм сын. бағ., индукция периоды 0, 2 с; 8 - қисық - 5, 8 мм сын. бағ., индукция периоды 0, 05 с.
Сонымен, жарылыстық реакцияларға тән екі ерекшелік - индукция периоды τ инд және шектік шарттардың (температура, қысым) болуы.
Жарылыстық реакциялардың ерекшеліктерін тудыратын физикалық себептерді қарастырайық. Көп жағдайларда реакцияның жарылыс арқылы жүруі тізбекті сипатпен, реакция жылдамдығының әрекеттесу кезінде пайда болатын активті орталықтар концентрациясына тәуелділігімен түсіндіріледі.
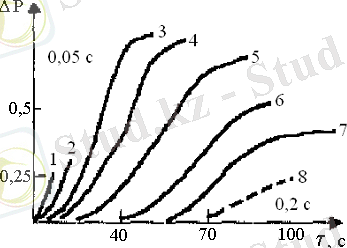
14 - сурет. Стехиометриялық 2Н 2 + О 2 қоспасының кинетикалық қисықтары
Неліктен төмен температурада баяу әрекеттесетін қоспа жоғары температурада тұтанады? Бұл сұрақ Н. Н. Семеновтың жылулық жарылыс теориясында қарастырылады.
Қабырғаларының температурасы Т 0 жабық ыдыстағы экзотермиялық химиялық реакцияның өтуін қарастырайық. Бастапқы уақыт мезетінде газ температурасы да Т 0 - ге тең, сосын ол айнымалы Т - ға өзгереді. Реакция жылдамдығы температураға тәуелді. Ыдыста жылу бөліну жылдамдығы:
+ (19)
Мұндағы: - химиялық реакция жылдамдығы, - реакция жылуы, яғни бір молекуланың жылу эффектісі.
Реакциялық ыдыс қабырғасына жылу берілу жылдамдығы:
- α- 0 / V (20)
Мұндағы: α - жылу берілу коэффициенті, , - ыдыстың ауданы мен көлемі.
Процесс кинетикасы төмендегі теңдеумен өрнектеледі:
/ =1/ρC (q + - q - ) (21)
С - тұрақты көлемдегі жылу сыйымдылығы.
Реакцияның стационарлық режимде жүру жағдайы жылу бөліну мен жылу берілу бір-біріне теңескенде q + = q - аяқталады, бұл теңдік ыдыстағы температураның стационарлық шамасының мүмкін болатын шамасын анықтайды.
Жылу берілудің әр түрлі жағдайларындағы q + және q - мәндерінің температураға тәуелділігін қарастырайық (18 - сурет) .
Температура өскен сайын жылу бөліну жылдамдығы q + Аррениус заңына сәйкес реакция жылдамдығы сияқты өседі (1 - қисық), ал жылу берілу жылдамдығы q - сызықты түрде өседі.
Жылудың берілуі өте айтарлықтай болып, q - түзуі жылудың бөліну қисығын қиып өтсін деп қарастырайық (2 - қисық) .
Т қоспа = Т 0 (ыдыс қабырғасы) болғандықтан жылу әкетілмейді, реакцияда жылу бөлініп, қоспа температурасы өсе бастайды, осының негізінде газ бен ыдыс қабырғасының температураларының айырымы да өсе бастайды, бұл жылу берілу жылдамдығының өсуіне алып келеді.
Т = Т Ғ газдың қандай да бір температурасында Ғ нүктесінде q + пен q - теңесіп, газ ары қарай қыздырылмайды.
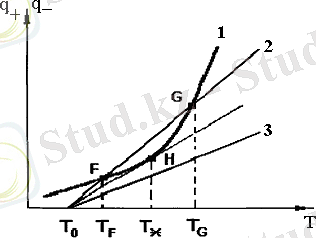
18 - сурет. Жылу бөліну (q + ) және жылу берілу жылдамдықтарының (q - ) температураға тәуелділігі
Егер газды T ж ≥ Т Ғ дейін қыздырса, температура Т Ғ -қа дейін төмендейді, бұл Ғ нүктесіне сай келетін стационарлық режимнің тұрақтылығын көрсетеді, яғни жылу берілу айтарлықтай және q + пен q - қиылысатын болса, газ Т 0 -ге жақын Т Ғ температураға дейін қызады да, осы температурада ұзақ уақыт әрекеттесетін болады.
Т = Т G тең болғанда 2-қиылысу нүктесіне G жетеді, ол тұрақсыз режимге сәйкес келеді. Шынында да, егер Т мәні Т G мәнінен төмен болса, онда q - > q + және Т > Т ғ . Егер газды Т G мәнінен жоғары мәнге қыздырса, онда q + өсе түседі. Бұл экспоненциалды жарылысқа алып келеді. Осылайша G нүктесі айырық нүктесінің ролін атқарады.
Енді жүйені Т 0 температурада жылу берілу нашарлады (мысалы S/V қатынасының азаюынан) деп қарастырайық. Жылу бөліну қисығы өзгермейді, бірақ q - түзуінің бұрыштық коэффициенті азаяды (3 - қисық) . 1 - қисық барлық температура мәнінде осы 3 - қисықтан жоғары жататын болады. Бұл жағдайда әрекеттесуші қоспа температурасы мен реакция жылдамдығы шексіз жоғарылайды. Осы кезде өздігінен тұтану болады. Экзотермиялық реакцияның стационарлық режимі болмайды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz