Мырыштың күкірт қышқылындағы еру кинетикасы және электротерістілігі жоғары металдардың әсері


ҚАЗАҚСТАН РЕСПУБЛИКАСЫ ҒЫЛЫМ ЖӘНЕ БІЛІМ МИНИСТРЛІГІ РЕСПУБЛИКАЛЫҚ МЕМЛЕКЕТТІК ҚАЗЫНАЛЫҚ КӘСІПОРНЫ
ЖАРАТЫЛЫСТАНУ ҒЫЛЫМДАРЫ ЖӘНЕ ЭКОЛОГИЯ ФАКУЛЬТЕТІ
Бейорганикалық және
аналитикалық химия кафедрасы
БІТІРУ ЖҰМЫСЫ
Тақырыбы: Мырыштың күкірт қышқылында еру кинетикасына, кейбір электротерістілігі жоғары металдардың әсері.
МАЗМҰНЫ
КІРІСПЕ . . . 3
ТЕОРИЯЛЫҚ БӨЛІМ
1 МЕТАЛДАРДЫҢ ЕРУІНІҢ ЭЛЕКТРОХИМИЯЛЫҚ КИНЕТИКАСЫ . . . 6
1. 1 Түйіскен электрохимиялық реакциялар . . . 6
1. 1. 2 Мырыш концентраттарын күйдіру . . . 9
1. 1. 3 Мырыш сульфатының ерітіндісін басқа қоспалардан тазарту . . . 11
1. 2 Қоспасы бар металл ерітіндісінің кинетикасы . . . 12
1. 2. 1 Электролиз үрдісінің теориялық негізі.
Катодтық үрдіс. Анодтық үрдіс . . . 15
1. 2. 2 Электролиз үрдісін анықтайтын факторлар.
Анодтар. Катодтар . . . 17
1. 3 Сутегілік деполяризациялы металдардың еруі. Сутегі бөлінуінің асқын кернеулілігі . . . 18
2 ТӘЖІРИБЕЛІК БӨЛІМ
2. 1 Тәжірибенің әдістемесі . . . 24
2. 2 Мырыштың еру үрдісіне температурамен күкірт қышқылының концентрациясының әсерін анықтау . . . 26
2. 3 Қышқыл ерітіндісіндегі қоспалардың мырыштың
еру кинетикасына әсері . . . 29
ҚОРЫТЫНДЫ . . . 38
ҚОЛДАНЫЛҒАН ӘДЕБИЕТТЕР . . . 39
ҚОСЫМШАЛАР . . . 42
КІРІСПЕ
Мырыш - Д. И. Менделеевтің периодтық системасындағы екінші топ элементі, реттік номері 30 және атомдық массасы 65, 38. Мырыш - латын тілінен аударғанда «ақ» деген мағынаны береді. Металды мырыш көкшіл-ақ түсті болады. Оның балқу температурасы 419, 5 0 С, қайнау температурасы 905, 4 0 С. Мырыш гексоганальді жүйеде кристалданады. Құйылған металдың тығыздығы 7, 13 г/см 3 , ал балқыған металл тығыздығы 6, 92 г/см 3 болады.
Мырыштың пластикалық қасиеті температураға байланысты өзгереді. Мырыш бөлме температурасында омырылғыш, ал 100-150 0 С-да созылмалы және жеңіл беттерге жайылады. (0, 05 мм дейін) 250 0 С температурада ол қайта механикалық өңдеуге жарамсыз болады.
Мырыштың көп мөлшері (40%) - құбырларды, сымдарды және де басқа металл өнімдерін мырыштауға шығындалады. Өйткені мырыш темірді коррозиядан жақсы сақтайды.
Мырыш - латунь және бронзы балқымаларын алу үшін қолданады. Тағы құрылыс материалдар ретінде, құрғақ батарей дайындау үшін пайдалынады. Мырыштың химиялық қосылыстары резина, пластмасс, бояу, қағаз т. б өндірістерде қолданады. [1]
Табиғаттағы мырыш
Табиғатта 60-қа жуық мырыштың минералдары белгілі. Ең көп таралғаны мырыштың күкіртті және оттекті қосылыстары. Олардың ішіндегі өнеркәсіпке қажетті минералдары: сфалерит немесе мырыш алдамшысы (ZnS), марматит (mZnS*nFeS), смитсонит (ZnCO 3 ), және (Н 2 Zn 2 SiO 5 ) .
Мырышты минералды кендерде кадмий, индий, талий, галлий, күшән, қалайы, селен, сынап, висмут, кобальт, германи, алтын, күміс және тағы басқа элементтер болады. Бұл кендерде мырыш өте аз 0, 5-15%-дейін жетеді.
Барлық сульфитті мырышты кендерді флотациялық байытуға ұшыратады, кеннің құрамына байланысты мырышты, қорғасынды, мысты концентраттар алынады.
Бұл концентраттар 40% мырыш сонымен қатар 1, 5% қорғасын сульфиді және оксиді, 9, 5% темір, 1, 03% мыс, 0, 23% кадмий, 31, 3% күкірт, 0, 42% күшән.
Гидраметаллургиялық әдіспен мырышты алу.
Пирометаллургиялық әдіске қарағанда гидрометаллургиялық әдіс көп қолданыста. Мырыш гидрометаллургиялық өндірудің мәні, күйдірілген мырыштың концентраттарын әлсіз күкірт қышқылымен ерітіп, мырышты ерітіндіге сульфат ретінде ауыстыру. Мырыш ерітіндісі құрамындағы басқа қоспалардан арылады, металдың электрлі тұнуы арқылы индукциялық пеште катодты мырышты балқытады.
Мырышты гидрометаллургиялық технологиялық әдіспен алу үшін мынадай саты арқылы жүзеге асады:
1. Шикізатты металлургиялық өндіруге дайындау.
2. Мырыш концентратын күйдіру.
3. Күйдірілген заттарды және басқа да материалдарды ерітуге дайындау.
4. Құрамында мырышы бар материалдарды еріту.
5. Мырыш ерітінділерін басқа қоспалардан тазарту.
6. Мырышты электрлік тұндыру.
7. Катодты мырышты балқыту.
Электролит ерітінділерінде металдың өздігінен еру үрдісі зерттеушілердің назарын ертеден аударған. Ол металдардың электрохимиялық коррозиясының негіздерінің бірі болып саналады және гидрометаллургияда көптеген үрдістерді қоса алып жүреді. Жеке алып қарағанда, мырыштың гидрометаллургиялық өндірісінде металдың еру үрдісі мырыш ұнтағының көмегімен мырыш сульфатының қоспалардан ерітіндінің цементациялық арылу тереңдігін анықтайды, сондай-ақ мырыштың электролиз үрдісінің техника-экономикалық көрсеткіштерін анықтайды. Берілген үрдіс никель гидрометаллургиясында және басқа да металдарға ұқсас әсер етеді, сондай-ақ металдарды қышқылдарда ерітіп, тұз алуда әсер етеді.
Қолданбалы және халық шаруашылығындағы мәнділігімен қоса металдардың еру үрдісі теориялық қызығушылық тудыруда. Осыдан біраз уақыт бұрын осы үрдістердің сипатын кейбір сусыз ерітінділердегі металдардың өзара әсерлесуі болатындығына орай химиялық жағынан қарастырған су ерітінділерінде қышқыл реакциясы электрохимия механизмі бойынша жүреді. [2] : металл ерітіндіге ион (тотығады) түрінде өтеді, ал қалған металда бос электрондар орнына тотықсыздану үрдісі қатысады. Мұнда ерудің барлық үрдісі бір уақытта біріңғай жылдамдықпен өтетін бірнеше параллель (түйіскен) сатыдан тұрады. Металдың иандалуының анодты үрдісінің табиғаты өзгеріссіз, реакциясының табиғатын, ерітінді құрамын өзгертуге болады. Сонымен қатар бір сатыдағы үрдіс жылдамдығының төмендеуі екіншісін де тежейді, яғни металл еруінің барлық үрдісінің жылдамдығына әсер етеді.
Берілген жұмыстың мақсаты металдық мырыштың күкірт қышқылының сулы ерітіндісінде еру кинетикасынның температураға, ерітінді құрамына байланысын, ерітіндіде мырышқа қарағанда электротерістілігі жоғары кейбір металдардың қоспаларының әсерін анықтау.
ТЕОРИЯЛЫҚ БӨЛІМ
1 МЕТАЛДАРДЫҢ ЕРУІНІҢ ЭЛЕКТРОХИМИЯЛЫҚ КИНЕТИКАСЫ
1. 1 Түйіскен электрохимиялық реакциялар
Металдың электрохимиялақ ерігіштігінің теориясының негізгі сұрағы металл бетінің электролит ерітіндісімен байланысында жүретін анодты және катодты үрдістердің өзара байланысына қатысады.
Электролит ерітінділерде металдың еруінің жүйелік ілімін 1880 ж. Н. Каяндер орындаған. [2] Осы зерттеу негізінде үрдістердің хлектрохимиялық сипаты жайлы қорытынды жасалған.
Одан бұрынырақ 1830 ж. Де-ля-Рив [7] металл еруі үрдісінің қоспа қосындысының бар болуына тәуелділігін, яғни локальды микроэлемент тудыратын металл бетімен бірге микроскопиялық өлшемді қысқа тұйықтайтын гальваний элементтерінің үлкен санын тудыратындығын анықтады.
Локальды элементтердің алғашқы сандық хаттауды Н. И. Слугинов берген, ол металдың еру жылдамдығын электр қозғаушы күшімен және локальды элементтердің кедергісімен байланыстырды [8] .
Локальды элемент теориясы соңынан кең дамыды. Әсіресе оған Г. В. Акимов және оның серіктестері үлкен үлес қосты.
Қысқа тұйықталатын микроэлементтердің бар болуы, яғни катодты және анодты реакцияларды кеңістіктік бөлу коррозиялық үрдістің электрохимияның табиғатына тән. Бірақ коррозияның классикалық теориясында таза әрі біртекті кеңістіктегі металдың толық химиялық тұрақтылығы жайлы қате қорытынды жиі жасалады. Шындығында металл бетінің біртектілігі онда өтетін анодты және катодты үрдістерге кедергі бола алмайды, сондықтан химиялық таза әрі біртекті металл электролит ерітіндісінде ери алады. Біртекті металл бетінен түйіскен электрохимиялық реакциялардың өтуі жайлы қорытындыны алғаш рет 1932 ж А. Н. Фрумкин берді, бұл қорытынды сілтілік металдардың амальгама орналастыру кинетикасын оқудан туды. [2]
Түйіскен электрохимиялық реакциялардың теориясының әрі қарай дамуы Вагнер мен Трауд [2] жұмыстарында көрініс тапты және металдардың еру кинетикасы жайлы Я. В Дурдиннің, А. И Шультиннің, Я. М Колотыркиннің және басқалардың жұмысында расталған.
Осы көрініске сүйенсек, егер беттің барлық химиялық және физикалық қасиеттері бірдей болса, онда ықтималдылыққа тең кез-келген нүктеден анодты және катодты үрдістер өте алады. Мұнда әрі катодты және анодты бөліктер шексіз болады. Беттің әртүрлі дәрежесіне байланысты катодты және анодты үрдістердің дифференциация дәрежесі де әртүрлі болуы мүмкін.
Қышқыл ерітіндісіндегі металдың электрод бетінде нақты жылдамдықпен келесі реакциялар жүреді:
Н + +е=½Н 2 і 1 реакциясының жылдамдығы (1. 1)
Ме=Ме n+ +ne і 2 - реакциясының жылдамдығы (1. 2)
Кері реакциялар жылдамдығы; сутегінің иондалуы және металдың тотықсыздануы көрсетілгеннен төмен өлшенетін жылдамдықты болғандықтан кешітуге болады. Көрсетілген реакциялардың электрод потенциялына және әсер ететін компаненттердің белсенділігіне тәуелділік жылдамдығын келесі теңдеу арқылы өрнектеуге болады:
і 1 =k 1 ·a н ·exp[-α 1 ·F·φ к /RT] (1. 1)
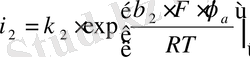 (1. 2)
(1. 2)
мұндағы
k 1 және k 2 сәйкес реакциялардың жылдамдық константасы
R - уневерсал газ тұрақтысы
α 1 және β 2 ионның электр энергиясының өзгеруіне байланысты осы реакциялардың белсенділігін және сәйкес энергия өзгерісін байланыстыратын коэффициенттер
F- фарадей саны
φ к және φ а - осы реакциялардың электрод потенциалы
Сутегінің бөлінуі мен металдың еру үрдісі эквивалентті санмен жүріп жатқандықтан, екі үрдіс жылдамдығы і 1 және і 2 тең:
і 1 =і 2 =і с (1. 3)
мұнда і с - металдың өздігінен еру жылдамдығы келтірілген теңдеу стационарлық шартын өрнектейді, яғни бір реакция жүрісінен босайтын электрон саны екінші реакцияға түсетін электрон санына тең, әрі электрод бетінде электр зарядының жиналып қалуын байқамайды.
Қышқыл ерітіндісіндегі металдың электродта сутегі электроды мен теңескен металл потенциялынан өзгеше потенциялдың стационарлық мәні (φ с ) белгіленген. Стационарлық потенциал шамасын біле отырып, металдың өздігінен еру жылдамдығын табуға болады: ( і с )
i
c
= ķ
1
* а
1
*ехр
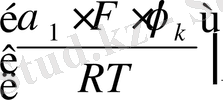
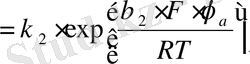 (1. 4)
(1. 4)
Стационарлық потенциал мен металдың өздігінен еру жылдамдығының шамасы графикалық жолмен табылуы мүмкін. Осы жағдайда графикте жартылайлогорифмдік масштабта сутегінің сондай-ақ металдың қатысуымен реакция жылдамдығының тәуелділігін бейнелеуге болады. Сыртқы ток жоқ болғанда осы екі жылдамдық тең, яғни і 1 және і 2 қисық шамасы нүктесіне сәйкес келетін стационарлық потенциял мәнін электрод қабылдайды. Өздігінен еру жылдамдығы осы нүктенің абциссасымен анықталады. (сурет 1)
Өздігінен еру жылдамдығы тура аналитикалық жолмен шешілуі мүмкін, φ с қатысты теңдеуді шеше отарып (1. 4)
φ
c
=A+
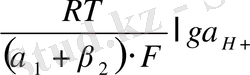 (1. 5)
(1. 5)
мұндағы A=
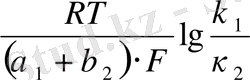
мәнді φ с теңдеуіне қоя отырып (1. 1) немесе (1. 2) теңдеуден өздігінен еру жылдамдығы шамасының ара қатынасын аламыз.
i
c
=
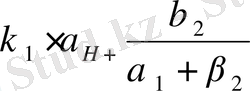 (1. 6)
(1. 6)
(1. 5) теңдеуден металл үшін стационарлық үрдістің иондану жылдамдығы теңдік потенциалында сутегі ионының разряды жылдамдығымен салыстырғанда үлкен еместігі сутегі ионының белсенділігінің өзгерісі сутегі электродының потенциялымен бірдей екендігін көру. (1. 6) байқаймыз, сутегі (коцентрациясы) ионының белсенділігі артқанда, металдың өздігінен еру жылдамдығы да артатынын көру. Осы теңдеудің шындығы болаттың еруінің күкірт қышқылының орташа белсенділігіне тәуелділігін анықтау тәжірибесінде ұйғарылған. [2]
Жоғарыда аталған заңдылықтар, қышқылда темір мен қорғасынның ерігіштігін анықтауда бақыланған. [2]
Осы зерттеулер нәтижесінде, еріту кинетикасы мен стационарлық потенциал шамасы металдың және сутегі электродында токпен айырбастау шамасына үлкен әсер ететіндігі бекітілген.
1. 1. 2 Мырыш концентраттарын күйдіру.
Мырыш өндірудің ең алғаш металлургиялық операциясы мырыш концентраттарын күйдіру. Концентратты күйдірудің мақсаты - мырыш сульфидін сұйытылған күкірт қышқыл қосылысқа аудару және күкірт қышқыл газдарын алу үшін концентратты күйдірудің мынадай мақсаттары бар:
1) Металл сульфльфатының максималды мөлшерін тотыққа айналдыру.
2) Күйдірілген затта аз мөлшерде сульфид 3-4%-тін, өндіріс үрдісінде күкірт қышқылын жоғалту үшін қолдану.
3) Күкірт қышқылында ерімейтін мырыш ферритін аз мөлшерде алу.
4) Мырыш және қорғасын силикаттарының түзілуін көп мөлшерде болдыртпау. Олар ерітіндіні тұндыруға және фильтрлеуге қиындық туғызады.
5) Күйдірілген затты ұнтақ ретінде және үлкен реакциялық бетімен алу.
Гидрометаллургияда мырыш концентраттары тотығып - сульфаттанған болып табылады. Мырыш сульфиді оттегімен әрекеттескенде мынадай реакция теңдеулері жүреді:
ZnS+1, 5O 2 = ZnO+SO 2 +230025Дж
Бұл реакция 900-1000 0 С температурада жүреді. Ал қалған мырыш сульфиді мынадай реакция бойынша жүреді:
ZnS+2O 2 = ZnSO 4
Мырыш сульфатының түзілуін басқа да реакция теңдеулерімен келтіруге болады:
2SO 2 + O 2 = 2SO 3
ZnO+ SO 3 = ZnSO 4
Күйдірілген затты еріту.
Мырышты гидрометаллургиялық өндіруде еріту үрдісі басты рөлді атқарады. Осыдан технико-экономикалық көрсеткіштер тәуелді болып отыр.
Ерітуге ең алдымен күйдірілген заттың құрамы мырыш оксидінен (ZnO), мырыш сульфатынан (ZnSO 4 ), силикаттардан (2ZnO*SiO 2 ) және ферриттерден (ZnO*Fe 2 O 3 ) құралған. Сонымен қатар, күйдірілген заттың құрамында мынадай қосылыстар кездеседі: мыс, қорғасын, кобальт, күшән, никель, кадмий т. б.
Еріту үрдісінің мақсаты: күйдірілген заттың құрамындағы мырышты және бағалы компоненттерді ерітіндіге айналдыру. Ол үшін электролит қолданады, Н 2 SO 4 120-160г/л және Zn 30-50г/л болады.
Еріту үрдісі - дегеніміз қатты материалдың бірнеше құрамды бөліктерін еріту. Басында күйдірілген затты нейтралдап ерітеді, ал қою пульпаны - қышқылдап ерітеді. Электролиз цехынан орындалған электролит - қышқылдап ерітуге келіп түседі. Мұнда қышқыл ерітінді түзіледі, ол Н 2 SO 4 2-3г/л және Zn 80-120г/л және мырыш кегі болады. Қышқыл ерітінді нейтралды ерітуге дейін жетеді, жаңа күйдірілген затқа дейін нейтралданады. РН=5, 2-5, 4
Еру үрдісінің басты көрсеткіші болып, мырышты күйдірілген заттан ерітіндіге аудару, 80-86% құрайды.
Мырыш оксиді күкірт қышқылында мынадай реакция теңдеуі бойынша жүреді:
ZnS+H 2 SO 4 =ZnSO 4 +H 2 O
Ал мырыш сульфиді концентрлі күкірт қышқылымен әрекеттеседі:
ZnS+H 2 SO 4 =ZnSO 4 +H 2 S
1. 1. 3 Мырыш сульфатының ерітіндісін басқа қоспалардан тазарту.
Техникалық прогреске байланысты гидрометаллургиялық әдіспен мырышты алудағы, ерітіндіні басқа қоспалардан тазартудың бірнеше әдісі белгілі.
Ең алдымен электролиттің тазалығы басты рөлді атқарады, ол мырыштың электролизінің жақсы нәтижесіне әкеледі.
Мыс, қорғасын, кадмий қоспалары катодты металды ластайды, мырышпен бірге тұнады. Темір, кобальт, никель, күшән және германий токтың төмендеуіне әкеп соғады, катодтық мырыш структурасын нашарлатады. Ал хлор мен фтор алюминий катодын бұзады және мырыш тұнбасын алюминий катодымен жалғасуын көбейтеді.
Қоспалардан тазарту әдісіне байланысты 4 топқа бөлінеді:
І - темір, алюминий, күшән, сурьма, индий, галий, кремнизен.
ІІ - мыс, кадмий, кобальт, никель, талий.
ІІІ - хлор, фтор.
ІV - калий, натрий, магний, марганец.
Ерітіндіні І топ қоспаларынан тазарту үшін гидролитикалық әдіс қолданамыз. Металл сульфаттары және гидроксидтерін тұндыру арқылы жүреді. Тұздардың гидролиз реакциясы РН жоғары болу керек.
Fe 2 (SO 4 ) 3 +6 H 2 O=2Fe(OH) 3 +3H 2 SO 4
Fe 2 (SO 4 ) 3 +2H 2 O=2Fe(OH) SO 4 +H 2 SO 4
Темір ерітіндіде ІІ валентті болып келеді. Темір гидроксиді Fe(OH) 2 РН > 6, 5 болғанда тұнбаға түсе бастайды.
Темірді тұнбаға түсіру үшін, оны ІІІ валенттілікке ауыстыру керек. Ол үшін калий перманганатын немесе ауамен тотықтырамыз. Темір гидроксиді Fe(OH) 3 бұл жағдайда РН=2-5 аралығында болуы керек. Ал егерде РН жоғарылап кетсе кремний қышқылының когуляциясы немесе тұнбасы түзіліп кетеді.
Екінші топ қоспаларынан арылу үшін ерітіндіні мырыш шаңымен өңдейді. Мырыш шаңынан басқа ерітіндіге активирлейтін қоспалар қосады: Шлиппе тұзын - натридің ортосульфоантимонаты.
Хлордан арылу үшін бір валентті мыс қосады.
Cu + +Cu+2CI - → Cu 2 CI 2
Мұнда мыстың ионды түрі және металды түрі қажет. Сондықтан хлордан арылу үшін мырыш шаңымен өңдеудің алдында қолданады. Мысты ұсақ кек түрінде енгізеді.
1. 2 Қоспасы бар металл ерітіндісінің кинетикасы
Металды біртекті бетте ерітуде электрохимиялық реакция жылдамдығы барлық бөлікте бірдей (эквипотенциалды бет) . Осы жағдай сұйық металға, мысалы сынапты немесе амальгамалы электродқа лайық. Қатты металда осы лайықтылық белгілі жақындық ретінде ғана қызмет етуі мүмкін. Егер қатты металл бөліктері кристалл торларырының кемшілігіне байланысты физикалық біртекті болмайды. Жеке кристаллиттер осы нүктелерде электрохимиялық реакциалар кинетикасында көрініс табатын әртүрлі энергия және әртүрлі қасиетке ие болады.
Ерітудің нығайған көрінісінен әлі де ауытқуды металда біртексіз қоспалар бар екендігін анықтауда және оның бетінде әртүрлі химиялық және физикалық қасиетті бөліктер бар екендігін білгенде байқалады. Сондықтан жоғарыда келтірілгендер қандай жағдайда шынайы қатты металға қолданылуы мүмкін екендігін анықтау қажет.
Біртексіз қоспалардың физикалық және химиялық қасиеттерінің негізгі металл қасиеттерінен үлкен өзгешелігінің бар екендігі және осы қоспалар бөлігінде сутегінің бөлінуі төмендетілгені жайлы жағдайлар тіркелген.
Осы жағдайда қосындының электродты потенциялы негізгі металл потенциялына қарағанда оң электрлі болуы керек, себебі сутегі бөлінуіне арналған бөліктер жылдам өздік еруге ұшырауы мүмкін.
Бұрынырақта анықталғандай, қоспа және негізгі металл микрогальваний элементтерінің үлкен санын түзеді. Осы элементтердің ішкі кедергісі ерітіндінің электрөткізгіштігі және қоспаның өлшемі мен формасына қарай анықталады. Алғашқы кедергі ерітінді кедергісімен өлшенбейді.
Электрөткізгіштігі төмен ерітінділерде жергілікті электр токтары туындайды. Металда ток қоспаның оң бөлігінен беттің теріс бөлігіне қарай өтеді. Ерітіндіде ток бағыты керісінше. Негізгі металл бетінен токтың өтуінде металдың анодты қышқылдануы болады, ал қоспада сутегінің катодты бөліну реакциясы жүреді.
Қоспаның жұмысы келесі түрде түсіндіріледі. [3] Негізгі металда қоспаның болмауы стационарлық потенциалды тудырады әрі ион разрядының катодты үрдісі және иондалудың анодты үрдісі бірдей жылдамдықпен өткен болар еді. Ал қоспада сутегі ионы разряды жеңілдетілген, сондықтан негізгі металл потенциялының оң жаққа жылжуы байқалады. Осының есебінен негізгі металл еруінің үрдісі жылдамдайды, ал ондағы сутегі бөлінуінің катодты үрдісі баяулайды. Сутегі ионы разрядының жылдамдығы металл табиғатына тәуелді болғандықтан, сутегі бөлінуінің төмен кернеулі қоспасы қышқыл ерітіндісінде жоғары кернеулі металл ерітіндісінің жылдамдығын арттыруы мүмкін. Осындай әрекет темір мен мырыш және сурьма мен қорғасын қоспасында да байқалады. [2]
Беттің катодты және анодты бөліктері ток өткенде поляризацияланады. Локальді элементтердегі ток күші қосылады, егер олардың катодты және анодты бөліктерінің поляризацияның қисығы мен омдық өзара кедергісі белгілі болса.
Металл коррозиясы жайлы әдебиеттерде локальды элементтердің ток күшінің графикалық әдісі катодты және анодты бөліктердің поляризациялық қисығы көмегімен жиі қолданылады. [1. 2]
Осындай диаграмманың мысалы 2 суретте көрсетілген.
1 қисық металдың анодты, ал 2 қисық қоспаның катодты поляризациясына сәйкес келеді. Абсцисса өсіне көбіне ток тығыздығының логарифмін емес, ток күші логарифмін кейде жай ғана ток күшін орналастырады. Тәсілде поляризациялық қисықтың орналасуы металл мен ерітіндінің сипатына ғана емес, сондай-ақ сәйкес бөліктер шамасына да байланысты болады. 2 суреттегі абсцисса анодты және катодты ток күшінің жиынын өрнектейді.
Стационарлық жағдайда микроэлемент жұмысында негізгі металл анодты, ал қоспа катодты поляризацияланады, ал олардың арасындағы потенциалдар айырмасы бастапқыдан төмен болады, сақталынған потенциялдар айырмасы анодты және катодты бөліктерде ерітіндінің омдық потенциялының төмендеуіне сәйкес келеді. (2 сурет)
Коррозия тогының шамасын табу үшін, ток күші мәнін таңдаймыз, мұнда катодты және анодты бөліктер арасындағы потенциалдар айырмасы ІR омдық потенциялының төмендеуіне тең. Коррозия ток күшінің ең алғашқы жақындауы мына теңдеумен табылады:
I=
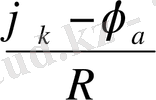 (1. 7)
(1. 7)
R шамасына ток күші әсер етеді, себебі оның өтуінде ерітінді концентрациясы өзгереді, соның салдарынан оның электрөткізгіштігі катодты кеңістіктік бөлудің гальваний элементіне де қолдануға келеді. Осы жағдайда катод пен анодтың түрлі нүктелерінің арасындағы электролит кедергісінің айырмашылығы жоқ. Осы жағдайда кедергі шамасының микроэлементі бір нүктеден екіншісіне өзгереді. Сондықтан микроэлемент жұмысы жайлы толық мағлұмат алғыңыз келсе металл бетінде токтың тығыздығы көрініс болуы керек. Мұндай есептеу, кейбір жеке жағдайларда, мысалы диск түріндегі қоспа үшін жүргізілуі мүмкін. [2]
Микроэлементтің қарастырылған қарапайым үлгісі шынайы жағдайда металл бетінің анодты және катодты бөліктері арасындағы өзара байланысты күрделенген. Сонымен техникалық маңызды қорытпалар, әртүрлі поляризацияның сипатты екі, үш немесе одан да көп бөлікті типтермен жиі жұмыс істейді. «Көп электродты» жүйенің поляризациялық сипат негізінде есептеу тәсіліне сипатты Г. В Акимов және оның серіктестері берген. [2]
Катодты және анодты үрдістерді кеңістікте бөлу дәрежесі анодты бөліктерден түйіскен реакциялардың жылдамдығына тәуелді, осы бөліктердің анодты поляризацияның шамасы көрші катодты бөліктің ықпалында болады. Жалпы жағдайда, анодты бөліктерде негізгі анодты үрдістермен қатар катодты реакциялардың да өтуі мүмкін, ал катодты реакцияларда төмен жылдамдықты анодты үрдістер жүреді. Металдың өздігінен еру жылдамдығын анықтайтын негізгі шарттар; негізгі металл және металл-қоспадағы сутегі бөлінуінің кернеулігінің шамасы, қышқыл ерітіндісінің сипаты, катодты және анодты бөліктердің өлшемдерінің ара қатынасы, электрохимиялық реакциялардың компонент диффузиясының жылдамдығы және басқа да факторлар.
1. 2. 1 Электролиз үрдісінің теориялық негізі
Электролиз - мырыштың гидрометаллургиялық өңдеудің ақырғы стадиясы болып табылады. Электролиз нәтижесінде алынған катодты мырыштың дайын мырыш металынан көп айырмашылығы жоқ.
Күйдірудің, ерітудің, басқа қоспалардан тазалаудың нәтижесі - электролиз үрдісінде сапалығы байқалады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz