Ішкі энергия: молекулалық-кинетикалық түсінік және идеал газдардың ішкі энергиясының өзгерісі


Қазақстан Республикасы Білім және ғылым министрлігі
Шәкәрім атындағы Семей мемлекеттік университеті
Инженер-техналогиялық факультет
СРО
Тақырыбы: Ішкі энергия
Орындаған: Румиев А. Т ТЭ-417
Тексерген : Шалаганова А. Н
Семей қаласы 2015 жыл
Жоспары: Ішкі энергия. Идеал газдың ішкі энергиясы. Газдардың ішкі энергиясының өзгеруі. Қортынды. Пайдаланған әдебиеттер. Iшкi энергия.Iшкi энергия туралы түсiнiк . Макроденелердің механикалық энергиямен қатар, өздерiнiң iштерiне тұйықталған энергияға ие. Ол - iшкi энергия. Ол барлық энергетикалық түрленулердiң балансына кiредi. Механикалық жұмыс жасамай-ақ денелердi қыздырғанда, олардың iшкi энергиясы ұлғаяды. Ішкі энергияның механикалық энергияға айналуының кері процесі болатыны сөзсiз. Молекулалық-кинетикалық теория көзқарасынан макроскопиялық дененiң iшкi энергиясы барлық молекулалардың ретсiз қозғалыстарының кинетикалық энергиялары мен олардың бiр - бiрiмен өзара әсерiнiң потенциалдық энергияларының қосындысынатең.
U = 3mRT/2M .
Бiр атомды идеал газдың iшкi энергиясы, молекулаларының өзара әсерлесуiнiң потенциалдық энергиясы нөлге тең болғандықтан, көлемге ( қысымға) байланысты емес. Тек газ температурасының өзгеруiнiң есебiнен ғана газдың энергиясы өзгередi . Нақты газдар және сұйықтар үшiн молекулалардың орташа потенциалдық энергиясы нөлден өзгеше. Газдарда ол кинетикалық энергиямен салыстырғанда өте аз, ал сұйықтар мен қатты денелер үшiн кинетикалық энергиямен шамалас болып келедi. Демек, жалпы жағдайда, iшкi энергия потенциалдық энергия сияқты қозғалмалы ортаның көлемiне, температурасына тәуелдi болады.
Ішкі энергия - дененің (жүйенің) тек ішкі күйіне байланысты энергия. Ішкі энергияға дененің барлық микробөлшектерінің (молекулалардың, атомдардың, иондардың, т. б. ) ретсіз (хаосты) қозғалыстарының энергиясы, микробөлшектердің өзара әсерлесу энергиясы, атомдар мен молекулалардың ішкі энергиясы, т. б. жатады. Ішкі энергия ұғымын 1851 жылы У. Томсон енгізген. Дененің бір күйден екінші күйге ауысу барысындағы Ішкі энергиясының өзгерісі (ΔU) мынаған тең: ΔU=ΔQ-A, мұндағы Q - жүйенің қоршаған ортамен алмасқан жылу мөлшері А - істелген жұмыс. Бұл теңдеу жылу алмасу процесі басты рөл атқаратын жүйелердегі энергияның сақталу және айналу заңын (термодинамиканың бірінші бастамасын) өрнектейді. Энергияның сақталу заңына сәйкес Ішкі энергия физикалық жүйе күйінің, яғни осы күйді анықтайтын тәуелсіз айнымалылардың (мысалы, температура, көлем не қысым), бір мәнді функциясы болады. Q және шамаларының әрқайсысы жүйені Ішкі энергиясы U1-ге тең күйден U2-ге тең күйге ауыстыратын процестің сипатына тәуелді болады, ал ΔU=U2-U1. Жүйе бастапқы күйіне қайтып келетін (U2-U1) кез келген тұйық процесс үшін Ішкі энергияның өзгерісі (ΔU) нөлге тең және Q=A (қ. Дөнгелек процесс) . Адиабаттық процесте (қоршаған ортамен жылу алмасу болмаған, яғни Q=0 жағдайда) жүйенің Ішкі энергияның өзгерісі жүйенің істеген жұмысына не жүйеге жасалған жұмысқа тең. Газдардың кинетикалық теориясы бойынша Молекула-кинетикалық теория тұрғысынан алғанда ішкі энергия денені құрайтын бөлшектердің өздік әсерлесуінің потенциалдық энергиясының және олардың бейберекет жылулық қозғалысының кинетикалық энергиясының қосындысынан тұрады.
Идеал газдардың iшiнде өзiнiң физикалық қасиеттерi бойынша қарапайым болып табылатын газ - бiр атомды газ (гелий, неон, аргон және т. б. ) . Егер молекулалардың әсерлесуінің потенциалдық энергиясы нөлге тең болса, идеал газдың ішкі энергиясы оның барлық молекулаларының жылулық қозғалысының кинетикалық энергиясының қосындысына тең:
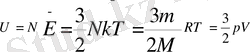 идеал газдар Ішкі энергиясының өзгеруі нәтижесінде, температураға байланысты молекулалардың кинетикалық энергиясы өзгереді. Сондықтан идеал газдың (немесе қасиеттері сол идеал газға жуық газдардың) Ішкі энергиясының өзгерісі тек оның температурасының өзгерісімен анықталады (Джоуль заңы) . Бөлшектері өзара әсерлесетін физикалық жүйелерде (реал газдарда, сұйықтықтарда, қатты денелерде) молекулааралық және молекула ішіндегі өзара әсер энергиялары да Ішкі энергияға жатады. Мұндай жүйелерде Ішкі энергия температурамен қатар қысым мен көлемге де тәуелді болады. Абс. нөлге жуық (-273, 16°С) төмен температуралар аймағында конденсацияланған жүйелер (сұйық және қатты дене) Ішкі энергиясының температураға тәуелділігі жойылып, ол белгілі бір тұрақты мәнге (U0) - “нөлдік энергия” дейтін мәнге ұмтылады (термодинамиканың үшінші бастамасы) . Ішкі энергия негізгі термодинамиқалық потенциалдардың бірі болып есептеледі. Көп атомды газдың ішкі энергиясы[өңдеу] Көп атомды газдың ішкі энергиясы дегеніміз - серпімдішариктер деп қарастыруға болатын молекулалардың ілгерілемелі қозғалыстың орташа кинетикалық энергиясы. Егер екі атомды газды алсақ, онда бізге атомдармен емес, молекулалармен жұмыс істеуге тура келеді, ал олар түрлене де алады.
идеал газдар Ішкі энергиясының өзгеруі нәтижесінде, температураға байланысты молекулалардың кинетикалық энергиясы өзгереді. Сондықтан идеал газдың (немесе қасиеттері сол идеал газға жуық газдардың) Ішкі энергиясының өзгерісі тек оның температурасының өзгерісімен анықталады (Джоуль заңы) . Бөлшектері өзара әсерлесетін физикалық жүйелерде (реал газдарда, сұйықтықтарда, қатты денелерде) молекулааралық және молекула ішіндегі өзара әсер энергиялары да Ішкі энергияға жатады. Мұндай жүйелерде Ішкі энергия температурамен қатар қысым мен көлемге де тәуелді болады. Абс. нөлге жуық (-273, 16°С) төмен температуралар аймағында конденсацияланған жүйелер (сұйық және қатты дене) Ішкі энергиясының температураға тәуелділігі жойылып, ол белгілі бір тұрақты мәнге (U0) - “нөлдік энергия” дейтін мәнге ұмтылады (термодинамиканың үшінші бастамасы) . Ішкі энергия негізгі термодинамиқалық потенциалдардың бірі болып есептеледі. Көп атомды газдың ішкі энергиясы[өңдеу] Көп атомды газдың ішкі энергиясы дегеніміз - серпімдішариктер деп қарастыруға болатын молекулалардың ілгерілемелі қозғалыстың орташа кинетикалық энергиясы. Егер екі атомды газды алсақ, онда бізге атомдармен емес, молекулалармен жұмыс істеуге тура келеді, ал олар түрлене де алады.
Сондықтан, екі атомды идеал газдың ішкі энергиясы молекулалардың ілгерлемелі қозғалысының кинетикалық энергиясы мен айналмалы қозғалысының кинетикалық энергиясының қосындысына тең. Қаралып отырған процесстің қиындауынан ішкі энергияның кеңею құбылысы жүреді. Сонымен, газды ағынның өту кезіндегі зерттеуде, химиялық процесстермен, диссоциациямен, ионизациямен немесе ядролық реакциямен еріп жүретін, ішкі энергияны анықтауға арналған формулаларға, қосымша анықтаушы көрсеткіштер енгізіледі. Құбылыс саласындағы техникалық жылудинамикасының зерттеуінде, ішкі энергияны молекулярлы көзқараспен, кинетикалық және потенциалды энергияның қосындысы ретінде қарастырады, дененің молекулаларының өзара әрекеттігі мен қалай болса солай қозғалысы себепші болады. Газ энергиясының басқа түріне ие болуын есепке алмайды, себебі, қаралып отырған техникалық жылудинамикасындағы температураның, газ жағдайындағы өзгеру эсерін ескермейді.
Бiрақ, газ жұмысы бұрынғысынша сандық түрде бастапқы және соңғы күйлердегi p 1 және p 2 қысымдарына тең AV 1 және AV 2 кесiндiлерiмен және P -ның - V ға байланысты графигiмен шектелген фигураның ауданына тең болады. Идеал газдардың iшiнде өзiнiң физикалық қасиеттерi бойынша қарапайым болып табылатын газ бiр атомды газ (гелий, неон, аргон және т. б. ) . Бiр атомды газдың iшкi энергиясы. . Идеал газдың барлық iшкi энергиясы оның молекулаларының қалыптаспаған қозғалысының кинетикалық энергиясы болып табылады. Массасы m бiр атомды газ үшiн ол бiр атомның орташа кинетикалық энергиясының E = 3kT/2 жалпы атомдар санына N = mN a /M көбейткенге тең Қаралып отырған процесстің қиындауынан ішкі энергияның кеңею құбылысы жүреді. Сонымен, газды ағынның өту кезіндегі зерттеуде, химиялық процесстермен, диссоциациямен, ионизациямен немесе ядролык реакциямен еріп жүретін, ішкі энергияны анықтауға арналған формулаларға, қосымша анықтаушы көрсеткіштер енгізіледі. Құбылыс саласындағы техникалық жылудинамикасының зерттеуінде, ішкі энергияны молекулярлы көзқараспен, кинетикалық және потенциалды қосындысы ретінде қарастырады, дененің молекулаларының өзара әрекеттігі мен қалай болса солай қозғалысы себепші болады. Газ энергиясының басқа түріне ие болуын есепке алмайды, себебі, қаралып отырған техникалық жылудинамикасындағы температураның, газ жағдайындағы өзгеру эсерін ескермейді. Ішкі энергия u тек қана температураның функциясы болса, онда эксперимент кезінде, газ температурасының өзгеруі білінбеуі керек. Бірақ, көп емес, ол бар және оны Джоуль-Томсон эффектісі деген атпен аталады. Қандай газ болса да, Джоуль-Томсон (Дж) эффектісі идеалды газдардан, оның ауытқуы өлшемімен есептелінеді. Идеалды газдардың техникалық жылу динамикасындағы есептеулерінің көбісінде, потенциалды энергиясының молекулалары өзара әрекеттегісі Р және V байланыстығын қарастырмайды, ішкі энергия - тек қана температураның (функциясы) ретінде айтылады. Ішкі энергия (U) системаның жалпы энергия
Қорын сипаттайды. Оның құрамына системаны құрайтын электрондардын,
ядролардың, атомдардың, молекулалардың, бөлшектердің өзара әрекеті мен қозғалыстарындағы энергияның барлық түрлері енеді. Әйтсе де ішкі энергияға сыртқы күш өрісіндегі потенциалдык, энергия мен системадағы кинетикалық энергия4 енбейді. Оның абсолюттік мәнін ең қарапайым система үшін де анықтау мүмкін емес және термодинамика мақсаты үшін ол керек емес. Система бір күйден екіншіге ауысқан кездегі оның ішкі энергия өзгерісінің мәнін табу маңыздыU=U2-U1 Қарастырылып отырған процестегі системаның ішкі энергиясы көбейсе (артса), онда U оң, азайса теріс болады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz