Ферменттермен жұмыс істеу әдістемесі және ферменттерді бөліп алу технологиялары


Қазақстан Республикасының Білім және Ғылым министрлігі
Семей қаласының Шәкәрім атындағы мемлекеттік университеті
СӨЖ
Тақырыбы: «Ферменттермен жұмыс істеу әдістемесі. Ферменттерді бөліп алу »
Орындаған:Жумагазинов А. Е.
Тексерген: Қабденова А. Т.
Семей -2015ж.
ЖОСПАР
І. КІРІСПЕ
ІІ. НЕГІЗГІ БӨЛІМ
2. 1. Ферменттер биотехнологиясының міндеттері
2. 2. Ферменттердің қасиеттері
2. 3. Ферменттердің жіктелуі
2. 4. Микробиологиялық синтез технологиясының негізгі кезеңдері
2. 4. 1. Сүтқоректілердің тіндері мен ағзаларынан ферменттерді бөліп
алу технологиясы
2. 4. 2. Панкреатин өндірудің негізгі технологиялық кезеңдері
2. 4. 3. Өсімдік жасушаларынан ферментті кешенді бөліп алу технологиясы
ІІІ. ҚОРЫТЫНДЫ
IV. ПАЙДАЛАНҒАН ӘДЕБИЕТТЕР ТІЗІМІ
КІРІСПЕ
Ферменттер - барлық тірі организмдер құрамына кіретін арнайы ақуыздар. Химиялық реакциялардьі жеделдетеді. Реакция түрлеріне сай ферменттер 6 топқа бөлінеді:
1. оксидоредуктазалар,
2. трансферазалар,
3. гидролазалар,
4. лиазалар,
5. изомеразалар,
6. лигазалар.
Ферменттер жасушаларда синтезделіп, биохимиялық реакцияларға қатысатын ақуыздық табиғаттағы биокатализатор болып табылады. Фермент немесе энзим (лат. fermentum - ашу; грек. en - ішінде, zim - ашытқы; 19 ғ. Ван Гельмонт ұсынған) алғашқыда ашыту үдерістерінде анықталған зат. Энзимология, ферментология - ферменттерді зерттейтін ғылым саласы. Ол басқа ғылымдармен: биология, генетика, фармакология, химиямен тығыз байланысты. Ферменттердің қызметі туралы алғашқы ғылыми еңбекті Кирхгофф (1814) жариялады. Кейін ашу үдерісі ашытқы жасушаларында ғана өтеді деген ұйғарым жасаған Л. Пастерге (1871), Либих ферменттер жасушалардың өмір сүруіндегі пайда болған өнім, ол жасушада да, олардан бөлек те қызмет атқарады деген қарсы пікір білдірді. Либихтің ғылыми көзқарасы М. Манассейна (1871), Бухнер (1897) зерттеулерінде эксперимент жүзінде дәлелденді. Жасушаларда синтезделген ферменттер өзіне тән арнайы қызметтерін организмнің барлық мүшелерінде атқарады. Ферменттік қасиет, негізінен глобулалық құрылымдағы ақуыздарға тән екені белгілі. Бірақ, қазіргі кезде кейбір фибриллалық ақуыздар да (актин, миозин) катализдік белсенділік көрсететіні анықталды.
ІІ. НЕГІЗГІ БӨЛІМ
1836 жылы Т. Шванн асқазан сөлінен ақуыздарды ерітіп, ыдырататын затты бөліп алды. Ол пепсин еді. Сол жылы Я. Берцелиустың жұмысы жарыққа шықты. Онда: «Бізде өсімдіктер мен жануарлардың тіндері мен сұйықтықтары арасында көптеген түрлі ыдырауды шақыратын мыңдаған катализдік үрдістер жүретіні туралы жеткілікті дәлелдер бар. Келешекте, олар дене ағзаларын құрайтын тірі тіндердің катализдік күшін табуға үміттеміз» - деп жазған.
Микробтық, өсімдік және жануар табиғатының ферменттері биопрепараттар ретінде медициналық тәжірибеде адамның әртүрлі ауруларында диагностикалық және емдік мақсатта қолданады. Олар, әсіресе, организмде белгілі бір ферменттер мүлде болмауы не оның жеткіліксіздігінен туындаған тұқым қуалайтын патологияны емдеуде тиімді.
Ферменттер биотехнологиясының міндеттері:
- адам ауруларының емі мен алдын алу үшін ферменттік препараттарды алу технологиясын жасау;
- ферменттердің каталитиздік белсенділігі мен стереоталғамдылығына негізделген аналитикалық әдістерін, диагностикалық тест-жүйелерін жасау;
Ферменттер - барлық тірі ағзалардың негізгі жұмыс құралдары. Олар тірі ағзада өтетін барлық химиялық реакцияларға жауап береді: энергия және құрылыс материалдарымен қамтамасыз етеді; өмірлік үрдістерді реттеуге қатысатын сигналдық молекулаларды құрылуына және ыдырауына қатысады; организмді бөтен заттардан қорғайды. Сонымен қатар, ферменттер тұқым қуалау ақпараттарын қайта жазып көбейтуге, яғни ДНҚ мен РНҚ синтездеуге қатысады. Осы ақпараттың жүзеге асуына, яғни өз-өзінің және басқа ақуыздардың синтезделуіне қатысады.
Ферменттер басқа глобулалы ақуыздар сияқты рибосомаларда синтезделінеді, клетка ішінде қызмет атқарады (эндоферменттер), не сыртқы ортаға бөлінеді (экзоферменттер) . Көптеген эндоферменттер цитоплазмада еріген түрінде бола тұра, клеткада бос күйінде жүреді; басқалары күрделі жоғары реттелген құрылымдармен байланыста болады. Клеткалардың ферментті жиыны типті, түрге сипатты, генетикалық детерминацияланған. Сонымен қатар, клеткада арнайы әрқашан бір концентрацияда болатын конститутивті (өмірлік маңызды, жиі эндогенді) және концентрациясы субстраттың болуына байланысты индуцибельді ферменттерді ажыратады. Клетка индуцибельді ферменттерсіз де өз тіршілігін сақтай алады. Ферменттер клетканың функционалды ақуыздарының негізгі массасын құрайды. Кейбір энзимдер үшін белсенді қызмет уақыты 20 минуттан аспайды, кейіннен олар алмастырылуы керек. Басқа энзимдер ыдырап, организмнен жойылғанға дейін бірнеше апта бойы белсенді болып қалады. Ферменттер химиялық катализаторлардан да тиімді, одан бөлек олар таңдамалырақ: күрделі қоспалардан бір затты бөліп алып, оны бірнеше емес, бір өнімге айналдыра алады.
Ферменттер құрылысын оқып-зерттеудің негізін салған Д. Самнер, ол бірінші болып ферменттердің ақуыздық табиғатын ашқан. Осы уақытқа дейін кристалды түрінде 150-ге жуық ферменттер сипатталған, яғни олардың құрылысы ашылған.
Басқа ақуыздар тәрізді, ферменттер біріншілікті, екіншілікті, үшіншілікті және төртіншілікті құрылысымен сипатталады:
- біріншілкті құрылысы - бұл бір-бірімен пептидті байланыспен байланысқан аминқышқылдар реті;
- екіншілікті құрылысы - тізбектің басқа бөлімдеріндегі СО- және NH топтары арасындағы сутекті байланыс арқылы полипептидті тізбектің конформациясын спираль түрінде реттейді;
- үшіншілікті құрылысы - полипептидті тізбектің глобулаға фрагмент молекуласының гидрофобты ядросын түзу арқылы арнайы ретпен көрінеді. Химиялық байланыстың барлық түрлерін тұрақтандырады. Күшті байланыстар - пептидті және дисульфидті; әлсіз - сутекті, гидрофобты және электростатикалық;
- төртіншілікті құрылысы - екі және одан көп глобулалы бірліктердің ассоциациясы нәтижесінде құрылады.
Ферменттердің біріншілікті құрылысын секвенирлеу әдісі арқылы анықтайды - полипептидті тізбектегі аминқышқылдар реттілігін анықтау (наносаңылаулар арқылы полипептидті тізбекті өткізу жолымен ақуыздың біріншілікті құрылысын детекциялау әдісі жасап шығарылады; ол арқылы өткенде белгілі бір аминқышқылдарына детекцияның сәйкес сигналы беріледі) . Ферменттердің үшіншілікті құрылысын рентгенқұрылымды анализ арқылы анықтайды.
Біріншілікті құрылысы (аминқышқылдар тізбегі) Екіншілікті құрылысы (альфа-спираль) Үшіншілікті құрылысы Төртіншілікті құрылысы (ақуыз глобуласы)
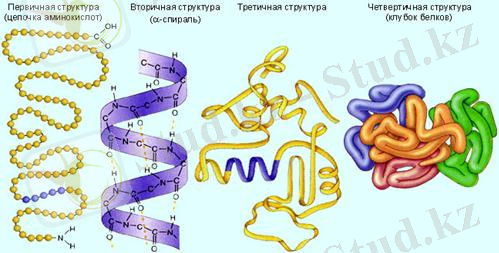
Ақуыздың құрылысы
Фермент құрылысында белсенді орталық пен аллостериялық, яғни «басқа кеңістікті құрылысы бар» орталықты ажыратады. Фермент белсенді орталығы кеңістікте жақындасқан әртүрлі полипептидті тізбек немесе полипептидті тізбектің әртүрлі бөлімдерінің құрамында орналасқан аминқышқыл қалдықтарынан құралған. Ақуыз-фермент үшіншілікті құрылысының деңгейінде құралады. Белсенді орталық субстратпен арнайы өзара байланысатын полярлы емес химиялық топтардың бірлестігімен көрінеді. Оның полипептидті басқа бөлімдерінен ерекшелініп тұратын арнайы топографиялық шекарасы жоқ. Ферменттердің белсенді орталықтарына протондардың донорлары (-COOH, -NH 3 , -SH) немесе акцепторлары (-COO, -NH2, -S-) болып табылатын арнайы аминқышқылды қалдықтар енеді.
Белсенді орталықтың бір түрі әртүрлі ферменттерде қолданылуы мүмкін. Осылайша, ДНҚ гидролиздейтін ферменттер (экзонуклеаза мен эндонуклеазалар) суды магний иондарының карбоксильді топтар кешенінің көмегімен белсенеді де, фрагменттерге ыдырайтын ДНҚ қосады. Белсенді орталық осындай түрінде ДНҚ-полимераза ферменті болады, бірақ ол фосфатты топтар арқылы екі негізді тігеді. Сол белсенді орталық, бірақ суды емес, негіздің қантты қалдығының гидроксильді тобын белсендіреді. Сондықтан, ДНҚ фрагменттерге ыдыратудың орнына, керісінше, фрагменттерден ДНҚ толық молекуласын түзу арқылы байланысу орынды.
Егер ферменттің субстратпен өзара әрекеттестігінің талғамдылығы белсенді орталық қасиетіне негізделген болса, онда аллостериялық орталықтың ферменттің каталитиздіқ белсенділігін реттеуде маңызы бар. Аллостериялық орталық фермент молекуласының бір бөлігі болып келеді, оған төмен молекулалы қосылыстар - тежеушілер не эффекторлар қосылғанда, ақуызды молекуланың үшіншілікті құрылысы өзгереді. Осының нәтижесінде белсенді орталықтың конфигурациясы өзгереді, ол ферменттін катализдік белсенділігінің артуымен не төмендеуімен көрінеді.
Фермент пен субстрат арасындағы кеңістікті өзара әрекетті түсіндіру үшін Э. Фишер «құлыпқа кілт» моделін ұсынды. Кейіннен ферментті реакциялар кинетикасын түсіндіру үшін түрлі математикалық модельдер жасап шығарылды (Моно, Михаэлис және т. б. ) . 1948 жылы Л. Полинг артынан тәжірибелік түрде дәлелденгендей, ферменттердің каталитиздіқ әсері химиялық реакциялардың ауыспалы жағдайы ферменттің белсенді орталығымен әрекеттесу арқылы тұрақтандырылады деп болжады. «Индуцияланған сәйкестік» гипотезасы бойынша (Кошланд моделі), ферментативті белсенділік реакция өнімі немесе субстрат молекуласынан айрықша аздаған молекулалармен реттелуі мүмкін. Аллостериялық орталықтардың болатыны көрсетілді, фермент белсенділігін реттейтін әдістер жасап шығарылды.
Ферменттердің қасиеттері:
- ферменттер әсерінің жоғары тиімділігі. Олар реакцияны 10 8 -10 12 есе жылдамдата алады;
- ферменттер реакция соңғы өнімдерінің құрамына кірмейді, яғни олар жұмсалмайды (бірақ кейбір ферменттер реакцияның соңында өзгермеген күйінде босап шықпай, модификацияға, кейде ыдырауға ұшырайды) . Ферменттің өте аз мөлшері субстраттың көп мөлшерінің ыдырауын катализдейді;
- ферменттердің субстрат (субстраттық талғамдылық) пен катализдеуші реакция типіне (әсер ету талғамдылығы, яғни химиялық реакцияның тек белгілі түрін ғана катализдеу мүмкіндігі) жоғары талғамдылығы; ферменттердің субстратқа талғамды әсері субстрат пен фермент молекулалары арасындағы конформациялық және электростатикалық комплементарлыққа және белсенді орталықтың ерекше құрылысына негізделген. Кейбір ферменттер тобында әлсіз әсер ету талғамдылығы байқалады, бұл топтық талғамдылығы бар ферменттер. Олардың әсер ету талғамдылығы субстрат молекуласындағы химиялық байланыс түріне байланысты. Осылайша, пепсин өсімдік және жануар табиғатының ақуыздарын олардың химиялық құрылысы мен аминқышқылдық құрамы, сондай-ақ, физикалық-химиялық қасиеттеріне қарамай, ыдырата алады. Алайда, пепсин көмірсу мен майды ыдыратпайды. Бұл пепсиннің пептидті - СО-NH - байланысына әсер етуімен түсіндіріледі. Басқа топтық талғамдылығы бар липаза-ферменттері глицерин мен май қышқылына дейін гидролизін катализдейтін липазаның әсер ету орны күрделі эфирлі байланыс болып табылады.
Моноталғамдық ферменттердің тек бір ғана субстраттың өзгеруін катализдейтін мүмкіндігі бар (мысалы, СО 2 ыдырауын катализдейтін бактериалық стереохимиялық талғамдылығы тек L-аспарагин қышқылынан L-аланинге айналуын қамтамасыз етеді) ;
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz