Идеал газдың макроскопиялық күй теңдеуі және негізгі газ заңдары


Білім және ғылым министрлігі
Семей қаласының Шәкәрім атындағы мемлекеттік университеті
СӨЖ
Тақырыбы: Идеал газдың макроскопиялық күй теңдеуі
Орындаған: Оралбекова А.
Тобы: ХН-401
Тексерген: Абдуахитова О. Т.
Семей, 2015
Жоспар:
Кіріспе
1. Идеал газ
2. Газдың қысымы
3 . Температура
4. Идеал газ күйінің теңдеуі
5. Идеал газ заңдары
6. Пайдаланылған әдебиеттер
Кіріспе
Көптеген жағдайларда біз нақты бір жүйелерді қарастыратын боламыз: бұл қайсы-бір дене немесе қайсы-бір денелер жүйесі болып табылады: осы жүйенің төңірегіндегІ қалған барлық денелер қоршаған орта деп аталады. Нақты жүйенің күйін (немесе жүйенің болу шартын) сипаттау үшін, мысалға ыдыстағы газ болсын, макроскопиялық немесе микроскопиялық көзқарастарды пайдаланамыз . Микроскопиялық сипаттау дегенімІз жүйені түзетін барлық молекулалар мен атомдардың қозғалыстарын жан-жақты қарастыру, бұл аса күрделі болып кетуі мүмкін. Бұл кинетикалық теорияның (жөне статистикалық механиканың) үлесІ болып табылады. Макроскопиялық сипаттау кезінде біз сипаттауды тікелей өлшеуге болатын шамалар арқылы береміз: оларға көлем, масса, қысым жөне температура жатады. Жүйенің күйін кез келген уақыт мезетінде анықтау үшін қажет болатын макроскопиялық айнымалылардың саны жүйенің түріне тәуелді болады. Мысалы, ыдыстағы газдың күйін сипаттау үшін үш айнымалы жеткілікті, оларға көлемді, қысымды жөне температураны алуға болады. Жүйенің күйін анықтау үшін қажет болатын осыған ұқсас шамалар күй параметрлері деп аталады.
1. Идеал газ
Кезкелген зат қабылдай алатын үш агрегаттық күйлердің ең қарапайымы газ күйі болып табылады, себебі бүл кезде молекулалар арасында әсер ететін күштер өте әлсІз, белгілі жағдайларда оларды ескермей кетуге болады. Сондықтан молекулалық физиканы газдардың қасиеттерін қарастырудан бастаған ыңғайлы. Бүл жерде біз, еуелі газдағы молекула аралық күштер аз ғана емес, оларды тіптен жоқ деп санаймыз. Сонымен қатар қарапайым шарт үшін молекулалардың өлшемдерін де ескермейміз, яғни оларды материалдық нүктелер деп есептейтін боламыз. Осындай кезде газ молекулаларын еркін, өзара әрекетгеспейтін мелшерсіз бөлшектер жүйесі деп қара-стыруға болады. Молекулалар енді түзу сызықты жөне бірқалыпты қозғалатын болады. Әрбір молекула өзін ыдыста өзінен басқа молекула жоқ секілдІ сезінетін болады. Кейін, реал (нақты) газдарды қарастырған кезде бүл айтылғандардан бас тартуға тура келеді. Өзара әрекеттеспейтін материалдық нүктелердің жиынтығының қасиеттеріндей қасиеттері бар газды идеал газ деп атайды. БіздІң бастапқы мақсатымыз осы идеал газ кинетикалық теориясын қарастыру болып табылады.
2. Газдың қысымы
Ыдыста түрған газды қарастырайық. Бей-берекет қозғалыстағы газ молекулалары өзІ тұрған ыдыстың қабырғасына да, өзара да өте жақын қашықтыққа жақындайды. Осы кезде газ молекулаларының арасында немесе газ молекулалары мен ыдыстың затының молекулаларының арасында қашықтаған сайын өте тез қүлдырайтын өзара әрекеттесу күші пайда болады. Осы күштердің әсерінен газ молекулалары өздерінің бағытын өзгертеді. Бүл процесс соқтығысулар деп аталады. Соқтығысулар газдың сипаттамаларында үлкен рөл атқарады. Оған толығырақ кейінірек тоқталамыз. Қазір біз назарымызды молекулалардың ыдыстың қабырғасымен немесе газ жанасып түрған кезкелген бетпен соқтығысуларына аударамыз. Міне, газ молекулаларының және қабырғаның осы өзара әрекеттесуі газ тарапынан қабырғаға эсер ететш және оған теңбе-тең, бағы-ты жағынан қарама-қарсы, қабырға тарапынан газға эсер етілетін күшті анықтайды. Қабырғаға газ тарапынан эсер ететін күштің мөні қабырғаның ауда-ны неғүрлым үлкен болса, ол да солғүрлым үлкен болады. Міне, қабырғаның осы ауданы тәрізді кездейсоқ шамаға төуелді болмас үшін газдың қабырғаға әсерін күш арқылы емес, қысым аркылы, яғни ыдыстың бетінің бірлік ауданына перпендикуляр түсірілген ғ күштің шамасымен сипатгау қабылданған. Газдың өзі түрған ыдыстың қабырғасына қысым түсіруі газдың негізгі қасиеттерінің бірі. Газдың бар-жоғын көбіне оның осы қысымы арқылы ғана анықтауға болады. Сондықтан да қысым газдың ең басты сипаттамапарының бірі болып табылады. Газдың ыдыстың қабырғасына түсіретін қысымы газ молекулаларының ыдыс қабырғасымен сансыз-көп соқтығысуларының нәтижесі болып табылады. Молекулалардың осындай соқтығысуларының нәтижесінде ыдыс қабырғасының материалының бөлшектері ығысады, яғни деформцияланады. Деформацияланған қабырға, әрбір нүктеде қабырғаға перпендикуляр бағытталған серпімді күшпен газға эсер етеді. Бүл күш шама жағынан газдың кабырғаға түсіретін күшіне тең де, ал бағыты жағынан оған қарама-қарсы болады. ӘрбІр жеке молекуланын қабырға молекулаларымен әрекетгесу күшінің шамасы белгісіз болса да, механика заңдарына сүйене отырып, газдың барлық молкеулалардың қозғалысынан туған орташа күшті, яғни қысымды табуға болады екен. Газ параллелипед түріндегі ыдыста болсын, әрі газ тепе-тендік күйде делік. Бүл берілген уакытта газ ыдыс қабырғаларына катысты тұтастай алғанда тынышгыкта деген сөз: қайсы-бір алынған бағытга қозғалатын
молекулалар саны орташа есеппен жылдамдықтары карама-карсы жақка бағытталған молекулалар санына тең. Газдың ыдыстың бір қабырғасына, мысалға, оң жақ abcd бүйір қабырғасына түсіретін қысымын есептеп шығарайық, x координат осін параллелепипедтің abcd қа-бырғасына перпендикуля рқырының бойымен бағыттайық V жылдамдықтар қалай бағытталса да, бізге керегі тек молекулалар жылдамдығынын х өстегі Vх қүраушылары ғана abcd қабырғаға қарай молекулалар тек VХ жылдамдыкпен ғана қозғалады. Қарастырылмақ қабырғаға жанай жатқан қалындығы Δх газ қабатын ойша бөліп алайық. Оған деформацияланған қабырға тарапынан серпімді күш Ғәсер етеді. Абсолют шамасы жағынан дәл осындай күшпен газ да қабрғаға әсер етеді. Ньютонның екінші заңы бойынша күш импульсы ҒΔt (мұндағы t - қайсы-бір уақыт аралығы) біздің қабаттағы газ импульсының өзгерісіне тең болады. Газ тепе-тендік күйде, сондықтан газ күш импульсы бағытында (х өсінің оң бағытына қарсы бағытта) ешқандай импульс өсімшесін қабылдамайды. Газ молекулаларының ретсіз қозғалысы кезінде уақыттың ішіңде біздің қабатқа солдан оңға қарай молекулалардың қайсы бір саны кіріп, молекулалар-дың сонша саны одан кері бағытта, оңнан солға қарай, шығады. Кіретін молеку¬лалар өздерімен бірге белгілі импульс мөлшерін ала кіреді. Шығатын молекулалар өздерімен бірге карсы таңбалы дәл осындай импульс мөлшерін ала кетеді де, қабаттың алған импульсы қабатка кіретін және одан шығатын молекулалардың импульстерінің алгебралық қосындысына тең болады. Біздің қабатқа уақыттың ішінде сол жақтан келіп кіретін молекулалар санын есептеп шығарайық. Осы уақыттың ішінде шекаралыққа сол жақтан оданшама- сынан аспайтын қашықтықта орналасқан молекулалар келіп жете алады. Олардың барлығы да табанының ауданы және үзындығы 5олатын параллелепипедтің көлемінде, яғни көлемде орналасқан.
3. Температура
Барлық газдар жылу тепе-теңдiгi кезiнде температуралары бiрдей болады. Молекулалардың жылулық қозғалысы сөз болғандықтан, температураны молекулалық деңгейдегi физикалық шамалар арқылы жазу керек. Бұндай шама ретiнде молекуланың iлгерлемелi қозғалысының кинетикалық энергиясын алуға болады. Бұл жорамал үш ыдыспен жасалған тәжiрибеде толық дәлелденедi.
Тәжiрибе көрсеткендей, θ=pV/N қатынасы температурадан басқа ештеңеден тәуелдi емес, сондықтан оны Т температураның бiрден-бiр өлшемi ретiнде қарастыруға болады.
θ = kТ немесе pV/N = kT , (1. 14)
мұнда k - Больцман тұрақтысы деп аталатын пропорционалдық коэффициентi.
(1. 14) теңдiгiмен анықталатын температура терiс шама болуы мүмкiн емес. Сондықтан ол абсолюттi температура деп аталады.
Температураның абсолюттi нөлi ( Т = 0) деп молекулалық қозғалыстардың тоқтаған кезiн ( E = 0) айтады. Бұл табиғаттағы ең төмен температура. Осы анықтама негiзiнде ағылшын ғалымы У. Кельвин температураның абсолюттi шкаласы ұғымын енгiздi. Бұл шкала бойынша температура абсолюттi нөлден бастап саналады және оның бөлiктерi Цельсий шкаласының градусына тең. Абсолюттi T температура мен Цельсий шкаласы бойынша t температураның арасындағы байланыс Т = t +273 теңдiгiмен берiледi. СИ жүйесiнде абсолюттi температура кельвинмен өлшенедi және ол К әрпiмен белгiленедi. Бiр кельвин Цельсий шкаласы бойынша бiр градусқа тең (1 К =1 o С ) .
(1. 14) өрнегiн молекулалық-кинетикалық теорияның
PV/N
=2/3
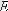 түрiндегi негiзгi теңдеуiмен теңестiрiп
түрiндегi негiзгi теңдеуiмен теңестiрiп
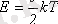 . (1. 15)
. (1. 15)
Осылайша, абсолюттi температура газ молекулаларының жылулық қозғалысының орташа кинетикалық энергиясының өлшемi болып табылады.
(1. 14) формуладан шығатыны мынадай өрнек
p = nkT . (1. 16)
Қысым мен температура бiрдей болған жағдайда барлық газдардағы молекулалар концентрациясы да бiрдей болады ( k тұрақтысы газдың қасиетiнен тәуелсiз) . Басқаша айтқанда Авогадро заңының орындалуы байқалады: көлемдерi бiрдей газдарда қысым мен температура бiрдей болған жағдайда олардағы молекулалар саны да бiрдей болады.
4. Идеал газ күйінің теңдеуі
Орыс ғалымы Д. И. Менделеев Клайперон және Авогадро заңдарын біріктіре отырып идеал газ күйінің теңдеуін алды:
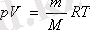
мұндағы: R-универсал газ тұрақтысы, R= 8, 31 Дж/(моль·К) .
Бұл теңдеу кейде Менделеев-Клапейрон теңдеуі деп аталады.
Газ молекулалары барлық уақытта ретсiз жылулық қозғалыста болады, оның мөлшерлiк сипаттамасын молекуланың сызықты жылдамдығының орташа квадраты, дәлiрек айтқанда, кинетикалық энергиясының орта мәнi бередi. Жеке молекулалардың жылдамдықтары бiр-бiрiнен өзгеше болуы мүмкiн, бiрақ бұл жылдамдықтардың модулiнiң орташа мәнi белгiлi бiршама. Жеке молекулалардың жылдамдықтарын v 1 , v 2 , v 3 , . . . , v N арқылы белгiлеймiз. Сонда, жылдамдықтардың квадратының орташа мәнi келесi формуламен анықталады:
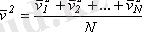 ,
,
мұнда,
N
- газдағы молекулалардың жалпы саны. Екiншi жағынан
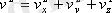 . Қозғалыстың бейберекеттiгi әсерiнен молекулалардың барлық бағыттарда орынауыстыруы тең мүмкiндiкте. Сондықтан, жылдамдықтың проекциясының квадраттарының орташа мәндерi өзара тең:
. Қозғалыстың бейберекеттiгi әсерiнен молекулалардың барлық бағыттарда орынауыстыруы тең мүмкiндiкте. Сондықтан, жылдамдықтың проекциясының квадраттарының орташа мәндерi өзара тең:
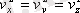 . Бұны ескере отырып, алатынымыз
. Бұны ескере отырып, алатынымыз
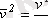 (1. 10)
(1. 10)
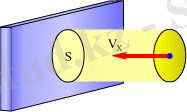
Ендi идеал газдың ыдыс қабырғасына әсер ететiн күшiн табайық. Қоршаған ортаның қандайда бiр бетке әсерiнiң физикалық сипаттамасы - күш емес қысым болып есептеледi. Қысым деп бiрлiк ауданға нормаль бойымен әсер ететiн күштi айтады. Қысым p әрпiмен белгiленiп, анықтамасы бойынша мынаған тең: p=F n /S , мұнда S - бет элементiнiң ауданы, ал F n - бет элементiне перпендикуляр әсер ететiн күш шамасы (1. 5 - сурет) .
Идеал газ жағдайында F n нормаль күштiң шамасы келесi өрнекпен анықталады:
 (1. 11)
(1. 11)
мұнда, n - газ молекуласының концентрациясы (бiрлiк көлемдегi молекулалар саны: n=N/V ), m 0 - молекула массасы.
Бұл қатынастың қорытындысы
Газдың барлық молекулаларда
v
x
жылдамдық мәнi бiрдей бола бермейдi, олай болса қабырғаға әсер ететiн күштiң уақыт бойынша орта мәнi
v
2
x
-қа емес, жылдамдықтарының орташа квадратына пропорционал:
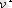 . (1. 10) -шi формуланы ескере отырып, алатынымыз:
. (1. 10) -шi формуланы ескере отырып, алатынымыз:
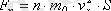 Анықтамасы бойынша
p = F
n
/S
. Бұдан шығатыны
Анықтамасы бойынша
p = F
n
/S
. Бұдан шығатыны
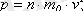 (1. 12)
(1. 12)
Егер
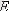 арқылы молекуланың iлгерлемелi қозғалысының орташа кинетикалық энергиясын белгiлесек:
арқылы молекуланың iлгерлемелi қозғалысының орташа кинетикалық энергиясын белгiлесек:
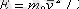 , онда (1. 12) теңдеуiн басқаша түрде жазуға болады
, онда (1. 12) теңдеуiн басқаша түрде жазуға болады
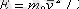 (1. 13)
(1. 13)
(1. 12) немесе (1. 13) қатынастар газдардың молекулалық-кинетикалық теориясының негiзгi теңдеулерi болып табылады. Олар, тiкелей өлшенетiн, макроскоптық шама - қысымды қозғалыстағы молекулаларды сипаттайтын микропараметрлармен байланыстырады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz