Ферменттік катализдің кинетикасы мен әсерлесу механизмдері


Қазақстан Республикасының Ғылым және Білім министрлігі
Семей қаласының Шәкәрім атындағы мемлекеттік университеті
СӨЖ
Тақырыбы :
«Ферменттер әсерінің кинетикасы»
Орындаған: Ашкенова З. Н.
Тексерген: Кабденова А. Т.
Семей қ. 2015 ж
Мазмұны
Кіріспе
- Негізгі бөлімФерменттер құрылысыФерменттік катализдің теориялық әсерлесуінің ерекшеліктері
Қорытынды
Қолданылған әдебиеттер тізімі
Кіріспе
Ферменттер - барлық тірі ағзалардың негізгі жұмыс құралдары. Олар тірі ағзада өтетін барлық химиялық реакцияларға жауап береді: энергия және құрылыс материалдарымен қамтамасыз етеді; өмірлік үрдістерді реттеуге қатысатын сигналдық молекулаларды құрылуына және ыдырауына қатысады; организмді бөтен заттардан қорғайды. Сонымен қатар, ферменттер тұқым қуалау ақпараттарын қайта жазып көбейтуге, яғни ДНҚ мен РНҚ синтездеуге қатысады. Осы ақпараттың жүзеге асуына, яғни өз-өзінің және басқа ақуыздардың синтезделуіне қатысады.
Ферменттер басқа глобулалы ақуыздар сияқты рибосомаларда синтезделінеді, клетка ішінде қызмет атқарады (эндоферменттер), не сыртқы ортаға бөлінеді (экзоферменттер) . Көптеген эндоферменттер цитоплазмада еріген түрінде бола тұра, клеткада бос күйінде жүреді; басқалары күрделі жоғары реттелген құрылымдармен байланыста болады. Клеткалардың ферментті жиыны типті, түрге сипатты, генетикалық детерминацияланған. Сонымен қатар, клеткада арнайы әрқашан бір концентрацияда болатын конститутивті (өмірлік маңызды, жиі эндогенді) және концентрациясы субстраттың болуына байланысты индуцибельді ферменттерді ажыратады. Клетка индуцибельді ферменттерсіз де өз тіршілігін сақтай алады. Ферменттер клетканың функционалды ақуыздарының негізгі массасын құрайды. Кейбір энзимдер үшін белсенді қызмет уақыты 20 минуттан аспайды, кейіннен олар алмастырылуы керек. Басқа энзимдер ыдырап, организмнен жойылғанға дейін бірнеше апта бойы белсенді болып қалады. Ферменттер химиялық катализаторлардан да тиімді, одан бөлек олар таңдамалырақ: күрделі қоспалардан бір затты бөліп алып, оны бірнеше емес, бір өнімге айналдыра алады [1] .
- Ферменттер құрылысы
Ферменттер құрылысын оқып-зерттеудің негізін салған Д. Самнер, ол бірінші болып ферменттердің ақуыздық табиғатын ашқан. Осы уақытқа дейін кристалды түрінде 150-ге жуық ферменттер сипатталған, яғни олардың құрылысы ашылған.
Басқа ақуыздар тәрізді, ферменттер біріншілікті, екіншілікті, үшіншілікті және төртіншілікті құрылысымен сипатталады:
- біріншілкті құрылысы - бұл бір-бірімен пептидті байланыспен байланысқан аминқышқылдар реті;
- екіншілікті құрылысы - тізбектің басқа бөлімдеріндегі СО- және NH топтары арасындағы сутекті байланыс арқылы полипептидті тізбектің конформациясын спираль түрінде реттейді;
- үшіншілікті құрылысы - полипептидті тізбектің глобулаға фрагмент молекуласының гидрофобты ядросын түзу арқылы арнайы ретпен көрінеді. Химиялық байланыстың барлық түрлерін тұрақтандырады. Күшті байланыстар - пептидті және дисульфидті; әлсіз - сутекті, гидрофобты және электростатикалық;
- төртіншілікті құрылысы - екі және одан көп глобулалы бірліктердің ассоциациясы нәтижесінде құрылады.
Ферменттердің біріншілікті құрылысын секвенирлеу әдісі арқылы анықтайды - полипептидті тізбектегі аминқышқылдар реттілігін анықтау (наносаңылаулар арқылы полипептидті тізбекті өткізу жолымен ақуыздың біріншілікті құрылысын детекциялау әдісі жасап шығарылады; ол арқылы өткенде белгілі бір аминқышқылдарына детекцияның сәйкес сигналы беріледі) . Ферменттердің үшіншілікті құрылысын рентгенқұрылымды анализ арқылы анықтайды.
Біріншілікті құрылысы (аминқышқылдар тізбегі) Екіншілікті құрылысы (альфа-спираль) Үшіншілікті құрылысы Төртіншілікті құрылысы (ақуыз глобуласы)
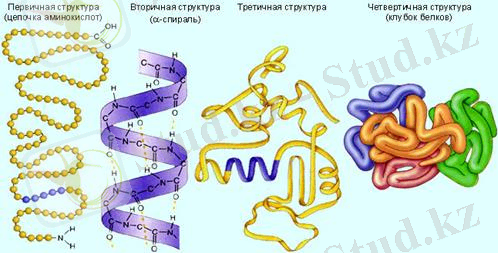
1-сурет. Ақуыздың құрылысы
Фермент құрылысында белсенді орталық пен аллостериялық, яғни «басқа кеңістікті құрылысы бар» орталықты ажыратады. Фермент белсенді орталығы кеңістікте жақындасқан әртүрлі полипептидті тізбек немесе полипептидті тізбектің әртүрлі бөлімдерінің құрамында орналасқан аминқышқыл қалдықтарынан құралған. Ақуыз-фермент үшіншілікті құрылысының деңгейінде құралады. Белсенді орталық субстратпен арнайы өзара байланысатын полярлы емес химиялық топтардың бірлестігімен көрінеді. Оның полипептидті басқа бөлімдерінен ерекшелініп тұратын арнайы топографиялық шекарасы жоқ. Ферменттердің белсенді орталықтарына протондардың донорлары (-COOH, -NH 3 , -SH) немесе акцепторлары (-COO, -NH2, -S-) болып табылатын арнайы аминқышқылды қалдықтар енеді.
Белсенді орталықтың бір түрі әртүрлі ферменттерде қолданылуы мүмкін. Осылайша, ДНҚ гидролиздейтін ферменттер (экзонуклеаза мен эндонуклеазалар) суды магний иондарының карбоксильді топтар кешенінің көмегімен белсенеді де, фрагменттерге ыдырайтын ДНҚ қосады. Белсенді орталық осындай түрінде ДНҚ-полимераза ферменті болады, бірақ ол фосфатты топтар арқылы екі негізді тігеді. Сол белсенді орталық, бірақ суды емес, негіздің қантты қалдығының гидроксильді тобын белсендіреді. Сондықтан, ДНҚ фрагменттерге ыдыратудың орнына, керісінше, фрагменттерден ДНҚ толық молекуласын түзу арқылы байланысу орынды.
Егер ферменттің субстратпен өзара әрекеттестігінің талғамдылығы белсенді орталық қасиетіне негізделген болса, онда аллостериялық орталықтың ферменттің каталитиздіқ белсенділігін реттеуде маңызы бар. Аллостериялық орталық фермент молекуласының бір бөлігі болып келеді, оған төмен молекулалы қосылыстар - тежеушілер не эффекторлар қосылғанда, ақуызды молекуланың үшіншілікті құрылысы өзгереді. Осының нәтижесінде белсенді орталықтың конфигурациясы өзгереді, ол ферменттін катализдік белсенділігінің артуымен не төмендеуімен көрінеді.
Фермент пен субстрат арасындағы кеңістікті өзара әрекетті түсіндіру үшін Э. Фишер «құлыпқа кілт» моделін ұсынды. Кейіннен ферментті реакциялар кинетикасын түсіндіру үшін түрлі математикалық модельдер жасап шығарылды (Моно, Михаэлис және т. б. ) . 1948 жылы Л. Полинг артынан тәжірибелік түрде дәлелденгендей, ферменттердің каталитиздіқ әсері химиялық реакциялардың ауыспалы жағдайы ферменттің белсенді орталығымен әрекеттесу арқылы тұрақтандырылады деп болжады. «Индуцияланған сәйкестік» гипотезасы бойынша (Кошланд моделі), ферментативті белсенділік реакция өнімі немесе субстрат молекуласынан айрықша аздаған молекулалармен реттелуі мүмкін [2] .
1. 2 Ферменттік катализдің теориялық негіздері
Ферменттер басқа да катализаторлар (бейорганикалық) тәрізді термодинамикалық тұрғыдан жүруі мүмкін емес реакцияны жүргізбейді. Тек, жүре алатын реакцияның жылдамдығын ғана жоғарлатады. Кез келген химиялық реакцияның жүру мүмкіндігі оның реакция өнімдерінің энергиясының реакцияласушы заттардың энергиясынан төмен немесе бірдей болғанында ғана өтеді. Реакция қашанда бос энергияның төмендеуі бағытына қарай жүреді, сондықтан реакция тепе-теңдігі өнімдер түзілуіне сәйкес ығысады. Бірақ, кез келген реакция басталуы үшін оның кедергі энергиясын, активтеуші энергияны қосу арқылы жеңуі қажет. Себебі реакция жүргенде кедергі энергиясының энергиялық қоры артық аздаған молекулалар ғана әсерлеседі. Бұл жағдайда реакция жылдамдығы да баяу болады.
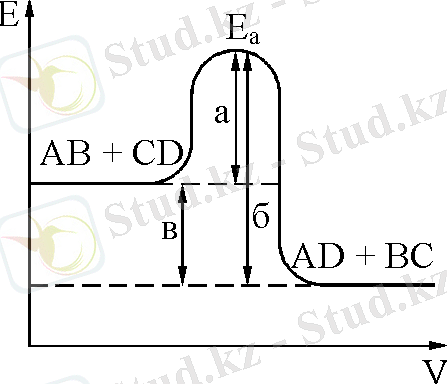
Сур. 2. Ферментативті реакцияның энергетикалық схемасы.
Реакцияласушы заттардың көптеген молекулалары бір бірімен неғұрлым жиірек әсерлесетін болса ғана жылдамдық жоғарлауы мүмкін. Ол тек активтеуші энергия көмегімен активтелген молекулалар мөлшерінің көбеюі нәтижесінде бола алады.
Екі заттың реакциясын байқағанда
АВ + CD ↔︎ AD + BC
реакция өнімдері (AD, BC) түзілуі үшін АВ және CD әсерлесуіне қажет а-ға тең (активтендіруші энергия) энергияны қосымша алуы қажет. Ал реакция кері бағытта жүретін болуы үшін б-ға тең шамадағы көп мөлшерде энергия қажет. Сол себепті кері бағытта жүретін реакцияның активтендіруші энергиясы (Е а ) жоғары болады. Бұл жағдайда екі реакция үшін де бірдей өзгеретін бос энергияның шамасын в-кесіндісі көрсетеді. Солдан оңға қарай өтетін реакция экзотермиялық, ал кері бағыттағы реакция эндотермиялық болады. Сондықтан реакцияларды эндергоникалық (энергияны қабылдап жүретін реакция) және экзергоникалық (энергия бөліп жүретін реакция) реакцияларға бөледі. Реакция жүргенде энергияның жылу түрінде бөлінуі немесе қосып алуы міндетті емес.
Реакция жылдамдығының жоғарлауы катализатордың Е а -ны (кедері энергиясын) төмендетуі арқылы өтеді. Ол суретте үзікті сызықпен көрсетілген. Мысалы, сутегі асқын тотығын (Н 2 О 2 ) сутегі мен оттегіге бөлу үшін (Н 2 О 2 → Н 2 ↑ + О 2 ↑) Е а = 75, 2 кДж/моль қажет. Коллоидтық пласты катализатор ретінде қолданғанда Е а = 50, 2 кДж/моль, ал биокатализатор каталаза қатысқанда Е а = 8, 3 кДж/моль қажет болады.
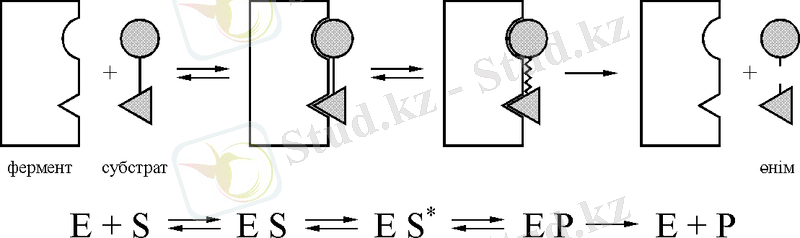
Биокатализатор-ферменттің жылдамдығын жоғарлатуы немесе Е а -ны төмендеуі көп этапты механизм арқылы іске асады.
Сур. 3. Фермент пен субстраттың әсерлесу механизмі (Михаэлис-Ментен) .
Ферментативті реакцияның жүруін жалпы түрде үш этапқа бөледі.
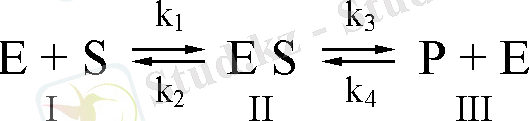
немесе фермент + субстрат ↔︎ фермент-субстраттық комплекс →
→ өнім + фермент.
Бұл реакция теңдеуінде (Михаэлис-Ментен теңдеуі) шешуші рольді фермент пен субстраттың қосылуынан түзілген фермент-субстраттық комплекс атқарады. Ферменттің әсерлесу спецификасына тәуелді өтетін бұл қосылыс белгілі бір байланыстардың әлсізденіп бір мезгілде субстрат активтелінуі мен реакцияласушы қабілетінің жоғарлауына әкеледі. Фермент-субстраттық комплексте бір мезгілде екі процесс өтеді: алғашқыда, комплекстің электрондар тығыздығының өзгеруі нәтижесінде ондағы байланыстардың полярлануы және соңынан субстрат молекуласындағы және активтік орталықтағы кейбір байланыстардың геометриялық деформациясы. Молекулалардағы химиялық байланыстардың деформациясы мен полярлануы фермент-субстрат комлексінің аралық қалпындағы кедергіні (активтеуші энергияны (Е а ) ) жеңуді қамтамассыз етеді. Ферментативтік катализдің бірінші этапында фермент пен субстраттың бір бірмен ковалентті немесе басқа түрлі байланысуы өтеді. Екінші этапта субстрат оған байланысқан ферменттің әсерінен химиялық өзгерістерге түседі. Соның нәтижесінде фермент-өнім комплексі пайда болады. Үшінші этапта фермент-өнім комплексі бөлініп фермент және өнімге ажыратылады [3] .
Қысқа уақытта «өмір сүріп», жылдам арада құрам бөліктеріне ажырайтын фермент-субстрат комплексі туралы түсінік 1913 ж. Михаэлис пен оның шәкірті Ментеннің ферментативті реакциялардың кинетикасына анализ жасауы нәтижесінде дамытылды және кейін Михаэлис-Ментен теориясы деп аталды. Бұл теория бойынша жоғарыда келтірілген схема ферментаттік процесстің үдеуі, энергетикалық тұрғыдан, реакцияның кедергі энергиясын тұрақсыз фермент-субстрат комплексі түзілуі көмегімен «айналып» өтуі арқылы іске асады. Комплекстің түзілуінде және ыдырауында аралық реакциялардың энергиясын негізгі реакцияға қарағанда төмендеу кедергілік энергияда болады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz