Ішкі энергия: молекулалық-кинетикалық негіздері және термодинамикалық өзгерістері


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТІРЛІГІ
СЕМЕЙ КАЛАСЫНЫҢ ШӘКАРІМ АТЫНДАҒЫ МЕМЛЕКЕТТІК УНИВЕРСИТЕТІ
ТАҚЫРЫБЫ:
« Ішкі энергия »
Орындаған: Нұрамбаев. Қ. Б
ТОс-423
Тексерген: Шалаганова А. Н
Семей 2015
Жоспар
Кіріспе
1. Ішкі энергия.
2. Ішкі энергиядағы жылу мөлшері
4. Қорытынды
5. Қолданылған әдебиеттер
Кіріспе
Дененін ішкі энергиясы - денені кұрайтын барлық бөлшектердің қозғалысының кинетикалық энергиясы мен өзара әсерлесулерінің потенциялдык энергияларының қосындысы. Ішкі знергия-скаляр шама.
Ішкі энергия дененің температурасы мен агрегаттык күйіне тәуелді. Ішкі энергия дененің орналасу жағдайына ( дене тыныштықта ма, әлде қозғалыста бола ма) тәуелді емес.
Дененің толық энергиясы - механикалық және ішкі энергияларының косындысы кез- келген процестерде өзгермейді.
Температуранын артуынша қарай дененің ішкі энергиясы да артады, себебі молекулалардың орташа кинетикалык энергиясы артады. Температураның төмендеуіне қарай дененің ішкі энергиясы азаяды.
Бір молекуланың потенциалдык және кинетикалык энергиясының аздығы.
Денеде молекулалар саны көп болса, сәйкесінше ішкі энергиясы да көп болады.
Сутегінің бір молекуласының ішкі энергиясы өте аз (5-10~ !1 Дж), ал 1 м 3 көлемдегі сутегінің ішкі энергиясы (14 Дж) . Осындай мөлшердегі энергия көмегімен массасы 5 т балғаны Зм биіктікке көтеруге болады.
Дененің ішкі энергиясы жұмыс атқарған кезде өзгереді. Егер денемен жұмыс атқарылса, онда дененің ішкі энергиясы артады. Дененің өзі жұмыс атқарса, онда дененін ішкі энергиясы кемиді.
ДененІң ішкі эпергиясын жылу берілу (жылу алмасу) арқылы да өзгертуге болады. Жылу алмасу температуралары әр түрлі денелер арасында жүреді.
Ішкі энергия - ішкі энергия ұғымын 1851 жылы У. Томсон енгізген. Дененің (жүйені) тек ішкі күйіне байланысты энергия. Жылу табиғатын эксперимент жүзінде ХVIIІ ғасырдың аяғында ағылшын ғалымы Бенжамен Томпсон (1753-1814) ашты. Энергияның сақталу заңына сәйкес ішкі энергия физикалық жүйе күйінің, яғни осы күйді анықтайтын тәуелсіз айнымалылардың (мысалы, температура, көлем не қысым), бір мәнді функциясы болады. Iшкi энергияның механикалық энергияға айналуының керi процесi болатыны сөзсiз. Молекулалық-кинетикалық теория көзқарасынан макроскопиялық дененiң iшкi энергиясы барлық молекулалардың ретсiз қозғалыстарының кинетикалық энергиялары мен олардың бiр-бiрiмен өзара әсерiнiң потенциалдық энергияларының қосындысына тең.
Ішкі энергия.
Заттарды құрайтын бөлшектердің қозғалысының орташа кинетикалық энергиясының осы бөлшектердің өзара әсерлесу орташа потенциалдық энергиясына қосындысын ішкі энергия деп атайды. Өлшем бірлігі
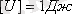 .
.
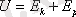
Идеал газдың ішкі энергиясы абсолют температураға тура пропорционал болады:
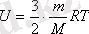
Идеал газдың ішкі энергиясының өзгерісі
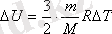
Кез-келген газдардың ішкі энергиясы
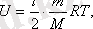
мұндағы:
 - газ молекуласының еркіндік дәрежесі.
- газ молекуласының еркіндік дәрежесі.
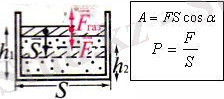
Ішкі энергия - Ішкі энергия ұғымын 1851 жылы У. Томсон енгізген. Дененің (жүйені) тек ішкі күйіне байланысты энергия. Дененің бір күйден екінші күйге ауысу барысындағы ішкі энергиясының өзгерісі (ΔU) мынаған тең: ΔU=ΔQ-A, мұндағы Q - жүйенің қоршаған ортамен алмасқан жылу мөлшері, А - істелген жұмыс. Жүйе бастапқы күйіне қайтып келетін (U2-U1) кез келген тұйық процесс үшін ішкі энергияның өзгерісі (ΔU) нөлге тең және Q=A (Дөнгелек процесс) . Адиабаттық процесте (қоршаған ортамен жылу алмасу болмаған, яғни Q=0 жағдайда) жүйенің ішкі энергияның өзгерісі жүйенің істеген жұмысына не жүйеге жасалған жұмысқа тең. Ішкі энергияға дененің барлық микробөлшектерінің (молекулалардың, атомдардың, иондардың, т. б. ) ретсіз (хаосты) қозғалыстарының энергиясы, микробөлшектердің өзара әсерлесу энергиясы, атомдар мен молекулалардың ішкі энергиясы, т. б. жатады. Бұл теңдеу жылу алмасу процесі басты рөл атқаратын жүйелердегі энергияның сақталу және айналу заңын (термодинамиканың бірінші бастамасын) өрнектейді. Энергияның сақталу заңына сәйкес ішкі энергия физикалық жүйе күйінің, яғни осы күйді анықтайтын тәуелсіз айнымалылардың (мысалы, температура, көлем не қысым), бір мәнді функциясы болады.
Газдардың кинетикалық теориясы бойынша идеал газдар ішкі энергиясының өзгеруі нәтижесінде, температураға байланысты молекулалардың кинетикалық энергиясы өзгереді. Сондықтан идеал газдың (немесе қасиеттері сол идеал газға жуық газдардың) Ішкі энергиясының өзгерісі тек оның температурасының өзгерісімен анықталады (Джоуль заңы) .
Бөлшектері өзара әсерлесетін физикалық жүйелерде (реал газдарда, сұйықтықтарда, қатты денелерде) молекулааралық және молекула ішіндегі өзара әсер энергиялары да Ішкі энергияға жатады. Мұндай жүйелерде Ішкі энергия температурамен қатар қысым мен көлемге де тәуелді болады. . Q және А шамаларының әрқайсысы жүйені Ішкі энергиясы U1-ге тең күйден U2-ге тең күйге ауыстыратын процестің сипатына тәуелді болады, ал ΔU=U2-U1.
Iшкi энергия туралы түсiнiк.
Макроденелерді механикалық энергиямен қатар, өздерiнiң iштерiне тұйықталған энергияға ие. Ол - iшкi энергия. Ол барлық энергетикалық түрленулердiң балансына кiредi. Механикалық жұмыс жасамай-ақ денелердi қыздырғанда, олардың iшкi энергиясы ұлғаяды.
Iшкi энергияның механикалық энергияға айналуының керi процесi болатыны сөзсiз. Молекулалық-кинетикалық теория көзқарасынан макроскопиялық дененiң iшкi энергиясы барлық молекулалардың ретсiз қозғалыстарының кинетикалық энергиялары мен олардың бiр-бiрiмен өзара әсерiнiң потенциалдық энергияларының қосындысына тең.
МКТ көзқарасы тұрғысынан макроскопиялық денелердің ішкі энергиясы U [Дж] - денені құрайтын бөлшектердің (молекулалардың, атомдардың, электрондардың, т. б. ) хаосты қозғалыстары мен өзара әсерлесуінің энергияларының қосындысы.
Идеал газдың ішкі энергиясы оның молекулаларының тек жылулық қозғалысының кинетикалық энергияларының қосындысы болып табылады, өйткені идеал газ бөлшектерінің өзара әрекетін ескермеуге болады. Идеал газ - молекулалар арасындағы өзара әсер ескерілмейтін газ моделі. Сондықтан идеал газда молекулалардың потенциалдық энергиясы 0-ге тең
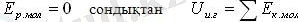
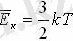 бір атомды идеал газдың молекуласының орташа кинетикалық энергиясын, N-молекуланың санына көбейтіп оның ішкі энергиясын есептеуге болады. Барлық молекулалардың кинетикалық энергиясы бірдей деп есептейміз (орташа кинетикалық энергия)
бір атомды идеал газдың молекуласының орташа кинетикалық энергиясын, N-молекуланың санына көбейтіп оның ішкі энергиясын есептеуге болады. Барлық молекулалардың кинетикалық энергиясы бірдей деп есептейміз (орташа кинетикалық энергия)
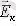
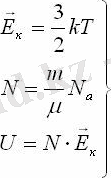
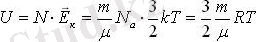
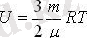
Берілген газ массасы үшін температураның өзгерісінен оның ішкі энергиясы өзгереді
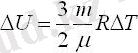
Екі атомды (мысалы, О 2 , H 2 , N 2 ) газдардың ішкі энергиясын анықтайтын формула
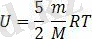
Ішкі энергияның өзгеру тәсілдері: ж ұмыс істеу (А), жылу берілу (Q) .
Жүйенің ішкі энергиясын өзгертуде мәжбүрлеп істелінетін жұмыс
термодинамикадағы жұмыс.
Газбен жұмыс істегенде әруақытта көлемі өзгереді
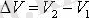
Газдың ұлғаюы
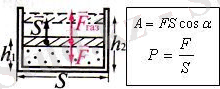
Газдың сығылуы

A- cыртқы
күштердің
жұмысы
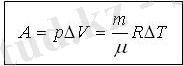
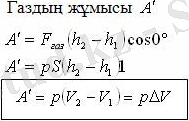
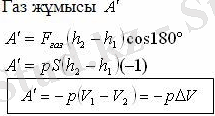
Термодинамикадағы жұмысты Р(V) графигі бойынша анықтау:
Термодинамикадағы
жұмыстың
сан мәні Р(V)
графигі
астындағы
фигураның
S ауда-нына тең
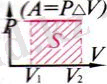
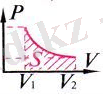
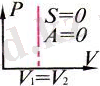
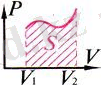
Жылу өткізгіштік - жұмыс істемей дененің ішкі энергиясының өзгеруі (қаттырақ қызған денеден суығырақ денеге жылу берілу) . Жылу мөлшері - жылуалмасу кезіндегі ішкі энергия өзгерісінің өлшемі Q [Дж] .
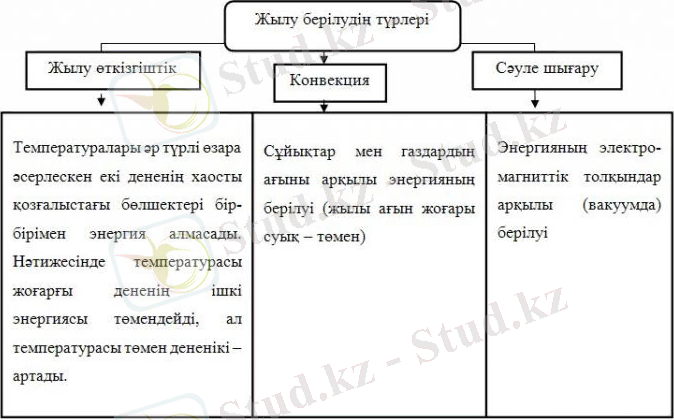
Әр түрлі жылулық процестердегі жылу алмасу арқылы берілген энергияны ж ылу мөлшері деп атайды және ол ішкі энергиянын өзгерісіне тең.
Жылу (суу)
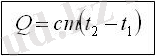
Меншіктік жылу сыйымдылығы
с [Дж/кг·К]
1 кг затты 1 К-ге қыздырғанда
жұтылатын (суытқанда бөлінетін)
жылу мөлшері
Булану
(конденсациялану)
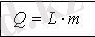
Меншікті булану жылуы
L [Дж/кг]
Қайнау температурадағы
1 кг сұйықтың буға айналғанда
жұтылатын (қатайғанда бөліп
шығаратын) жылу мөлшері
Балқу (қатаю)
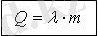
Меншікті балқу жылуы
λ [Дж/кг]
 балқу температурадағы қатты
балқу температурадағы қатты
заттың сұйыққа айналғанда
жұтатын (қатайғанда бөліп шығарылатын) жылу мөлшері
Отынның жану
жылуы
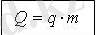
Отынның меншікті
жану жылуы
q [Дж/кг]
Массасы 1 кг отын толық
жанғанда бөлінетін жылу
мөлшерін көрсететін физикалық шама.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz