Жылудинамиканың бірінші және екінші заңдары: идеал газдар, энтропия және жылу алмасу


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
ШӘКӘРІМ АТЫНДАҒЫ СЕМЕЙ МЕМЛЕКЕТТІК УНИВЕРСИТЕТІ
ИНЖЕНЕРЛІК-ТЕХНОЛОГИЯЛЫҚ ФАКУЛЬТЕТІ
(ФАКУЛЬТЕТ АТАУЫ)
«ТЕХНИКАЛЫҚ ФИЗИКА ЖӘНЕ ЖЫЛУЭНЕРГЕТИКА»КАФЕДРАСЫ
(КАФЕДРА АТАУЫ)
МАМАНДЫҚҚА КІРІСПЕ
(ПӘН АТАУЫ)
СӨЖ
(жұмыс түрі)
Жылудинамиканың бірінші және екінші заңы
(жұмыстың тақырыбы)
Орындаған: Жұмақын С
Топ: ТЭ-517
Тексерген: Сейсенбаева М. К
Семей
2015
Мазмұны
Кіріспе2
1. Термодинамикалық жүйе3
1. 1 Жылудинамикалық тепе-теңдік3
2. Идеал газдар3
2. 1. Идеал газ және оның заңдары3
2. 2 Идеал газдың қоспасы4
3. Жылу динамикасының бірінші заңы5
4. Идеал газдардың жылудинамикалық процестер6
5. Жылу динамикасының екінші заңы8
5. 1 Идеал газ энтропиясы8
5. 2 Жылу процесстері9
5. 3 Стефон -Больцман заңы10
Қортынды11
Пайдаланылған әдебиеттер12
Кіріспе
Жылу құбылысы табиғат әлемінде және техниканың әртүрлі саласында ең көп таралған жердегі ең басты энергия көзі күн болып саналады. Күн мен жер арасындағы жылу алмасу арқасында біздің планетамызда өмір сүруге ең қолайлы жағдай жасалған. Күн сәулесі мен жылуы әсерінен өсімдік әлемі өсіп және дамиды. Ал өсімдік адам мен жан-жануар үшін тамақ, бұл әрі киім, отын және құрылыс материалы.
Күн мен жер арасындағы жылу алмасу процесі жел мен бұлттың, жауын мен туманның пайда болуын туғызады, тәулік және жыл бойындағы атмосфера температурасы жер шарының әр жеріндегі ауа-райын, климатын анықтайды.
Техникада жылу құбылысы құрылысы күрделі жылу системасында (қазандық қондырғысы, сораптары бар көп километрге созылған бу-су құбырларымен) елеулі роль атқарады.
Қазіргі кездегі өндіріс орнын және транспортты жылу машиналарсыз елестетуге де болмайды. Мысалы, автомобильдегі трактордегі, тепловоздағы, теплоходтағы, танктегі, экскаватордағы поршенді іштен жану қозғалтқышы олардың энергетикалық «жүрегі» болып саналады. Реактивті қозғалтқыштар көмегімен самолеттер мен ракеталар ұшады. Ал электрстанцияларда үлкен бу машиналары (турбиналары) генератор роторларын қозғалысқа келтіреді.
Металлургия және металл өңдеу өнеркәсіптерінде жылу процесі қара және түсті металл алуда, машина бөлшектерін құюда, оларды өңдеуде аса зор роль атқарады.
Жылу процесі ағаш, тамақ өнімдерін шығаруда, денекерлеу, кесу, металды шынықтыруда оның негізі болып саналады.
Табиғатта жәңе техникада қолданылатын көптеген және әртүрлі жылу процестері жалпы заңдарға бағынады. Бұл заңдарды білу инженерлер мен ғалымдарға әртүрлі маңызы зор мәселелерді шешуде, практикалық есептерді шешуде көмегін тигізеді. Мысалы, бу қондырғыларын жылу электроцтанцияларда есептеу, жылу беру жүйелерін жобалау т. б.
Жылу теориясын білмей құрылыс материалдарын, пластмассаны шығару, көп жылу беретін ядролық реактордың жұмысын басқару, ракеталарды оларға қойылатын приборлар мен күрделі аппараттарды есептеу мүмкін емес.
Адамның әр қадамы жылу процессімен байланысты, сондықтан жылу заңдылықтарын, жылу қондырғылары мен машиналар құрылысымен жұмыс істеу тәртібімен таныс болуы қажет.
1. Термодинамикалық жүйе
Табиғаттың көптеген құбылыстарында бір-бірімен әртүрлі байланыста болатын көптеген денелер қатысады. Жылу және жұмыс түрінде өзді-өзді және айнала ортамен энергия алмасатын материалдық денелердің жиынтығы термодинамикалық жүйе дер аталады. Осы термодинамикалық жүйені таңдау өз пайымдауымызға берілген.
Жылу динамикасы жүйенің қарапайым мысалы ретінде поршень мен цилиндрдің астындағы газды алуға болады. Егер жылу динамикалық жүйе сыртқы ортамен ешқандай байланысы болмаса ондай жүйені тұйықталған немесе тұйық жүйе деп атайды. өзінің көптеген бөліктерінде құрамы және физикалық қасиеті бірдей жүйені физикалық біртекті немесе біркелкі жүйе деп атайды. біртекті жылудинамикалық жүйе, егер олардың ішінде оны бөліп тұратын, бөлу беттері болмаса, онда ондай жүйе галогендік жүйе деп аталады (мысалы, мұз, су, газ) . Олардың арасында бөлу беттері болса гетерогенді жүйе деп аталады. Гетерогенді жүйе бөлу беттері бір-бірімен араласпайтын, әрқайсысының физикалық қасиеті бір макроскопиялық заттардан тұратын жылудинамикалық жүйені айтады (мұз+су, су+су буы) .
1. 1 Жылудинамикалық тепе-теңдік
Жылудинамикалық жүйеге кіретін барлық заттардың күйі ұзақ уақыт өзгермесе онда жүйенің мұндай күйін жылудинамикалық тепе-теңдік деп атайды. жылудинамикалық тепе-теңдік жүйенің заттарының температуралары айналадағы ортаның айналадағы ортаның температуралары
2. Идеал газдар
2. 1. Идеал газ және оның заңдары
Газ (франц. gaz, грек chaos ) деген сөз молекулалары арасында өзара әсер (әрекеттестік) әрекет ету күш жоқ, ал молекулалардың өзі көлемсіз және олар өздерін материалдық нүкьелер ретінде көрсететін газдарды идеал газдар деп атайды.
Жоғарыдағы анықтамалардан, идеал газ бұл модель екенін көреміз және ол жуықтап және оңайлатып (жеңілдетіліп) алынған түрі.
Нақты газдарда молекулалар арасында ілініс күші бар және оның шамасы молекулалар арасы бір-бірінен қашықтаған сайын азая береді, онда заттардың молекулалары бірімен-бірі берік ұстаспайды, мүмкін болған көлемді толтыра бет-бетімен қозғала береді. Кәдімгі қысым мен температурада газ молекулаларының арасындағы орташа қашықтық, сұйықтар және қатты заттардағымен салыстырғанда шамамен 10 есе артық болады, сондықтан газдың тығыздығы әлде қайда кем.
Идеал газдың тығыздығы аз болған сайын, оның дәлдігі соғұрлым жоғары.
Табиғатта идеал газдың жоқтығына қарамай көптеген газдар (ауа, азот, оттегі, көміртегі тотығы, отынның жану продуктері және т. б. ) бөлмелік температурада және бірнеше бар болатын қысымда идеал газ заңына бағынады. Тығыздалған (қоюланған) будың (сұйыққа немесе кристалға айналуын) жағдайындағы газдар мен сұйықтар. Мысалы, кәдімгі температурадағы және қысымдағы суды және су буын идеалдыгазға жатқызуға болмайды.
Идеал газдардың заңдары тәжірибе жүзінде алынған: Бойль-Мариотт 1662 жылы, тұрақты температурада өтетін изотермалын, жылудинамикалық процесте газдың қысымының оның көлеміне көбейтіндісі тұрақты шама PV=const. Еркін жылдамдығы екі идеал газдың тұрақты температурадағы өтетін жылудинамикалық процесіндегі параметрлердің қатынасын мына кескінмен көрсетеді:
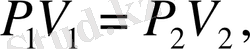 немесе
немесе
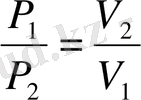 Бойль-Мариотт. (1)
Бойль-Мариотт. (1)
2. 2 Идеал газдың қоспасы
Техникада өздері жеке газдардың қоспасы болып келетін газ тәрізді заттар қолданылады. Жердегі ең кең таралған газ ауа (бұл негізінен азот пен оттегінің қоспасы) . Отынның жануы кезінде жүретін химиялық реакция ауадағы оттегімен тотығады да, пайда болған түтін газдары да қоспа түрінде болады. Бұндай мысалдарды көптеп келтіруге болады.
Газ қоспасы деп бір-бірімен химиялық реакцияға кірмейтін жеке газдар қоспасын айтады. Қоспадағы әр газ басқа газдардан тәуелсіз өзінің бар қасиеттерін сақтайды және ол өзі ғана толтырылған көлемдегі сияқты әсер етеді.
Ыдыстың қабырғасына газдың молекулалары парциалды (құрамдас бөліктері) деп аталатын қысым туғызады. Қоспаға кіретін әр жеке газ, Клапейронның теңдеуіне бағынады, сонымен ол идеал газға жатады. Идеал газдар қоспасы Дальтон заңына бағынады, ол былай дейді:
Газдар қоспасының жалпы қысымы, жеке газдардың құрамдас бөліктерінің қысымдарының қосындысына тең:
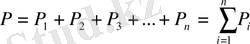 (2)
(2)
мұндағы P 1 , P 2 , P 3 …P n -құрамдас бөліктердің қысымы.
3. Жылу динамикасының бірінші заңы
Жылу динамикасының бірінші заңы М. В. Ломоносов ашқан энергияның сақталу және айналу заңының газға арналған бір түрі болып саналады. Бұл заң материяның, қозғалыстың және күштік жойылмайтының оның бір түрден екінші түрге айналатынын көрсетеді.
Жылу динамикасының бірінші заңы механикалық және жылу энергиясының өзара айналуының ара қатнасын көрсетеді:
Q=L (3)
мұндағы, Q - жұмысқа айналатын жылу мөлшері;
L - Q жылу мөлшерінен алынатын жұмыс.
СИ жүйесінде Q мен L бір өлшеммен Дж алынады.
Энергияның өлшем бірліктері мына қатнаста болады.
1 Дж 0, 102 кгс·м 0, 24 кал
1 Кал 4, 18 Дж 0, 43 кгс·м
1 Дж 2, 39 10 -4 ккал 2, 78 10 -7 кВт ·сағ 0, 74 ft lbg
Қуат 1 Вт 0, 102 кгс·м/с 0, 24 кал/с 1, 36 10 -3 а. к.
1 ат. күші 736 Вт 75 кгс·м/с 175, 5 кал/с 542, 5 ft lbg
Жылу динамикасының бірінші заңын қолдана отырып жылу қоңдырғысының ПӘК табуға болады.
ПӘК - жылудың жұмысқа айналуының жетілу дәрежесін көрсетеді.
Егер 1 кВт/ сағ кететін отын мөлшелері белгілі болса, онда ПӘК-ті
мұндағы, b - отынның меншікті мөлшері, кг/ кВт·сағ
Qт - жылудан алынған жылулық мөлшері, кДж/кг
Кезкелген денеге арналған жылу динамикасының бірінші заңының дифференциалдық түрде алынған аналитикалық кескіні.
dQ = dU + dL (4)
мұндағы, dQ - массасы М, кг жұмысшы денеге сырттан жіберілген жылу мөлшері;
dU - Жұмысшы дененің ішкі энергия өзгерісі;
dL - сыртқы қысымды жеңуге кетірген жұмысшы дененің атқаратын жұмысы (ұлғаю процесінің сыртқы жұмысы)
1 кг кезкелген газдың күйінің өзгерісіне арналған түрі мынадай:
dq = dU + dL (5)
мұндағы dq = pdV онда dq = dU + pdV.
Процестің толық өзгерісін сипаттайтын теңдеу:
Q = ∆U + L (6)
Кезкелген процесс үшін (1кг) газ күйінің кішкентай өзгерісін көрсететін идеал газдың ішкі энергия өзгерісін арналған теңдеу:
dU = C v · dt (7)
Жылу техникасының есебінде көбіне ішкі энергия өзгерісі пайдаланылады. Соңдықтан оның абсолюттік шамасы қарастырылмайды. Сонымен осы теңдеуді интегралдау арқылы мына түрде аламыз:
∆U = C vm (t 2 -t 1 ) (8)
мұндағы, C cm - t 1 - t 2 температуралар арасында массалық орташа жылусыйымдылық.
4. Идеал газдардың жылудинамикалық процестер
Жылудинамикалық процестерге изохоралық, изотермиялық, изобаралық, адиабаттық және политроптық процестер жатады. Жылу техникасында процестерге және олардың есептеуне үлкен көңіл бөлінген. Жылудинамикалық процестердің есептеліуне олардың басындағы және соңыедағы барлық параметрлерін табу, жылулық және жұмыс мөлшерін анықтау және осы процесті P-V жылудинамикалық диаграммада көрсету. Изохоралық процесс тұрақты көлемде жүреді.
Егер изохоралық процесс қыздыру арқылы жүретін болса, онда диаграммада ол 1-2 сызығымен кескінделеді. Ал егер суыту арқылы жүретін болса онда 2-1 сызығымен кескінделеді. Екі жағдайдағы газ үшін. Клапейрон-Менделеев теңдеуін жазып және оны бір-біріне бөліп.
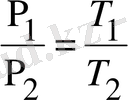 (9)
(9)
теңдеуін аламыз.
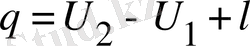 ; (10)
; (10)
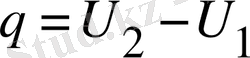 ; (11)
; (11)
мұндағы, l - ; жұмыс. (l=0)
U 2 ,, U 1 - ішкі энергия өзгерісі.
Берілген жылу процесте жылу жүрмегендіктен ол тек ішкі энергияны жылыту үшін қолданылады. Егер ішкі энергия жоқ болса, онда жылу мөлшері
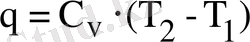 (12)
(12)
формуласымен анықталады.
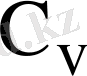 - тұрақты көлемдегі меншікті жылу сиымдылық және она кестеден алады.
- тұрақты көлемдегі меншікті жылу сиымдылық және она кестеден алады.
Егер процесте m кг газ қатысатын болса онда жылу мөлшері:
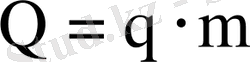 (13)
(13)
Изобаралық процесс тұрақты қысымда жүреді (Р=const) . Еркін түрде алынған екі изобаралық процесс үшін Клапейрон-Менделеев теңдеуін жазып
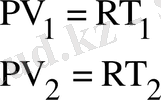 ;
;
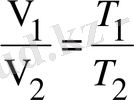 (14)
(14)
Изобаралық процесте жылу беру тек қана газдың ішкі энергиясын өсіру үшін немесе оны салқындату үшін, сығу үшін қолданылады.
Жұмыс:
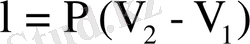 немесе идеал наз үшін
немесе идеал наз үшін
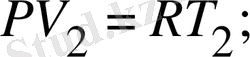
 . (15)
. (15)
Жылу мөлшері:
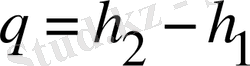 , (16)
, (16)
мұндағы
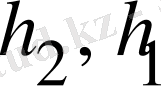 - энтальпиялар шамасы.
- энтальпиялар шамасы.
n кг газ үшін
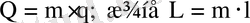 (17)
(17)
Изотермиялық процесс кезінде температура өзгермейді (T=const) . Идеал газдың изотермиялық процесс үшін параметрлер қатынасы мынадай болады: PV=const ;
P
1
V
1
=P
2
V
2
;
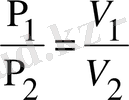 (18)
(18)
Идеал газдың ішкі энергиясы температураға тәуелді болғандықтан, ал изотермиялық процесте ішкі энергия өзгермейді, себебі температура тұрақты, ал берілген жылу жылудинамикасының бірінші заңы бойынша
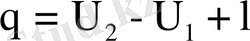 осыдан
осыдан
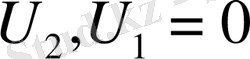 ;
;
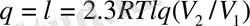 ; (19)
; (19)
5. Жылу динамикасының екінші заңы
Жылу динамикасының 1-заңы энергияның сақталу және айналу заңының бір түрі ретінде болып, жылудың жұмысқа, ал жұмыстың жылуға айналуының осы айналыс мүмкіндіктерінің қандай жағдайда жүретінін сақтамай-ақ бере алады.
1-заң жылу процесінің бағыт-бағдары туралы сұрақты қарастырмайды. Сонымен қатар 1-заң жылу ыстық денеден суық денеге немесе керісінше өте ме, оны шеше алмайды. Жылудың жұмысқа айналуы жылу көзімен оны қабылдаған дене арасында температуралар айырмасы болған шақта жүреді. Бірақ жұмыстан жылу немесе жылудан жұмыс толық мөлшерде алынбайды. Бар жылу, жылу қабылдағыштан алынған түгелімен жұмысқа айналса, ондай қозғалтқышты Кельвинг 2 сатылы мәңгі двигательді құру мүмкін еместігін көрсетті. Жылулық циклді бағалау үшін пайдалы әсер коэффициенті ПӘК деп аталатын критерий алынады:
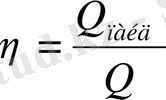 (20)
(20)
Кері циклдың жетлдіру циклын жетлдіру дәрежесін циклдың тоңазыту коэффициентмен анықтайды:
 ε=q
2
/l (21)
ε=q
2
/l (21)
Тоңазыту коэффициенті ыстық жылу кезінен жұмысқа жылудың қандай мөлшері жұмсалатынын көрсетеді.
5. 1 Идеал газ энтропиясы
Энтропия грекше айналу деген сөзден шыққан. Энтропия термодинамикалық жүйенің функциясы. Ол жүйе мен сыртқы ортаның арасында жүретін жылу алмасу прцесінің жүру бағытын сипаттайды. Сонымен қатар тұйық жүйелердің ішінде өздігінен жүретін процестердің жүйелік энтропия айырма мәні:
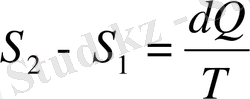 (22)
(22)
мұндағы S 1 , S 2 - екі процестің энтропиялары;
Q- жылу мөлшері;
T- температурасы.
Абсолюттік температура нөлге ұмтылғанда қатты және сұйық отындардың тепе-теңдігі кезінде limS 0, яғни энтропия да нөлге ұмтылады T 0 .
3-термодинамикалық бастау бойынша энтропияның абсолюттік мәні былай табылады:
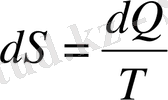 (23)
(23)
Термодинамиканың 3- бастауынан кейбір маңызды қорытындылар туады:
а) абсолюттік нөлге жетпеу мүмкіндігі (жете алмау мүмкіндігі) ;
б) абсолюттік температураның нөлге ұмтылысы кезінде жылусиымдылығы, ұлғаю коэффициентінің (жылулық) және қысымның термиялық коэффициентінің нөлге ұмтылысы.
Термодинамиканың 3-бастауының өте төмен суыте температурасын алуда маңызы зор, ал химияда химиялық тепе-теңдікті есептеуде және т. б. ролі үлкен. Меншікті энтропия процесс күйінің негізгі функциясы болып табылады:
S 1 =f 1 (P 1 T) ; S 2 =f 2 (T 1 V) ; S 3 =f(P 1 V) (24)
мұнда, S- энтропиясы;
f-функциясы.
5. 2 Жылу процесстері
Әртүрлі температудағы денелерде жылу энергиясының бірінен екіншісіне өтуі жылу алмасы процессі деп аталады. Жылу алмасы процесстерінің қозғаушы күші - ыстық және суық денелердің температуларының айырмасы болып табылады. Бұл қозғаушы күштің әсерінен термодинамиканың екінші заңына байланысты жылу ыстық денеден суық денеге өздігінен өтеді. Денелер арсындағы жылу алмасу еркін электрондар, атомдар және молекулалардың өзара энергия алмасуы арқасында болады. Жылу алмасуда қатынасатын денелерді жылу тасымалдағыштар деп атайды.
Жылу өту - жылу тарату процесстері жөніндегі ғылым. Жылу процесстеріне төмендегілер жатады: ысыту, суыту, конденсациялау және буландыру. Көптеген масса алмасу (Мысалы, айдау, суыту, кептіру т. б) және химиялық процесстердің өтуінде бұл процесстердің маңызы үлкен.
Жылу таратудың негізгі үш түрлі тәсілі бар: жылу өткізгіштік, жылулы сәуле шығару конвекция.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz