Фосфор қышқылы мен минералдық тыңайтқыштардың химиялық технологиясы


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ және ҒЫЛЫМ МИНИСТРЛІГІ
СЕМЕЙ қаласының ШӘКӘРІМ атындағы МЕМЛЕКЕТТІК УНИВЕРСИТЕТІ
Химия кафедрасы
БӨЖ №1
Оқу пәні : «Жалпы химиялық технология»
Шифр, мамандық : 5В072000, «Бейорганикалық заттарының химиялық технологиясы»
Орындаған : ХН-301 топ студенті Жұмабек Әдемі
Тексерген : аға оқытушы Лебаева Жеміс Темергалиевна
Семей 2015 ж
Жоспар:
- Фосфор қышқылының (H3PO4) физикалық және химиялық қасиеттері
- Фосфор қышқылын өндірісте және лабораторияда алу
- Фосфор қышқылының қолданылуы
- Суперфосфат
- Азот қышқылын өндіру әдістері
- Азот тыңайтқыштары және классификациясы
- Пайдаланылған әдебиеттер тізімі
Фосфор қышқылы (H 3 PO 4 )
Фосфор қышқылы -
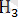 Р
Р
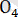 түссіз кристалды, улы емес зат. Суда жақсы ериді. Фосфор қышқылы орташа қышқыл катарына жатады.
түссіз кристалды, улы емес зат. Суда жақсы ериді. Фосфор қышқылы орташа қышқыл катарына жатады.
Фосфор қышқылы суда ерігенде, сатылап диссоциацияланады:
Ортофосфор қышқылының алғашқы сатысына қарағанда келесі сатыларында иондарға ыдырау мүмкіндігі біртіндеп төмендейді. Сондықтан ерітіндіде басқа иондарға қарағанда дигидрофосфат
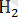 Р
Р
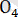 ионы көбірек болады.
ионы көбірек болады.
Химиялық қасиеті:
Фосфор қышқылы тотықтырғыш қасиет көрсетпейді, қышқылдарға тән барлық реакцияларға түседі.
1) Активті металдармен сутек бөле әрекеттеседі:
2Н 3 РО 4 + ЗСа = Са 3 (РО 4 ) 2 + ЗН 2 ↑
2) Негіздік оксидтермен тұз бен су түзеді:
2Н 3 РО 4 + 3MgO = Mg 3 (PО 4 ) 2 + ЗН 2 О
3) Негіздермен тұз бен су түзе әрекеттеседі:
Н 3 РО 4 + 3NaOH = Na 3 PО 4 + 3H 2 О
4) Әлсіз қышқылдардың тұздарымен әрекеттеседі;
2H 3 PО 4 + 3Na 2 S = 2Na 3 PО 4 + 3H 2 S↑
жаңа тұз және жаңа қышқыл түзеді.
Фосфор қышқылының қалдығына (РО 4 3- ) сапалық реакция жасау үшін күміс ионы (Ag + ) қолданылады.
Н 3 РО 4 + 3AgNО 3 = Ag 3 PО 4 ↓+ 3HNО 3
(РО 4 3- + 3Ag + → Ag 3 PО 4 ↓)
Алынуы:
Лабораторияда :
Фосфор (V) оксидін суда еріту арқылы :
Р 2 О 5 + ЗН 2 О = 2Н 3 РО 4
Өнеркесіпте:
Кальций фосфатына күкірт қышкылын қосып қыздыру арқылы алады:
Са 3 (РО 4 ) 2 + 3H 2 SО 4 (конц) = 2Н 3 РО 4 + 3CaSО 4
Фосфор қышқылы үш түрлі тұз түзеді: NaH 2 PО 4 - натрий дигидрофосфаты; Na 2 HPО 4 - натрий гидрофосфаты; Na 3 PО 4 - натрий фосфаты.
Фосфор қышқылының Na, К тұздары - ортофосфаттары, гидро- және дигидрофосфаттары суда жақсы ериді.
Қолданылуы:
Фосфор қышқылы дәрі-дәрмек жасайтын өнеркәсіпте пайдаланылады.
Кальций дигидрофосфаты Са(
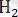 Р
Р
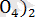 нан пісіруде пайдаланатын және алкогольсіз сусындар алуға арналған ұнтақтар ретінде қолданылады. Ал сілтілік металдардың фосфаттарынан жуғыш заттар алынады. Фосфор қышқылы және оның тұздары көбінесе минералдың тыңайтқыш алуға жүмсалады.
нан пісіруде пайдаланатын және алкогольсіз сусындар алуға арналған ұнтақтар ретінде қолданылады. Ал сілтілік металдардың фосфаттарынан жуғыш заттар алынады. Фосфор қышқылы және оның тұздары көбінесе минералдың тыңайтқыш алуға жүмсалады.
Фосфор (Ү) оксиді ақ түсті, су тартқыш қасиеті бар қатты зат. Ол - қышқылдық оксид. Ортофосфор қышқылы - көпнегізді қышқыл, ол қышқыл және орта тұздар түзеді. Қазақстанда табиғи фосфаттардың ірі бай кен орны бар. Табиғи фосфаттардан фосфор қышқылы мен минералдық тыңайтқыштар алынады.
Фосфор қышқылы суда ерігенде сатылап диссоциацияланады:
Н 3 РО 4 =Н + Н 2 РО 4
дигидрофосфат ион
Н 2 РО 4 =Н + Н РО 4
гидрофосфат ион
НРО 4 =Н + Н РО 4
фосфат ион
Ортофосфор қышқылының алғашкы сатысына қарағанда келесі сатыларында иондарга ыдырау мумкіндігі біртіндеп темендейді. Сондықтан ерігенде баска иондарға қарағанда дигидрофосфат Н 2 РО 4 ~ ионы көбірек болады.
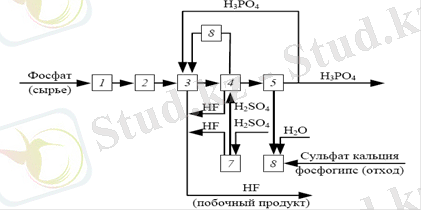
1 - сурет. Фосфор қышқылы өндірісінің принципиалды схемасы:
1 - фосфорды ұсақтау; 2 - байыту (флотация) ; 3 , 4 - химиялық ыдырау; 5 - фосфор қышқылың бөліп алу; 6 - фосфогипсты шаю; 7 - H 2 SO 4 сүйылту; 8 - пульпаны салқындату
Түзілген фосфорлы қышқылдың құрамындағы бір сутегі фосформен, тікелей ал екі сутегі оттегі арқылы байланысқандықтан, ол екі негізді қышқылға жатады және екі қатар тұздар тұзеді:
Н
2
РО
3
Н + NаОН = NаНРО
3
Н + Н
2
О
Н
2
РО
3
Н + 2NaOH = Na
2
PO
3
H + 2 Н
2
О
Осы реакциялардың нәтижесінде тұзілген NaHPO3H натрий гидрофосфиты, ал Na 2 PO 3 H натрий фосфиты деп аталады. Фосфор (V) оксиді ақ түсті, усыз, суда жақсы еріп және онымен әрекеттесіп қышқыл тұзеді. Фосфор (V) оксиді судың температурасына байланысты онымен әрекеттесіп үш түрлі қышқыл түзеді:
Р
2
О
5
+ Н
2
О = 2НРО
3
метафосфор қышқылы
Р
2
О
5
+ 2 Н
2
О = Н
3
Р2О
7
пирофосфоп кышқылы
Р
2
О
5
+ 3 Н
2
О = 2Н
3
РО
4
ортофосфор кышқылы
Бұлардың ішінде ортофосфор қышқылының немесе фосфор қышқылының практикалық маңызы бар. Техникалық мақсаттарға қолданылатын таза емес фосфор қышқылын кальций фосфаты мен күкірт қышқылының әрекеттесуінен алады.
Ca 3 (PO 4 ) 2 + 3H 2 SO 4 = 3CaSO 4 + 2H 3 PO 4
Фосфор қышқылы үш негізді болғандықтан сұдағы ерітіндісінде сатылап иондарға ыдырайды.
H
3
PO
4
↔︎Н+ + Н
2
РО
3
-(К = 7, 6- 10-3)
H
2
PO
4
↔︎H+ + HP04- (К2 = 6, 2- 10-8) НРО*-**Н+ + РО*-(Кз = 4, 4- 10-13)
Үш негізді болғандықтан фосфор қышқылы үш қатар тұздар тү-зеді, мысалы:
КОН + H
3
PO
4
= Н
2
О + ҚН2РО4 (калий дигидрофосфаты)
2КОН + H
3
PO
4
= 2 Н
2
О + К2НРО4(калийгидрофосфаты)
3КОН + H
3
PO
4
= 3 Н
2
О + К3РО4 (калий фосфаты)
Фосфор қышқылының орта тұздарын фосфаттар, ал қышқыл тұздарын дигидрофосфаттар (NaH2PO4) және гидрофосфаттар (Na2HPO4) деп атайды. Дигидрофосфаттардың барлығы дерлік, ал гидрофосфаттар мен фосфаттардан тек сілтілік металдар мен аммоний тұздары ғана суда жақсы ериді. Фосфор ауыл шаруашылық дақылдарынын. дұрыс өсіп - дамуы үшін қажет элемент. Сондықтан фосфор кышқылының тұздары ауыл шаруашылығында тыңайтқыштар ретінде қолданылады.
Табиғи фосфорит пен апатиттың ерімталдығы нашар болғандықтан олар «фосфорит ұны» деген атпен ұнтақ зат түрінде қышқылдығы жоғары топырақтарда пайдаланылады. Табиғи фосфориттерді әр түрлі әдістермен өңдеу арқылы топы-рақтың барлығында жаксы еритін жасанды тыңайтқыштарды өнді-ру химия өнеркәсібінің негізгі міндеттерінің бірі. Аса маңызды жасанды фосфор тыңайтқыштарына жай супер-фосфат, қоссулерфосфат, преципитат, аммофос жатады. Жай суперфосфатты табиғи фосфатқа күкірт кышқылымен әсер ету арқылы алады.
Ca 3 (PO 4 ) 2 + 2H 2 SO 4 = Ca(H2PO4) 2 + 2CaSO4
Сонымен жай суперфосфат кальций Дигидрофосфаты мен кальций сульфатының коспасынан тұрады. Кальций сульфаты өсімдіктерге қажет болмайтындықтан қоспада оның болуы суперфосфаттың құнын кемітеді. Қос суперфосфатты табиғи фосфат пен фосфор қышқылын әре-кеттестіру жолымен алады.
Саз(РО4) 2 + 4 H 3 PO 4 = ЗСа(Н2РО4) 2
Қос суперфосфаттын, құрамында жай суперфосфаттағыдай кальций фосфаты болмайтындықтан ондағы фосфордың мәлшері де екі есеге жуық көп болады. Байытылған суперфосфатты, жай суперфосфаттағы табиғи фосфатты күкірт қышқылымен азот қышқылыныц қоспасы арқылы өн деп, ондағы фосфордың мөлшерін көбейту жолымен алады.
Преципитатты фосфор қышқылын әк суымен немесе әк тасымен нейтралдау аркылы алады:
H
3
PO
4
+ Са(ОН) 2 = СаНРО4-2Н2О
H
3
PO
4
+ СаСО3+Н2О = СаНРО4-2Н2О + СО2
Аммофостарды немесе аммоний фосфаттарын фосфор қышқылы мен аммиактың әр түрлі мөлшерлерін нейтралдау жолымен өндіреді.
H
3
PO
4
+ H3 = Н2РО4 (аммофос)
H
3
PO
4
+ 2NH3=(NH4) 2HPO4 (диаммсфос)
2 H
3
PO
4
+3NH3=NH4H2 PO4+ (NH4) 2HPO4 (аммофос және диаммофос) .
Аммофостар құрамында әрі фосфоры, әрі азоты бар жоғары сапалы тыңайтқыштар.
Тыңайтқыштар - құрамында қоректік элементтер болатын заттар. Өсімдіктердің толық, өсіп-жетілуіне қажет элементті қоректік элемент дейді. Өсімдіктердің өсіп, өнім беруі үшін қажет қоректік элементтердің маңызы ерекше. Фотосинтез кезінде өсімдіктердің жапырағы арқылы және топырақтан алатын химиялық элементтерінің саны 50 шақты.
Ш ығу тегіне қарай органикалық және бейорганикалық тыңайтқыштар деп, ал агрегаттық күйіне қарай тыңайтқыштар қатты (селитра, фосфор тұздары) және сұйық (аммиак суы) болып бөлінеді. Тыңайтқыштар - өсімдіктердің топырақтан қоректенуін жақсарту үшін қолданылатын органикалық және минералдық заттар. Тыңайтқыштарды дұрыс пайдаланғанда ауыл шаруашылық дақылдарының түсімі артады, өнім сапасы жақсарады.
Елімізде өсірілетін алуан түрлі ауыл шаруашылығы дақылдарынан мол, тұрақты, әрі сапалы өнім алуда басқа да агротехникалық шаралармен қатар, тыңайтуды дұрыс ұйымдастырудың маңызы орасан зор.
Ауыл шаруашылығы практикасында егіншілікті химияландыру, оны жедел дамытудың куатты факторы екенін сенімді дәлелдеп берді. Мысалы, азотты тыңайтқыш астық дәніндегі белок мөлшерін арттырады, фосфорлы тыңайтқыш зығыр талшығының сапасын жақсартады, зығыр, күнбағыс тағы басқа дақылдар тұқымындағы май мөлшерін көбейтеді. Калий тыңайтқышы кант қызылшасы тамырының қант, картоптың крахмал мөлшерін арттырады.
Топырақтағы өсімдікке қоректік элементтердің көпшілігі өсімдік сіңіре алмайтын қосылыс түрінде, мәселен, 1 гектар күлгін және қара топырақта 3 . . . 100 тонна азот қоры бар, осының 1 проценттейі ғана өсімдікке сіңімді түрде болады. Еліміздің әр түрлі топырақтары өзінің физикалық, химиялық қасиеттері, құнарлығы және жалпы энергиясы жағынан үш класқа бөлінеді: бірінші, екінші класқа қара топырақтар, үшінші класқа сұр топырақтар жатады.
Түрлі аймақтардағы климаттың, топырақ түзілген аналық тау жынысының, өсімдіктердің ерекшеліктеріне байланысты әрбір топырақтарда қарашірік мөлшері де түрліше болады. Бір гектар қара топырақтың 0-20 см қабатында қарашірік қоры 90 . . . 140 тонна, 0-100-см қабатында 250 . . . 550 тонна болса, сұр топырақтардың жоғарыда аталған қабаттарында қарашірік қоры 30 . . . 80 тоннадай болады.
Сұр топырақ құрамындағы қарашіріктің қоры жағынан қара топырақтарға қарағанда кедей болуына қарамастан, құрамындағы микроорганизмдердің саны жағынан қара топырақтағы микроорганизмдерден анағұрлым артық болады. Мәселен, 1 грамм сұр топырақтарда - 218, 5 млн микроорганизм болса, қара топырақ¬тарда тек қана 57, 4 млн микроорганизмдер бар. Мұның өзі сұр топырақтардағы әртүрлі биологиялық, физикалық және химиялық жұмыстарының белсенділігінің артуына және дақылдардың өнімін молайтуға жағдай жасайды. Жүргізілген зерттеулердін нәтижесінде топырақтағы негізгі минералдық қоректік заттар - азот, фосфор, калий т. б. тыңайтқыштардың өсімдікке әсер етуі арасында белгілі бір байланыс бар екені анықталады. Егер топырақта өсімдікке сіңімді фосфор көп болса, фосфор тыңайтқыштарын енгізуден егіннің түсімі онша артпайды. Мәселен, күздік қара бидай мен күздік бидай көктемде қыстан әлсіреп шығады. Осы кезде өсімдікке қоректік элементтер өте қажет, бірақ топырақта өсімдікке сіңімді азот жетіспейді, өйткені күзде жаңбыр суы нитраттарды топырақтың терең қабатына жуып әкетеді, ал нитрлеуші бактериялар әрекеті ерте көктемдегі салқын әсерінен баяулайды. Жаздық дәнді дақылдарды себу кезінде және олардың өсуінің алғашқы кезеңінде де топырақта өсімдікке сіңімді азот мөлшері жеткіліксіз болады, сондықтан осы кезде тынайтқыш, әсіресе, азот тыңайтқыштарын енгізгенде (күздік дақылдарды көктемде үстеп қоректендіру, жаздық дақылдар тұқымын тыңайтқыш қосып себу) өсімдік тез және жақсы өседі. Егер топырақта қажетті элементтердің біреуі жетіспесе, өсімдікке екінші элементті тиімді пайдалануға мүмкіндік болмайды, соның салдарынан өсімдік нашар жетіледі және егін түсімі кемиді. Дақылдардың қоректік заттарды пайдалануы екі топқа бөлінеді. Олар: 1) минералдық тыңайтқыштарды аз мөлшерде кажет ететін масақты дәнді дақылдар - жаздық және күздік бидай, арпа, сұлы т. б. 2) минералдық тыңайтқыштарды көп кажет ететін техникалық дакылдар - мақта, қант қызылшасы, картоп, көкөніс және жоғары өнімді дәнді дақылдар - күріш, жүгері. Құрамына қарай тыңайтқыштар органикалық, минералдық, органикалық-минералдық және бактериялық тыңайтқыштар болып жіктеледі.
Азот тыңайтқышы.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz