Атом құрылысы: Резерфорд тәжірибелері, Ритц комбинациялық принципі және Бор-Зоммерфельдтің квантталу ережелері


Шәкәрім атындағы Семей мемлекеттік университеті.
СӨЖ
Тақырыбы: Резерфорд тәжірибелері. Ритцтің комбинациялық принципі. Бор-Зоммерфольдтің квантталу ережелері.
Орындаған: Сартбаева Т. Қ
Тобы: Т-323
Тексерген: Мешетова Ж. С
Семей 2015
Жоспар:
- Кіріспе
- Негізгі бөлім
- Резерфорд тәжірбиесі
- Ритцтің комбинациялық принципі.
- Бор-Зоммерфольдтің квантталу ережелері.
- Қорытынды
- Пайданған әдебиеттер тізімі
Кіріспе
Қазіргі кезде біз атомның оң зарядталған ядродан және сол ядроны айнала қозғалатын теріс зарядталған электроннан тұратынын жақсы білеміз. Электрон теріс зарядталған бөлшек. Ядроның заряды оң. Ол +eZ- ке тең, мұндағы е -электрон зарядының шамасы, z - Менделеев кестесіндегі элементтің (реттік) атомдық нөмірі.
Барлық заттар бөлiнбейтiн аса ұсақ бөлшектерден - атомдардан тұрады деген ұғым ерте қалыптасқан болатын. Егер атом шындығында заттың бөлiнбейтiн алғашқы кiрпiштерi болса табиғаттағы кездесетiн сан алуан заттарға сан алуан атомдар сәйкес қойылуы тиiс. Бұлай болуы бiр жағынан күмән туғызады.
Физика ғылымының дамуы барысында ХIХ ғасырдың аяғына қарата атомның қасиеттерiне байланысты жаңа тәжiрибелiк деректер жинала бастады. Мысалы М. Фарадей 1833 жылы электролиз құбылысын зерттеу барысында электролит ертiндiлерiндегi ток иондардың реттелген қозғалысы екенiн анықтады. Ал 1897 жылы Дж. Томсон сиретiлген газдардағы электр разрядын зерттеу барысында қыздырылған немесе ультракүлгiн жарықпен сәулелендiрiлген кез-келген химиялық элементтiң атомы өзiнен терiс зарядталған бөлшектердi шығатынын анықтады. Осылай алғашқы элементар бөлшек - электрон ашылды. Атом құрлысының күрделiлiгiне нұсқайтын тағы бiр бұлтартпас факт 1869 жылы орыс ғалымы Д. И. Менделеев ашқан химиядық элементтердiң периодтылық заңы. Атомдық масса өскен кезде элементтердiң қасиеттерiнiң қайталануын атомның құрамына кiретiн бөлшектердiң саны өскен кезде оның iшкi құрылымының қандай да бiр ерекшелiгiнiң қайталануымен түсiндiруге болатындай.
Резерфорд тәжірибелері. Ритцтің комбинациялық принципі. Бор-Зоммерфольдтің квантталу ережелері.
Резерфорд тәжірибелері.
Атомның алғашқы үлгілерінің бірін Дж. Томсон ұсынды. Бұл үлгіде атом радиусы ~10 −10 К) м оң зарядталған шар ретінде қарастырылады. Шардың ішінде тепе-теңдік жағдайының маңында электрондар тербеліп тұрады. Электрондардың теріс зарядтарының қосындысы шарға біркелкі таралған оң зарядтытеңестіреді, сондықтан тұтас алғанда атом электрлік бейтарап бөлшек болады. Кейінгі зерттеулер бұл модельдің дұрыс емес екенін көрсетті, сондықтан Томсон моделі қазір тек тарихи тұрғыдан қарастырылады.
Атомның ішінде электр зарядтарының орналасу тәртібін анықтау үшін 1911 жылы Резерфорд өзінің шекірттері Г. Гейгер және Э . Марсденмен бірге альфа-бөлшектер шоғын өте жұқа алтын фольгадан өткізіп, бірнеше тәжірибелер жасады. Осы тәжірибелерді зерделеу нәтижесінде атомның ядролық, басқаша айтсақ, планетарлық моделі өмірге келді.
Тәжірибенің нәтижесінде альфа-бөлшектердің басым көпшілігі фольгадан өткенде алғашқы бағыттан aуытқымайтыны (φ≈1-2°) анықталды. Бұл нәтиже, негізінен, Томсон моделіне сүйеніп жасалған есептеулермен дәл келді. Бірақ, альфа- бөлшектердің мардымсыз аз бөлігі 90°-тан артық бұрышқаауытқитыны, яғни олар фольгаға соғылып, кері бағытта ұшатыны таңдандырды. Сегіз мыңға жуық бөлшектердің біреуі ғана осындай үлкен бұрышқа ауытқиды екен! Мұны Томсон моделі негізінде түсіндіру тіпті мүмкін болмады.
Тәжірибеде алынған нәтижелерді зерделей отырып Резерфорд өз моделін ұсынды. Ол атомның оң заряды оның ортасында орналасқан радиусы шамамен 10 −15 м өте аз көлемге жинақталған деген қорытындыға келді. Бұл орталық бөлшекті Резерфорд ядро деп атады. Атомның массасы түгел дерлік ядрода шоғырланған. Ядроны айнала әр түрлі орбиталармен электрондар қозғалып жүреді. Ең шеткі электрон орбитасының радиусы атомның радиусына тең, R a ≈10 −10 м. Бұл үлгі Күн жүйесінің құрылымына ұқсайтын болғандықтан, оны атомның планетарлық моделі деп те атайды. Модель бойынша атом көлемінің басым көпшілік бөлігі "бос" болып шығады, ядроның радиусы атомның радиусынан 100 000 есе кіші. Орбиталардағы электрондардың теріс зарядтарының қосындысы ядроның оң зарядына тең, атом электрлік бейтарап.
Атомның ішіндегі бос кеңістік "өте үлкен". Сондықтан, фольга арқылы өткенде альфа-бөлшектерінің көбі ядродан алыс өтеді де, шашырамайды. Электрондар альфа-бөлшектен 8 мың еседей жеңіл болғандықтан, оның қозғалыс траекториясын өзгерте алмайды. Тек ядроға тікелей қарсы келіп қалған альфа-бөлшектер ғана онымен әсерлесіп, кері ұшады. Мұндай бөлшектер саны ядро радиусының атом радиусына қатынасымен анықталады.
Жоғарыда біз тәжірибеге тек сапалық талдау жүргіздік. Резерфорд сонымен қатар өз моделінің және Томсон моделінің негізшде есептеу жұмыстарын жүргізді , олардың нәтижесі Резерфорд үлгісінің дұрыстығын көрсетті. Бірақ классикалық физика тұрғысынан мұндай атомның орнықты болуы мүмкін емес. Бұдан бұрын айтылғандай, зарядталған бөлшек үдемелі қозғалса, міндетті түрде сәулеленуі (электромагниттік толқындар шығаруы) керек. Бұл сәулеленудің жиілігі электронның ядро маңында айналу жиілігіне тең болуы тиіс. Электрон ядроны айнала дөңгелек орбитамен қозғалса, оның центрге тартқыш үдеуі бар. Олай болса, электрон сәуле шығара отырып, өз энергиясын азайтуы тиіс. Энергияның (орбиталық жылдамдықтың) азаюы электронның ядроға кулон күшінің әсерінен біртіндеп жақындап, ақыры оған құлап түсуіне әкеп соғады. Бұған бар болғаны 10 −8 с-ка тең уақыт кетеді екен және классикалық теория бойынша мұндай атомның сәулелену спектрі тұтас болу керек, ал шын мәнінде атомдық спектрдің сызықтық болатынын алдыңғытақырыпта айтып кеттік.
Сайып келгенде, бұл жерде классикалық физиканың заңдары жүрмейтін болып шықты. Тіпті жоғарыда әңгіме болған атомның планетарлық моделі, дәл айтқанда ол бар болғаны нағыз атомның механикалық үлгісі екеніне біртіндеп көзіміз жетеді
Алайда мұндай моделді біз бірден құра алғанымыз жоқ. Атом құрылысының моделін жасаушылардың бәрі бірдей табысқа жеткен жоқ. Солардың бірі ағылшын ғалымы Дж. Томсон еді. М. Фарадей 1833 жылы электролиз құбылысын зерттеу барысында электролит ертiндiлерiндегi ток иондардың реттелген қозғалысы екенiн анықтады. Ал 1897 жылы Дж. Томсон сиретiлген газдардағы электр разрядын зерттеу барысында қыздырылған немесе ультракүлгiн жарықпен сәулелендiрiлген кез-келген химиялық элементтiң атомы өзiнен терiс зарядталған бөлшектердi шығатынын анықтады. Осылай алғашқы элементар бөлшек - электрон ашылды. Атом құрлысының күрделiлiгiне нұсқайтын тағы бiр бұлтартпас факт 1869 жылы орыс ғалымы Д. И. Менделеев ашқан химиядық элементтердiң периодтылық заңы. Атомдық масса өскен кезде элементтердiң қасиеттерiнiң қайталануын атомның құрамына кiретiн бөлшектердiң саны өскен кезде оның iшкi құрылымының қандай да бiр ерекшелiгiнiң қайталануымен түсiндiруге болатындай.
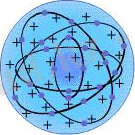
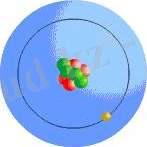
1. 1 - сурет - Томсон моделі 1. 2 - сурет -Резерфорд моделі
Атомды күрделi жүйе деп ұйғарып, оның алғашқы моделiн ұсынған ғалым - Дж. Томсон. Томсон моделi бойынша атом дегенiмiз радиусы шамамен 10 -10 м болатын шар. Бұл шардың бүкiл көлемi оң зарядталған, ал терiс зарядталған электрондар оның iшiнде су тамшысының iшiнде жүзiп жүрген түйiршiктер тәрiздi қозғалып жүредi (1. 1 - сурет) . Томсон моделi атомның бiрқатар қарапайым қасиеттерiн сәттi түсiндiргенiмен көп жағдайда қиыншылыққа тiрелетiн.
Ал, 1911 жылы ағылшын физигі Резерфорд атомның ядролық моделін ұсынды. Ол өз тәжiрибелерiнде аса шапшаң α-бөлшектер жұқа алтын фольгадан шашыраған кездегi бұрыштық таралуын зерттей келе атомның планетарлық моделi деп аталатын моделiн ұсынды. Резерфордтың бұл моделi бойынша атомдағы оң зарядтар Томсон моделiндегiдей бүкiл көлемде таралмай, керiсiнше, оның орталығында жинақталады. Оны атом ядросы деп атайды.
Ал электрондар болса Күн жүйесiндегi планеталар тәрiздi ядроны айнала қозғалып жүредi (1. 2 - сурет) . Электрондардың массасы аса аз болғандықтан атомның бүкiлдей дерлiк массасы ядрода шоғырланған. Ядроның өлшемi атомның өлшемiмен салыстырғанда шамамен 10 5 еседей кiшi.
Ритцтің комбинациялық принципі.
1908 ж. В. Ритц (нем. ) денелердің сәулені шығару және жұту спектрлерінің эксперименттік деректерін біріктіріп, комбинациялық принципті тұжырымдады. Атом спектріндегі барлық сызықтар спектрлік термдер деп аталатын шамалардың қандай да бір сандарының комбинациясы ретінде беріле алады. Термдердің барлық комбинациясы орындала бермейді. Рұқсат етілген және рұқсат етілмеген комб-цияларды айрықшалайтын сұрыптау ережелері (правила отбора) болады. Атомның планетарлық моделіне сәйкес, ядро өрісіндегі эл-ронның сәуле шығаруы үздіксіз болу керек. Яғни, сутегі атомының спектрі планетерлық теория б-ша үздіксіз б/у к/к, ал эксперимент б-ша ол үзікті болған. Бұл қайшылық, атом ядросының бар болуының эксперименттік дәлелімен бірге Бор теориясының құрылуына себеп болды.
Формулаларды қорытқанда әдтте атом ядросы қозғалмайды деп есептейді, демек ол оынң массасының шексіз үлкен екендігін білдіреді. Алайда, ядроның массасы электрон массасынан 3 орынға артық болғанымен, дәл есептеулер кезінде ядроның массасын шексіз деп санауға болмайды. Кванттық механикада сутегі атомын қарастырғанда, ядроның массасы шексіз деп болжайды. Шындығында бұл олай емес, сонда, ядроның массасының шектілігін ескергенде, энергия деңгейлеріне түзетулер енгізіледі. Ол Ридберг тұрақтысымен салыстырғанда әрине өте аз өте аз, бірақ нөлден өзгеше болады. Изотоптар үшін бұл түзетулердің айырмасы изотоптық ығысуды береді.
Бор-Зоммерфольдтің квантталу ережелері.
Резерфорд ұсынған модельге сәйкес атомның +Ze заряды бар өте кішкене, бірақ ауыр ядросы, оның төңірегінде z электрон болады. Бірақ атомның ядролық (планетарлық моделі) классикалық физика заңдары тұрғысынан орнықсыз. Өйткені классикалық электродинамика заңдарына сәйкес:
1. Үдемелі қозғалатын зарядталған бөлшек (электрон) электромагниттік энергияны (жарық) үздіксіз шығаруға тиіс.
2. Осы жарықтың жиілігі электронның ядроны айналу жиілігіне тең болуы керек.
Демек, осы модельге сәйкес атомның толық энергиясы үздіксіз кеми беруге, ал айналу жиілігі үздіксіз арта беруге тиіс. осы жағдайда өте аз уақыт ішінде (10 -8 с) электрон ядроға құлап, атом өз өмірін сүруін тоқтататындығын есептеп, көз жеткізугеболады. осы тұйыққа тірелуден шығу жолын 1913 ж. дания физигі Нильс Бор тапты. Бор өзінің жорамалдарын 2 постулат түрінде ұсынды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz