Идеал газдың заңдары және термодинамикалық процестер


Мазмұны
Кіріспе3
1 Идеал газ және оның заңдары4
1. 1 Идеал газ4
1. 2 Авогадро заңы4
1. 3 Клапейрон заңы5
1. 4 Идеал газ күйінің теңдеуі5
1. 5 Дальтон заңы5
1. 6 Идеал газдың қоспасы5
1. 7 Газ қоспасының жылусыйымдылығы6
2 Термодинамикалық процесстер8
2. 1 Изохоралық процесс8
2. 2 Изобаралық процесс9
2. 3 Изотермиялық процесс10
2. 4 Адиабаталық процесс10
2. 5 Политропты процесс11
Қорытынды13
Пайдаланылған әдебиеттер14
Макроәлем мен микроәлемнің арасындағы сандық байланысты табу үшін мәселені барынша ықшамдауымыз керек. Әр түрлі газдардың молекулалары бір-бірінен өлшемдері мен массалары және түрліше қосылыстары бойынша да ерекшеленеді. Сонымен қатар әр түрлі газдар молекулаларының арасындағы өзара әрекеттесу күштерімен ерекшеленеді. Егер осы факторлардың барлығын ескерсек, онда алға қойған мақсатымыз шым-шытырық болып кетеді. Сондықтан есептеулерді жеңілдету үшін молекулалы-кинетикалық теорияда нақты газдардың қарапайым физикалық моделі - идеал газ моделі енгізілді. Мұндай газ жоқ, бірақ макро және микроәлемдер арасындағы байланысты тағайындау үшін ол бізге қажет, сонымен қатар идеал газ нақты газдың ең көрнекі, сипатты деген қасиеттеріне ие болуы тиіс.
Идеал газ дегеніміз - молекулалары шексіз аз көлем алатын серпімді шариктер болып табылатын және өзара әрекеттесуі тек олардың бір-бірімен тікелей немесе ыдыстың қабырғасымен соқтығысуы кезінде ғана білінетін газ болып табылады.
Соқтығысулар аралығында молекулалар инерциямен қозғалады. Молекулалардың бір-бірімен және өзі тұрған ыдыстың қабырғаларымен соқтығулары серпімді соқтығысу заңдары бойынша есептеледі.
Макродененің күйі мен ондағы микробөлшектердің қасиеттерінің арасындағы байланысты газдың өзі тұрған ыдыстың қабырғаларына түсіретін орташа қысымын есептеу арқылы тағайындау тиімді.
1 Идеал газ және оның заңдары 1. 1 Идеал газГаз (франц. gaz, грек chaos ) деген сөз молекулалары арасында өзара әсер (әрекеттестік) әрекет ету күш жоқ, ал молекулалардың өзі көлемсіз және олар өздерін материалдық нүктелер ретінде көрсететін газдарды идеал газдар деп атайды.
Жоғарыдағы анықтамалардан, идеал газ бұл модель екенін көреміз және ол жуықтап және оңайлатып (жеңілдетіліп) алынған түрі.
Нақты газдарда молекулалар арасында ілініс күші бар және оның шамасы молекулалар арасы бір-бірінен қашықтаған сайын азая береді, онда заттардың молекулалары бірімен-бірі берік ұстаспайды, мүмкін болған көлемді толтыра бет-бетімен қозғала береді. Кәдімгі қысым мен температурада газ молекулаларының арасындағы орташа қашықтық, сұйықтар және қатты заттардағымен салыстырғанда шамамен 10 есе артық болады, сондықтан газдың тығыздығы әлде қайда кем.
Идеал газдың тығыздығы аз болған сайын, оның дәлдігі соғұрлым жоғары.
Табиғатта идеал газдың жоқтығына қарамай көптеген газдар (ауа, азот, оттегі, көміртегі тотығы, отынның жану продуктері және т. б. ) бөлмелік температурада және бірнеше бар болатын қысымда идеал газ заңына бағынады. Тығыздалған (қоюланған) будың (сұйыққа немесе кристалға айналуын) жағдайындағы газдар мен сұйықтар. Мысалы, кәдімгі температурадағы және қысымдағы суды және су буын идеалдыгазға жатқызуға болмайды.
Идеал газдардың заңдары тәжірибе жүзінде алынған: Бойль-Мариотт 1662 жылы, тұрақты температурада өтетін изотермалын, жылудинамикалық процесте газдың қысымының оның көлеміне көбейтіндісі тұрақты шама PV=const. Еркін жылдамдығы екі идеал газдың тұрақты температурадағы өтетін жылудинамикалық процесіндегі параметрлердің қатынасын мына кескінмен көрсетеді:
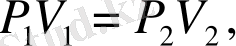 немесе
немесе
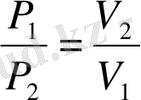 (1. 1. 1)
(1. 1. 1)
Температуралары және қысымдары бірдей кез-келген газдардың бір молінің көлемдері де бірдей болады.
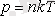 (1. 2. 1)
(1. 2. 1)
1834 жылы француз ғалымы Клапейрон Бойль-Мариот және Гей-Люссак заңдарын біріктіре отырып, (р, Т, V) параметрлерінің үшеуі де өзгергенде жүретін процестерді сипаттайтын теңдеуді алды. Бұл теңдеу Клапейрон теңдеуі деп аталады.
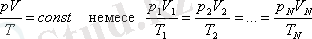 (1. 3. 1)
(1. 3. 1)
Орыс ғалымы Д. И. Менделеев Клайперон және Авогадро заңдарын біріктіре отырып идеал газ күйінің теңдеуін алды:
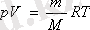 (1. 4. 1)
(1. 4. 1)
мұндағы: R-универсал газ тұрақтысы, R= 8, 31 Дж/(моль·К) .
Бұл теңдеу кейде Менделеев-Клапейрон теңдеуі деп аталады.
1. 5 Дальтон заңыҚоспа газдардың қысымы Дальтон заңының көмегімен анықталады:
Қоспа газдардың қысымы қоспаны құрайтын жеке газдардың парциаль қысымдарының қосындысына тең болады:
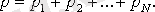 (1. 5. 1)
(1. 5. 1)
Парциаль қысым деп қоспадағы басқа газдардың қысымын ескермеген жағдайдағы жеке газдардың түсіретін қысымын айтады.
1. 6 Идеал газдың қоспасыТехникада өздері жеке газдардың қоспасы болып келетін газ тәрізді заттар қолданылады. Жердегі ең кең таралған газ ауа (бұл негізінен азот пен оттегінің қоспасы) . Отынның жануы кезінде жүретін химиялық реакция ауадағы оттегімен тотығады да, пайда болған түтін газдары да қоспа түрінде болады. Бұндай мысалдарды көптеп келтіруге болады.
Домнадағы газ, қазандықтан іштен жану двигателінен, реактивті двигателінен және басқа жылу қондырғыларынан шығар газдар да жоғарыда айтылған мысалға жатады.
Газ қоспасы деп бір-бірімен химиялық реакцияға кірмейтін жеке газдар қоспасын айтады. Қоспадағы әр газ басқа газдардан тәуелсіз өзінің бар қасиеттерін сақтайды және ол өзі ғана толтырылған көлемдегі сияқты әсер етеді.
Ыдыстың қабырғасына газдың молекулалары парциалды (құрамдас бөліктері) деп аталатын қысым туғызады. Қоспаға кіретін әр жеке газ, Клапейронның теңдеуіне бағынады, сонымен ол идеал газға жатады. Идеал газдар қоспасы Дальтон заңына бағынады, ол былай дейді:
Газдар қоспасының жалпы қысымы, жеке газдардың құрамдас бөліктерінің қысымдарының қосындысына тең:
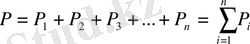 (1. 6. 1)
(1. 6. 1)
мұндағы P 1 , P 2 , P 3 …P n -құрамдас бөліктердің қысымы.
1. 7 Газ қоспасының жылусыйымдылығыДененің температурасын 1 0 С өзгерту үшін, берілетін немесе одан алынатын жылу мөлшерін жылусыйымдылық деп атайды.
Си жүйесінде энергия мөлшерінің өлшем бірлігі ретінде Дж алынады. Си жүйесінде джоуль барлық энергияларды: жылу, механикалық, сәулелік және т. б. энергияларды өлшеуге қолданылатын универсалді өлшем бірлік болып табылады. Жылулық өлшем бірлігі ретінде 1 Дж механикалық жұмысты жылуға айналдыру мөлшері алынады. Механикалық энергия өлшемі түрінде Джоуль 1Н күшпен денені 1 м қашықтыққа қозғалтатын жұмыс шамасы (1 Дж=Нм=1 кгм 2 /с 2 ) алынады.
Жылусыйымдылықтың зат мөлшеріне қатынасын меншікті жылусыйымдылық деп атайды. Меншікті жылусыйымдылықтың мынадай түрлері бар: массалық с кДж/кг*к; көлемдік с
I
, кДж/м
3
к; молдік
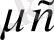 кДж/(кмоль·К) . Олардың арасындағы байланыс мынадай:
кДж/(кмоль·К) . Олардың арасындағы байланыс мынадай:
 (1. 7. 1)
(1. 7. 1)
Жылусыйымдылық жылудың берілу және әкетілу түрінен тәуелді. Тұрақты қысымдағы жылусыйымдылық- изобаралық с р -деп, ал тұрақты көлемдегі жылусыйымдылық- изохоралық с v деп ажыратылады. Бұл жылусыйымдылықтардың өзара байланысын Майер теңдеуі көрсетеді:
c p =c v +R (1. 7. 2)
мұндағы-R -газ тұрақтысы, кДж/кг∙к.
Жылусыйымдылықтардың қатынасы адиабат көрсеткіші деп аталады.
с р /с v =К (1. 7. 3)
Изохоралық процесте берілетін жылу тек газды ішкі энергиясын өзгертуге жұмсалады, ал изобаралық процесте ол жылу жұмыс жасау үшін де жұмсалады. Сондықтан с р >с v . Идеал газдың жылусыйымдылығы температурадан тәуелді. Бұл белгілері бойынша нақтылы және орташа жылусыйымдылықтар болып ажыратылады. Температураның шексіз аз өзгеруіне сәйкес келетін жылусыйымдылықты нақты жылусыйымдылық деп атайды. c=dq/dT . Температраның Т 1 -ден Т 2 -ге өзгеруіне сәйкес жылусыйымдылықты орташа жылусыйымдылық деп атайды.
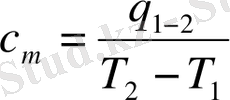 (1. 7. 4)
(1. 7. 4)
Идеал газдардың жылусыйымдылығы температурадан ғана емес сонымен қатар газдардың атомдар санына және процестің түріне де тәуелді.
Нақты газдардың жылусыйымдылығы олардың табиғи қасиеттерінен, температурасы мен қысымынан да тәуелді.
Газдар үшін жылыту және суыту кезіндегі тұрақты көлемдегі және тұрақты қысымдағы газ күйінің өзгерістері ерекше ескеріледі:
Тұрақты көлемдегі және қысымдағы мольдік жылусыйымдылықтардың арасында мынадай тәуелділік байқалады:
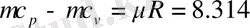 кДж/кмоль∙К. (1. 7. 5)
кДж/кмоль∙К. (1. 7. 5)
Бір атомды газдар үшін к=1. 67 , екі атомды газдар үшін к=1. 4 6 ал үш және көп атомды газдар үшін к=1. 29 .
Газ қоспалары үшін алынған жылусыйымдылық массалық:
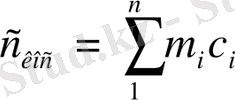 (1. 7. 6)
(1. 7. 6)
көлемдік:
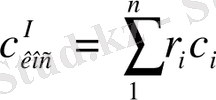 (1. 7. 7)
(1. 7. 7)
молдік:
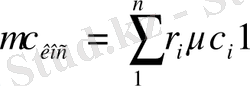 (1. 7. 8)
(1. 7. 8)
Термодинамикалық процесс деп қарастырылатын термодинамикалық жүйенің параметрлерінің өзгеруімен сипатталатын жүйенің күйінің өзгеруін айтады.
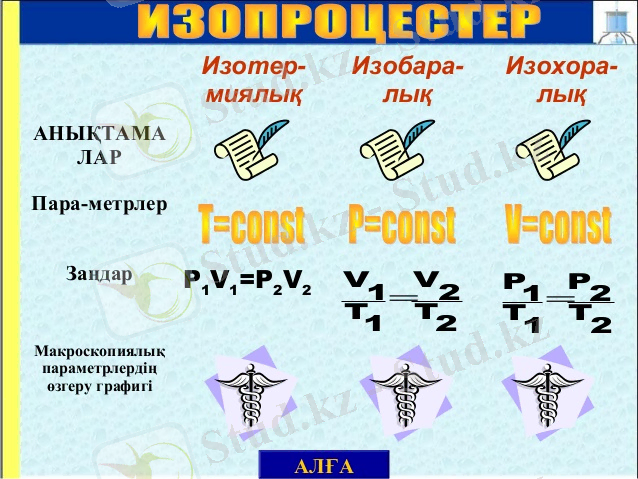
Сур. 1. Изопроцестер
Жылудинамикалық процестерге изохоралық, изотермиялық, изобаралық, адиабаттық және политроптық процестер жатады. Жылу техникасында процестерге және олардың есептеуіне үлкен көңіл бөлінген. Жылудинамикалық процестердің есептеліуне олардың басындағы және соңыедағы барлық параметрлерін табу, жылулық және жұмыс мөлшерін анықтау және осы процесті P-V жылудинамикалық диаграммада көрсету. Изохоралық процесс тұрақты көлемде жүреді.
Егер изохоралық процесс қыздыру арқылы жүретін болса, онда диаграммада ол 1-2 сызығымен кескінделеді. Ал егер суыту арқылы жүретін болса онда 2-1 сызығымен кескінделеді. Екі жағдайдағы газ үшін. Клапейрон-Менделеев теңдеуін жазып және оны бір-біріне бөліп.
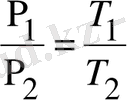 (2. 1. 1)
(2. 1. 1)
теңдеуін аламыз.
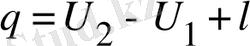 ; (2. 1. 2)
; (2. 1. 2)
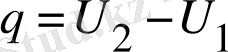 ; (2. 1. 3)
; (2. 1. 3)
мұндағы, l - ; жұмыс. (l=0) ; U 2 ,, U 1 - ішкі энергия өзгерісі.
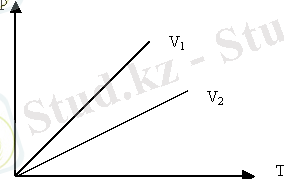
Сур. 2. Изохоралық процесс
Изохоралық процесті сипаттайтын графикті изохора деп атайды. Графикте V 1 <V 2 .
Берілген жылу процесте жылу жүрмегендіктен ол тек ішкі энергияны жылыту үшін қолданылады. Егер ішкі энергия жоқ болса, онда жылу мөлшері:
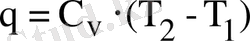 (2. 1. 4)
(2. 1. 4)
формуласымен анықталады.
 - тұрақты көлемдегі меншікті жылу сиымдылық және она кестеден алады.
- тұрақты көлемдегі меншікті жылу сиымдылық және она кестеден алады.
Изобаралық процесс тұрақты қысымда жүреді (Р=const) . Еркін түрде алынған екі изобаралық процесс үшін Клапейрон-Менделеев теңдеуін жазып
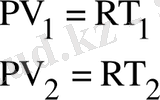 ;
;
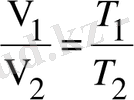 (2. 2. 1)
(2. 2. 1)
Изобаралық процесте жылу беру тек қана газдың ішкі энергиясын өсіру үшін немесе оны салқындату үшін, сығу үшін қолданылады.
Жұмыс:
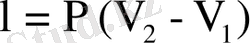 немесе идеал наз үшін
немесе идеал наз үшін
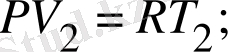
 (2. 2. 2)
(2. 2. 2)
Жылу мөлшері:
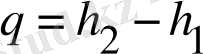 , (2. 2. 3)
, (2. 2. 3)
мұндағы
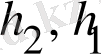 - энтальпиялар шамасы.
- энтальпиялар шамасы.
Сур. 3. Изобаралық процесс
Изобаралық процесті сипаттайтын графикті изобара деп атайды. Графикте р 1 <р 2 .
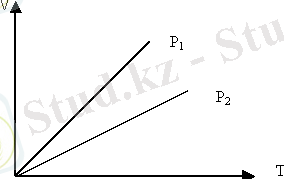
2. 3 Изотермиялық процессИзотермиялық процесс кезінде температура өзгермейді (T=const) . Идеал газдың изотермиялық процесс үшін параметрлер қатынасы мынадай болады: PV=const ;
P
1
V
1
=P
2
V
2
;
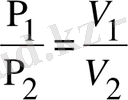 (2. 3. 1)
(2. 3. 1)
Идеал газдың ішкі энергиясы температураға тәуелді болғандықтан, ал изотермиялық процесте ішкі энергия өзгермейді, себебі температура тұрақты.

Сур. 4. Изотермиялық процесс
Изотермиялық процесті сипаттайтын графикті изотерма деп атайды. Графикте Т 1 <Т 2 .
2. 4 Адиабаталық процессАдиабаттық процесс - қоршаған ортамен жылу алмаспайтын физикалық жүйеде өтетін термодинамикалық процесс. Адиабаталық процесс жылу өткізбейтін (адиабаталық) қабықшалармен қоршалған жүйелерде өтеді деп есептелінеді. Сыртқы орта мен жүйе арасында жылу алмасып үлгере алмайтындай уақытта тез өтетін процестер (жылу оқшаулағыш қабықшалары болмайтын) адиабаталық процесс ретінде қарастырылады. Оған мысалы, дыбыстың ауада таралуы, жылу қозғалтқыштарының цилиндрі ішіндегі газдың сығылуы (немесе ұлғаюы) т. б. жатады. Газ сығылғанда температура көтеріледі, ұлғайғанда - төмендейді. Адиабаталық процесс қайтымды және қайтымсыз процесс түрінде өтуі мүмкін.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz