Идеал газ күйінің теңдеуі және негізгі термодинамикалық процестер


МАЗМұНы
Кіріспе3
1. Идеал газ күйінің теңдеуі4
1. 1 Идеал газ4
1. 2 Авогадро заңы4
2. 1 Термодинамикалық процесс . 5
2. 2 Изотермиялық процесс6
2. 3 Изобаралық процесс6
2. 4 Изохоралық процесс7
2. 5 Адиабаталық процесс8
2. 6 Политроптық процесс9
Қорытынды10
Пайдаланылған әдебиеттер12
КіріспеТермодинамика - тәжірибелерден жинақталған нәтижелерге сүйенетін феноменологиялық ғылым. Ол көптеген құрамдас бөліктерден тұратын макроскопиялық жүйелер - термодинамикалық жүйелерді зерттейді. Мұндай жүйелерде жүретін процестер макроскопиялық шамалар, мысалға қысым немесе температура арқылы сипатталады және олар молекулярлық деңгейде қолдануға келмейді.
Термодинамика заңдылықтары жалпы сипатта қолданылады және заттардың атомдық деңгейдегі құрылымына тәуелді емес. Сондықтан термодинамика ғылым мен техниканың энергетика, қозғалтқыштар, фазалық ауысу, химиялық реакциялар, секілді көптеген салаларында қолданылады. Термодинамиканың физика мен химияның бірқатар салаларында, химиялық технология, аэроғарыштық технология, машина жасау, жасушалық биология, биомедициналық инженерия секілді алуан түрлі салаларда алатын орны ерекше.
1. Идеал газ күйінің теңдеуі 1. 1 Идеал газИдеал газ дегеніміз - молекулалары шексіз аз көлем алатын серпімді шариктер болып табылатын және өзара әрекеттесуі тек олардың бір-бірімен тікелей немесе ыдыстың қабырғасымен соқтығысуы кезінде ғана білінетін газ болып табылады.
Идеал газ - бөлшектерінің өзара әсері ескерілмейтін газдың теориялық моделі.
Ол классикалық идеал газ және кванттық идеал газ болып ажыратылады. Классикалық идеал газдың қасиеттері классикалық физика заңдарымен - Клапейрон теңдеуімен, сондай-ақ оның дербес түрлері Бойль-Мариотт заңы және Гей-Люссак заңымен сипатталады. Классикалық идеал газ бөлшектерінің энергиясы Больцман үлестірілуіне сәйкес болып үлестіріледі. Жеткілікті дәрежеде сиретілген реал газдар классикалық идеал газдың моделімен жақсы түсіндіріледі. [1]
Газдың температурасы төмендеген немесе оның тығыздығы артқан кезде идеал газ бөлшектерінің толқындық (кванттық) қасиеттері елеулі рөл атқара бастайды. Бүтін санды спинді бөлшектерден құралған кванттық идеал газдың қалпы (күйі) Бозе - Эйнштейн статистикасымен, ал жарты бүтін санды спинді бөлшектерден құралған кванттық идеал газдың қалпы (күйі) Ферми-Дирак статистикасымен сипатталады. [2]
Мұндағы: R - меншікті газ тұрақтылығы. Мұндағы шамалар мына бірлікте: Р - Н/м 2 , v - м 3 /кг; Т - К, R - Дж/(кгК) . Теңдеу біртекті газдардың қалай болса солай алынған санына (m) арналғанын, басқа түріндегі теңдеуін пайдалана отырып жазуға болады:
P V = m R T {\displaystyle ~PV=mRT}
Бұл теңдеу, идеалды газдарға арналған Клапейрон-Менделеев теңдеуі деп аталады. Мейлі, М газдың молярлы массасы, кг/моль, өлшенеді.
1. 2 Авогадро заңыАвогадро заңы бойынша, идеалды газдың 10 −3 көлемі - қандай да химиялық құрамындағы ( р ) және ( t ) бірдей кезінде, дәл өзі болады. Белгілі, қысым кезінде р 0 = 101, 33 Па (760 мм. сын. бағ. ) және температурада T 0 =273, 16К (нормалы физикалық күйде), газ көлемі 10 −3 моль кезінде, (Vm = =22. 4116 м 3 ) . (р 0 , V m , Т 0 ) және (M=m) мәндерін теңдеуіне ауыстырып қойып табамыз:
Мұндағы R * барлық газдар үшін бірдей және оны, эмбебапты газ тұрақтылығы деп атайды. Сонымен:
Молекулалары бір бірімен және ыдыстың қабырғасымен өзара әрекеттесетін идеал газ моделі үшін алынған газдың қысымын оның температурасымен және молекулалар концентрациясымен байланыстыратын төмендегі формуланы аламыз
бұдан,
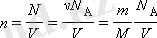
осы теңдіктерді қолдана отырып,
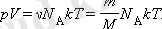
түрінде жазуға болады. Мұндағы N - ыдыстағы молекулалар саны, N A - Авогадро тұрақтысы, m - ыдыстағы газдың массасы, M - газдың мольдік массасы.
Авогадро тұрақтысының Больцман тұрақтысына көбейтіндісін универсал газ тұрақтысы деп атап, R- деп белгілейді (R = 8, 31 Дж/моль·К) .
2. 1 Термодинамикалық процесс Термодинамикалық процесс деп қарастырылатын термодинамикалық жүйенің параметрлерінің өзгеруімен сипатталатын жүйенің күйінің өзгеруін айтады.Берілген жағдайда атомдарының арасындағы өзара әсерлесу күші елеусіз аз болатын газды идеал газ деп атайды.
Қалыпты жағдайдағы газдарды идеал газ деп есептеуге болады. Термодинамикалық параметрлер арасындағы байланысты анықтайтын теңдеуді күй теңдеуі деп атайды.
2. 2 Изотермиялық процесс Тұрақты температурада өтетін процесс изотермиялық процесс деп аталады.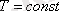
Изотермиялық процесті сипаттайтын заңды ағылшын ғалымы Бойль мен француз ғалымы Мариот бір-бірінен тәуелсіз, тәжірибе жүзінде алды. Сондықтан бұл заң Бойль-Мариот заңы деп аталады.
Берілген газдың массасы үшін тұрақты температурада газ қысымының көлемге көбейтіндісі тұрақты болады.
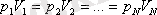 немесе
немесе
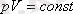

Сурет-1. Изотермиялық процесс.
Изотермиялық процесті сипаттайтын графикті изотерма деп атайды. Графикте Т 1 <Т 2 .
2. 3 Изобаралық процессТұрақты қысымда өтетін процесс изобаралық процесс деп аталады.
.
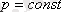
Изобаралық процесті сипаттайтын заңды француз ғалымы Гей-Люссак тәжірибе жүзінде алды. Сондықтан бұл заң Гей-Люссак заңы деп аталады.
Берілген газдың массасы үшін тұрақты қысымда газ көлемінің температураға қатынасы тұрақты болады.
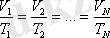 немесе
немесе
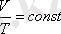
Гей-Люссак заңын Цельсий шкаласындағы температураны пайдаланып келесі түрде жазылады:
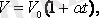
мұндағы:
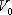 -
-
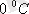 температурадағы газ көлемі,
температурадағы газ көлемі,
 -
-
 температурадағы газ көлемі,
температурадағы газ көлемі,
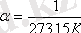 - газ көлемінің ұлғаюының температуралық коэффициенті.
- газ көлемінің ұлғаюының температуралық коэффициенті.
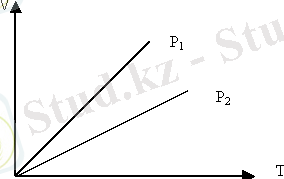
Сурет-2. Изобаралық процесс.
Изобаралық процесті сипаттайтын графикті изобара деп атайды. Графикте р 1 <р 2 .
2. 4 Изохоралық процессТұрақты көлемде өтетін процес изохоралық процесс деп аталады.
Изохоралық процесті сипаттайтын заңды француз ғалымы Шарль тәжірибе жүзінде алды. Сондықтан бұл заң Шарль заңы деп аталады.
Берілген газдың массасы үшін тұрақты көлемде газ қысымының температураға қатынасы тұрақты болады.
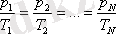 немесе
немесе
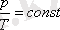
Шарль заңын Цельсий шкаласындағы температураны пайдаланып келесі түрде жазылады:
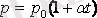 ,
,
мұндағы:
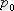 -
-
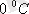 температурадағы газ қысымы,
температурадағы газ қысымы,
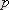 -
-
 температурадағы газ қысымы,
температурадағы газ қысымы,
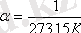 - газ қысымының температуралық коэффициенті.
- газ қысымының температуралық коэффициенті.
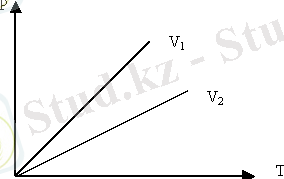
Сурет-3. Изохоралық процесс.
Изохоралық процесті сипаттайтын графикті изохора деп атайды. Графикте V 1 <V 2 .
2. 5 Адиабаталық процессАдиабаттық процесс - қоршаған ортамен жылу алмаспайтын физикалық жүйеде өтетін термодинамикалық процесс. Адиабаталық процесс жылу өткізбейтін (адиабаталық) қабықшалармен қоршалған жүйелерде өтеді деп есептелінеді. Сыртқы орта мен жүйе арасында жылу алмасып үлгере алмайтындай уақытта тез өтетін процестер (жылу оқшаулағыш қабықшалары болмайтын) адиабаталық процесс ретінде қарастырылады. Оған мысалы, дыбыстың ауада таралуы, жылу қозғалтқыштарының цилиндрі ішіндегі газдың сығылуы (немесе ұлғаюы) т. б. жатады. Газ сығылғанда температура көтеріледі, ұлғайғанда - төмендейді. Адиабаталық процесс қайтымды және қайтымсыз процесс түрінде өтуі мүмкін.
Адиабата (гр. Adiabatos - өтпейтін) - адиабата - қайтымды (адибаттық) процесті бейнелей алатын қисық, графикалық сызық.
T
2. 6 Политроптық процесс Политропты процесс дегеніміз, жылуды қалай болса солай жеткізу немесе алып кету (dq а ≠0) процессін айтады, ол үшін көрсеткіштерінің өзара байланыстылығының теңдеу түрі:S
Сурет-4. Адиабаталық процесс
мұндағы n - политроптың көрсеткіші. Дәл осы, қайтымды политропты өзгерту күйінің көрсеткіші n, процесстің барлық нүктелері үшін белгілі, тұрақты шамада болады.
n= 1 pν = const кезінде, яғни изотермиялық процесстің теңдеуі болады, n = k, Pν k = const - адиабатты (изоэнтропиялық) процесс кезінде болуы. Әр түрлі политропты көрсеткіштер үшін, политроп жағдайы суретте көрсетілген.
Политроптар үшін, жұмысқа арналған формулалар мен көрсеткіштер, аралық байланысы қалтқысыз болуы да, изоэнтропиялық процесспен ұқсас. Тек қана, изоэнтропты көрсеткішті k, политропты көрсеткішпен n алмастыру ғана қалды.
Политроптық процесс деп дененің жылу сыйымдылығы тұрақты болып қалатын процесті айтады.
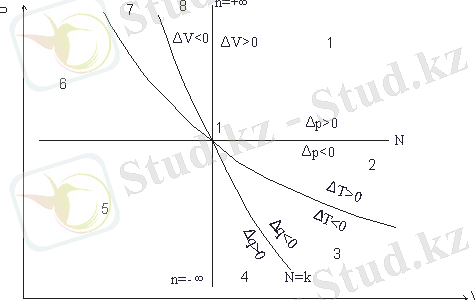
Сурет-5. Политроптық процестер
Қорытынды ... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz