Фосфордың табиғаттағы таралуы, химиялық қасиеттері, алынуы және қолданылуы


Жоспар
І кіріспе
ІІ Негізгі бөлім
2. 1 Фосфор . . . 3
2. 2 Фосфордың өттектің қосылыстары . . . 4
2. 3 Табиғатта таралуы. . 6
2. 4 Фосфордың алынуы мен қолданылуы . . . 9
2. 5 Фосфордың қасиеттері . . . 10
2. 6 Фосфордың оксидтері және қышқылдары . . . 12
2. 7 Фосфор тыңайтқыштары . . . 18
2. 8 Фосфордың сапалық анализі . . . 22
III Қорытынды
Пайдаланылған әдебиеттер
Кіріспе
Қоршаған табиғи ортада зиянды қалдықтардың түзілуінің негізгі көздерінің бірі - химия өнеркәсібі екендігі белгілі. Соның ішінде фосфор өндірісінің қалдықтарының табиғи ортаға, адам мен жануарлар ағзаларына және өсімдіктер дүниесіне зиянды әсерін тигізіп отырғанын айтпай кетуге болмайды. Фосфоритті шикізатты өндіру және өңдеу жұмыстары қоршаған ортаға кері әсер ете отырып, онда қалыптасқан экологиялық байланыстарды бұзады. Бұл өзгерістер әртүрлі жағдайда қоршаған табиғи ортаға зиянды әсерін тигізеді. Соның ішінде, ең маңыздысы жер асты және жер үсті суларының ластануы . Су нысандарына үлкен қауіп төндіретін минералданған ағызынды сулар және олардың құрамындағы фосфорлы және фторлы қосылыстар мен жер асты суларының ластануы берілген нормадан 3-4 есе артып отыр. Жер қорларының жағдайына әсер етуі бойынша жерді рекультивациялау мүмкін болмайды, себебі, ашылған жыныстардың құрамында уранның, фосфордың радиоактивті қосылыстардың болуы, топырақты тек ластап қана қоймай, биосферадағы тірі заттар жүйесінің алмасу механизмін де бұзады. Фосфатты шикізатты өңдеудің негізгі мәселелерінің бірі - фтордың зиянды әсері. Бұл фтордың аз ерігіш түрде болатындығын растайды және эндемикалық флюороздың дамуына мүмкіндік жасайды. Фосфаттарды өндіру барысында фтор, әдетте, тез ерігіш және ұшқыш түрге түзіледі. Минералды тыңайтқыштар алу мақсатында фосфатты кендерді өңдеуде фтордың дайын өнім мен қалдыққа (сұйық, қатты, газ түріндегі) бөлінуі жүреді. Жаңатас аймағында үлкен жылдамдықтағы желдердің болып отыратындығын ескерсек, ондағы атмосфераның әртүрлі құрамды шаң-тозаңмен бірге фосформен ластануы едәуір жоғарылайды.
Фосфор және фосфор өнімдерін шығаратын өндіріс орындарынан атмосфераға тасталынатын зиянды заттардың өндірістің санитарлық қорғау белдемі шекарасындағы концентрациялары ШРК талаптарынан аспайтындығын мониторинг жүргізу нәтижесінде анықталған. Бірақ, сол мониторинг құжатында аса ұнтақ дисперсті болып табылатын фосфогипс сақтау қоймасынан желді күндері атмосфераға көтерілетін фосфогипс шаңы мен оның құрамындағы қоспалардың атмосфераға сапалық көрсеткіштеріне қосатын үлесі анықталмаған.
Фосфор
Табиғатта таралуы және алынуы. Химиялық активтігі азотқа қарағанда жоғары болғандықтан фосфор табиғатта бос күйде кездеспейді. Ол жер қыртысында 200-ге жуық минералдар тұзеді, солардың ішінде практикалық маңыздыларына кальций фосфаттары- фосфорит Ca 3 (PО) 2 , апатит Саз(РО 4 ) 2 Са(ҒС1) 2 жатады. Фосфор барлық тірі организмдердің - өсімдіктің, жануардың, адамның белогынын, құрамына кіреді., Мысалы, ересек адамның қанқасында 600 г, еттерінде 56 г, миында 5 г фосфор болады. Академик A. E. Ферсман фосфорды «тіршілік және ой элементі» деп атады.
Біздің елімізде фосфор кендерінің бай қоры бар. 1924 ж. академик А. Е. Ферсман Кола түбегінде апатиттың өте көп қорын ашты. Фосфориттың аса көп мөлшері Қаратауда ашылды.
Фосфорды арнаулы пештерде өте жоғары температурада фос-фориттен немесе апатиттен алады. Ол үшін пешке фосфорит, құм және кемір қоспасын сальш ертейді. Осы процесс кезінде фосфорит құммен әрекеттесіп кальций силикаты түріндегі иілак тұзеді:
Ca 3 (PO 4 ) 2 + 3SiO 2 = 3CaSiO 3 + P 2 O 5
Реакцияның екінші сатысында фосфор (V) оксиді көмірмен то-тықсызданып фосфорға айналады:
Р 2 0 5 + 5С° = 2Р + 5СО
Бұл екі сатыны біріктіріп реакцияның жиынтық теңдеуін жазамыз:
Ca 3 (PO 4 ) 2 + 5C o + 3SiO 2 = 2P° + 5CO + 3CaSiO 3
Фосфор бірнеше аллотропиялық түр өзгерістер тұзеді, оларға ақ, қызыл және қара фосфор жатады. Ақ фосфор қызыл фосфорды тез суытудың нәтижесінде тұзіледі, ол өте улы болады, ауада өздігінен жанады. Ақ фосфорды суда ерімейтін болғандықтан су астында сақтайды, оның молекуласы төрт атомнан тұрады.
Қызыл фосфор кызғылт қоңыр түсті болады, ақ фосфор ауа қатыстырмай қыздыру арқылы алынады. Ол усыз, ауада өздігінен тұтанбайтын тұрақты зат.
Қара фосфор ақ фосфорды 200°С температурада (12 000 атм қысымда) қыздыру арқылы алады.
Фосфор химиялық қасиеттері жағынан өте актив элементтердің қатарына жатады. Химиялық қосылыстарда фосфор 3 -, 3+, 5+ тотығу дәрежелерін көрсетеді.
Фосфор күшті бейметалдармен әрекеттесіп оңай тотығады, мысалы ол оттегімен әрекеттесіп оксидтер, хлормен әрекеттесіп хлоридтер тұзеді:
4Р + 3О 2 = 2Р 2 О 3 ; 4Р + 5О 2 = 2Р 2 О 6
2Р + 3С1 2 = 2РС1 3 ; 2Р + 5СІ 2 = 2РС1 5
Фосфор тотықтырғыш кышқылдармен, пассив металдардың ион-дарымен әрекеттесіп ортофосфор қышқылына айналады:
Р° + 5HNO 3 = Н 3 РО 4 + 5NO 2 + Н 2 О
2Р + 5H 2 SO 4 = 2HРО 4 - 5SO 2 + 2H 2 O
Р° + 5AgNO 3 + 4Н 2 О = Н 3 РО 4 + 5Ag + 5HNO 3
Фосфор сілтілермен әрекеттесіп диспропорцияланады:
4Р° + 3NаОН + 3Н 2 О = 3NН 2 РО 2 + 3РН 3 ↓
Реакция нәтижесінде натрий гипофосфиты және фосфин тұзіледі. Фосфор тотықтырғыш ретінде металдармен әрекеттесіп фосфидтер деп аталатын заттар тұзеді, мысалы,
3Са + 2Р = Са 3 Р 2
Фосфидтер сумен немесе қышқылдармен әрекеттесіп фосфордың сутегімен қосылысын фосфинді тұзеді:
Ca 3 P 2 + 3H 2 SO 4 = 3CaSO 4 +2PH 3 ↑
Фосфин түссіз, улы, суда жақсы еритін газ. Ол өзінің химиялық қасиеттері жағынан аммиакқа ұқсас болады да суда еріткенде фосфоний гидроксидін, сілтіде еріткенде фосфоиий тұзын тұзеді.
РН 3 + Н 2 О = РН 4 ОН РН 3 + НС1 = РН 4 С1
Фосфин күшті қатарына жататындықтан қыздырғанда ауада жанып кетеді, күшті тотықтырғыштардың әсерінен фосфор қышқылына дейін тотығады, мысалы
2PH 3 +4O 2 = P 2 O 5 = 3H 2 O
3PH 3 + 4K 2 Cr 2 O 7 +16H 2 SO 4 =H 3 PO 4 + 4Cr 2 (SO 4 ) 3 + 4K 2 SO 4 +16H 2 O
Фосфордың қолданылуы. Фосфордың көп мөлшері әр түрлі зиянды насекомдарға қарсы қолданылатын хлорофос, тиофос сияқты пестицидтер дайындауға жұмсалады. Қызыл фосфор негізінен сіріңкенің бүйір жағында болатын коңырқай қоспаньщ құрамына кіреді. Жанғыш снарядтар мен бомбаларды, түтш шымылдығын тұзетін гранатаны ақ фосформен толтырады. Фосфордың жартысына жуығы қазіргі кезде синтетикалық жуғыш заттар жасауға қолданылады.
Фосфордың оттекті қосылыстары
Фосфор оттегімен әрекеттесіп бірнеше оксидтер тұзеді, оларға Р 2 О 3 , Р 2 О 4 , Р 2 О 5 жатады. Бұлардың ішінде практикалық маңыздылары фосфор (III), оксиді Р 2 О 3 және фосфор (V) оксиді Р 2 О 5 .
Фосфор ((III) оксиді Р 2 О 3 балауыз тәріздес, өте улы, суда жақсы еріп фосфорлы қышқыл тұзеді.
Р 2 О 3 + ЗН 2 О = 2Н 3 РО 3
Тұзілген фосфорлы қышқылдың құрамындағы бір сутегі фосформен, тікелей ал екі сутегі оттегі арқылы байланысқандықтан, ол екі негізді қышқылға жатады және екі қатар тұздар тұзеді:
Н 2 РО 3 Н + NаОН = NаНРО 3 Н + Н 2 О
Н 2 РО 3 Н + 2NaOH = Na 2 PO 3 H + 2Н 2 О
Осы реакциялардың нәтижесінде тұзілген NaHPO 3 H натрий гидрофосфиты, ал Na 2 PO 3 H натрий фосфиты деп аталады.
Фосфор (V) оксиді ақ түсті, усыз, суда жақсы еріп және онымен әрекеттесіп қышқыл тұзеді. Фосфор (V) оксиді судың температурасына байланысты онымен әрекеттесіп үш түрлі қышқыл тұзеді:
Р 2 О 5 + Н 2 О = 2НРО 3
метафосфор қышқылы
Р 2 О 5 + 2Н 2 О = Н 4 Р 2 О 7
пирофосфоп кышқылы
Р 2 О 5 + 3Н 2 О = 2Н 3 РО 4
ортофосфор кышқылы
Бұлардың ішінде ортофосфор қышқылының немесе фосфор қышқылының практикалық маңызы бар.
Техникалық мақсаттарға қолданылатын таза емес фосфор қышқылын кальций фосфаты мен күкірт қышқылының әрекеттесуінен алады.
Ca 3 (PO 4 ) 2 + 3H 2 SO 4 = 3CaSO 4 + 2H 3 PO 4
Фосфор қышқылы үш негізді болғандықтан сұдағы ерітіндісінде сатылап иондарға ыдырайды.
Н 3 РО 4 ↔︎Н + + Н 2 РО 3 -(К = 7 , 6- 10- 3 )
H 2 PO 4 ↔︎H+ + HP0 4 - (К 2 = 6, 2- 10- 8 ) НРО*-**Н+ + РО*-(Кз = 4, 4- 10- 13 )
Үш негізді болғандықтан фосфор қышқылы үш қатар тұздар тү-зеді, мысалы:
КОН + Н 3 РО 4 = Н 2 О + ҚН 2 РО 4 (калий дигидрофосфаты)
2КОН + Н 3 РО 4 = 2Н 2 О + К 2 НРО 4 (калийгидрофосфаты)
3КОН + Н 3 РО 4 = 3Н 2 О + К 3 РО 4 (калий фосфать, )
Фосфор қышқылының орта тұздарын фосфаттар, ал қышқыл тұздарын дигидрофосфаттар (NaH 2 PO 4 ) және гидрофосфаттар (Na 2 HPO 4 ) деп атайды. Дигидрофосфаттардың барлығы дерлік, ал гидрофосфаттар мен фосфаттардан тек сілтілік металдар мен аммоний тұздары ғана суда жақсы ериді.
Фосфор ауыл шаруашылық дақылдарынын. дұрыс өсіп - дамуы үшін қажет элемент. Сондықтан фосфор кышқылының тұздары ауыл шаруашылығында тыңайтқыштар ретінде қолданылады.
Табиғи фосфорит пен апатиттың ерімталдығы нашар болғандықтан олар «фосфорит ұны» деген атпен ұнтақ зат түрінде қышқылдығы жоғары топырақтарда пайдаланылады.
Табиғи фосфориттерді әр түрлі әдістермен өңдеу арқылы топы-рақтың барлығында жаксы еритін жасанды тыңайтқыштарды өнді-ру химия өнеркәсібінің негізгі міндеттерінің бірі.
Аса маңызды жасанды фосфор тыңайтқыштарына жай супер-фосфат, қоссулерфосфат, преципитат, аммофос жатады.
Жай суперфосфатты табиғи фосфатқа күкірт кышқылымен әсер ету арқылы алады.
Ca 3 (PO 4 ) 2 + 2H 2 SO 4 = Ca(H 2 PO 4 ) 2 + 2CaSO 4
Сонымен жай суперфосфат кальций Дигидрофосфаты мен кальций сульфатының коспасынан түрады. Кальций сульфаты өсімдіктерге қажет болмайтындықтан қоспада оның болуы суперфосфаттың құнын кемітеді.
Қос суперфосфатты табиғи фосфат пен фосфор қышқылын әре-кеттестіру жолымен алады.
Саз(РО 4 ) 2 + 4НзРО 4 = ЗСа(Н 2 РО 4 ) 2
Қос суперфосфаттын, құрамында жай суперфосфаттағыдай кальций фосфаты болмайтындықтан ондағы фосфордың мәлшері де екі есеге жуық көп болады.
Байытылған суперфосфатты, жай суперфосфаттағы табиғи фосфатты күкірт қышқылымен азот қышқылыныц қоспасы арқылы өн деп, ондағы фосфордың мөлшерін көбейту жолымен алады.
Преципитатты фосфор қышқылын әк суымен немесе әк тасымен нейтралдау аркылы алады:
Н 3 РО 4 + Са(ОН) 2 = СаНРО 4 -2Н 2 О
Н 3 РО 4 + СаСО 3 +Н 2 О = СаНРО 4 -2Н 2 О + СО 2
Аммофостарды немесе аммоний фосфаттарын фосфор қышқылы мен аммиактың әр түрлі мөлшерлерін нейтралдау жолымен өнді-реді.
НзРО4 + Шз = Ш 4 Н 2 РО4 (аммофос)
H 3 PO4 + 2NH3=(NH 4 ) 2HPO4 (диаммсфос)
2H 3 PO4+3NH 3 =NH 4 H2PO4+ (NH 4 ) 2 HPO 4 (аммофос және диаммофос) .
Аммофостар құрамында әрі фосфоры, әрі азоты бар жоғары сапалы тыңайтқыштар.
Фосфордың табиғатта таралуы.
Фосфор жер қыртысында әжептеуір мөлшерде болады, бірақ өте тотыққыш болғандықтан, дербес күйінде кездеспейді. Қосылыстарының маңыздысы фосфорит деген минерал, оның негізгі фосфор қышқылының кальций тұзы-
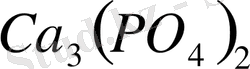 . Фосфорит әр жерлерде кен түрінде кездеседі; Жамбыл қаласының жанындағы Қаратау өңірінде, Ақтөбе маңында т. б. жерлерде бар. Қаратау жер жүзіндегі фосфоритке бай жердің бірі, әрі сапасы өте жоғары. Фосфордың табиғи қосылысының таңы бір маңыздысы апатит деген минерал, оның негізі
. Фосфорит әр жерлерде кен түрінде кездеседі; Жамбыл қаласының жанындағы Қаратау өңірінде, Ақтөбе маңында т. б. жерлерде бар. Қаратау жер жүзіндегі фосфоритке бай жердің бірі, әрі сапасы өте жоғары. Фосфордың табиғи қосылысының таңы бір маңыздысы апатит деген минерал, оның негізі
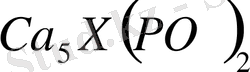 не
не
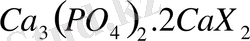 мұндағы X=F кейде Cl
-
не ОН
-
.
мұндағы X=F кейде Cl
-
не ОН
-
.
Дүние жүзінде апатиттің ең бай орнын Кеңес Одағында 1926жылы академиктер А. Е. Ферсман мен Л. Н. Лабунцов. Кола түбегінен, Хибинск деген жерден тапқан. Фосфориттер Оралда, Поволжьде, Сібірде, Қазақстанда, Эстонияда, Белоруссияда және басқада жерлерде кең таралған. Фосфориттің мол кендері Солтүстік Африкада, Сирияда және АҚШ - та бар.
Фосфор өте маңызды элемент, өйткені ол өсімдіктердің де, жануарлардың да белоктарының құрамына кіреді; өсімдіктерде-дәнінің, жануарлардың-сүт, қан, ми және жүйке жүйесінің ақуыздарының құрамында болады. Онымен қатар сүйек және тістің құрамында болады
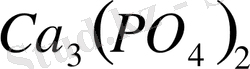 түрінде болады. Біздің елімізде фосфор кендерінің бай қоры бар. 1924 ж. академик А. Е. Ферсман Кола түбегінде апатиттың өте көп қорын ашты. Фосфориттың аса көп мөлшері Қаратауда ашылды.
түрінде болады. Біздің елімізде фосфор кендерінің бай қоры бар. 1924 ж. академик А. Е. Ферсман Кола түбегінде апатиттың өте көп қорын ашты. Фосфориттың аса көп мөлшері Қаратауда ашылды.
Фосфорды арнаулы пештерде өте жоғары температурада фос-фориттен немесе апатиттен алады. Ол үшін пешке фосфорит, құм және кемір қоспасын сальш ертейді. Осы процесс кезінде фосфорит құммен әрекеттесіп кальций силикаты түріндегі иілак тұзеді:
Ca 3 (PO 4 ) 2 + 3SiO 2 = 3CaSiO 3 + P 2 O 5
Реакцияның екінші сатысында фосфор (V) оксиді көмірмен то-тықсызданып фосфорға айналады:
Р 2 0 5 + 5С° = 2Р + 5СО
Бұл екі сатыны біріктіріп реакцияның жиынтық теңдеуін жазамыз:
Ca 3 (PO 4 ) 2 + 5C o + 3SiO 2 = 2P° + 5CO + 3CaSiO 3
Фосфор бірнеше аллотропиялық түр өзгерістер тұзеді, оларға ақ, қызыл және қара фосфор жатады. Ақ фосфор қызыл фосфорды тез суытудың нәтижесінде тұзіледі, ол өте улы болады, ауада өздігінен жанады. Ақ фосфорды суда ерімейтін болғандықтан су астында сақтайды, оның молекуласы төрт атомнан тұрады.
Қызыл фосфор кызғылт қоңыр түсті болады, ақ фосфор ауа қатыстырмай қыздыру арқылы алынады. Ол усыз, ауада өздігінен тұтанбайтын тұрақты зат.
Қара фосфор ақ фосфорды 200°С температурада (12 000 атм қысымда) қыздыру арқылы алады.
Фосфор химиялық қасиеттері жағынан өте актив элементтердің қатарына жатады. Химиялық қосылыстарда фосфор 3 -, 3+, 5+ тотығу дәрежелерін көрсетеді.
Фосфор күшті бейметалдармен әрекеттесіп оңай тотығады, мысалы ол оттегімен әрекеттесіп оксидтер, хлормен әрекеттесіп хлоридтер тұзеді:
4Р + 3О 2 = 2Р 2 О 3 ; 4Р + 5О 2 = 2Р 2 О 6
2Р + 3С1 2 = 2РС1 3 ; 2Р + 5СІ 2 = 2РС1 5
Фосфор тотықтырғыш кышқылдармен, пассив металдардың ион-дарымен әрекеттесіп ортофосфор қышқылына айналады:
Р° + 5HNO 3 = Н 3 РО 4 + 5NO 2 + Н 2 О
2Р + 5H 2 SO 4 = 2HРО 4 - 5SO 2 + 2H 2 O
Р° + 5AgNO 3 + 4Н 2 О = Н 3 РО 4 + 5Ag + 5HNO 3
Фосфор сілтілермен әрекеттесіп диспропорцияланады:
4Р° + 3NаОН + 3Н 2 О = 3NН 2 РО 2 + 3РН 3 ↓
Реакция нәтижесінде натрий гипофосфиты және фосфин тұзіледі. Фосфор тотықтырғыш ретінде металдармен әрекеттесіп фосфидтер деп аталатын заттар тұзеді, мысалы,
3Са + 2Р = Са 3 Р 2
Фосфидтер сумен немесе қышқылдармен әрекеттесіп фосфордың сутегімен қосылысын фосфинді тұзеді:
Ca 3 P 2 + 3H 2 SO 4 = 3CaSO 4 +2PH 3 ↑
Фосфин түссіз, улы, суда жақсы еритін газ. Ол өзінің химиялық қасиеттері жағынан аммиакқа ұқсас болады да суда еріткенде фосфоний гидроксидін, сілтіде еріткенде фосфоиий тұзын тұзеді.
Бұл едәуір көп таралған элемент, жер қыртысындағы оның мөлшері 0, 12%-ті құрайды. Фосфор белсенді, табиғатта бос күйінде кездеспейді құрамында болады, маңыздысы-құрамына кальций фосфаты кіретін апатит минералы. Апатиттің бірнеше түрі белгілі. Ең көп таралғаны фторапатит 3Ca (PO ) . Ca F
Апатиттің бір түр өзгерісі шөгінді тау жыныстарын- фосфориттерді түзеді.
Қазақстанда фосфорға өте бай кен орындары бар. ХХ ғасырдың 30-жылдары Ақтөбе облысында фосфорит кені табылған. Ақтөбе кен орындарының негізгі артықшылығы-олардың қабаттары жер бетіне жақын орналасқан және пайдалы қазбаны ешқандай кедергісіз өндіруге болады. Мұнда жалпы қоры жүздеген миллион тоннаға жететін ондаған ірі кен орындары бар.
30-жылдардың аяғында (1938-1940) Қаратау бассейні ашылды.
Бассейінде 26 кен орны бар. Бассейннің басты бес кен орындарында
( Жаңатас, Ақсай, Шолақтау, Көкжон, Көксу) бүкіл қордың 90%
P O бар. Қаратау фасфарит қабатының қалыңдығы 10-12 м, ал кейбір орындарда 30 м - ге жетеді.
Оңтүстік Қазақстанда, Аят және Лисаковск кен орындарындағы қоңыр тас көмірдің құрамында фосфордың едәуір қоры бар. Совет одағында фосфорит Жамбыл қаласының жанындағы Қаратау өңірінде, кездеседі. Қаратау жер жүзіндегі фосфоритке бай жердің бірі, әрі сапасы өте жоғары. Фосфордың табиғи қосылысының тағы бір маңыздысы апатит деген минерал, оның негізі Ca 5 X(PO) 2 . Совет Одағында апатитің өте көп жерін, 1926 академ А. Е. Ферсман мен Л. Н. Лабунсов, Қола түбегінен Хибинск деген жеріне тапқан.
Фосфор өте маңызы элемент, өйткені ол өсімдіктердің де, жануарладдың да белоктардың да құрамына кіреді; өсімдіктерде - дәннің жануарлардың, сүт, қан, ми және нерв тікені белоктарының құрамында болады. Онымен қатар сүйек және тістің құрамында Ca 3 (PO 4 ) 2 түрінде болады. РН 3 + Н 2 О = РН 4 ОН РН 3 + НС1 = РН 4 С1
Фосфин күшті қатарына жататындықтан қыздырғанда ауада жанып кетеді, күшті тотықтырғыштардың әсерінен фосфор қышқылына дейін тотығады, мысалы
2PH 3 +4O 2 = P 2 O 5 = 3H 2 O
3PH 3 + 4K 2 Cr 2 O 7 +16H 2 SO 4 =H 3 PO 4 + 4Cr 2 (SO 4 ) 3 + 4K 2 SO 4 +16H 2 O
2. 2 Фосфордың алынуы мен қолданылуы
Фосфорды апатиттен немесе фосфориттен алады. Фосфорды бос күйде алу үшін фосфоритті құм және көмірмен араластырып электр пеште 1500 0 -қа дейін қыздырады, онда болатын реакциялардың жалпы теңдігі былай жазылады:
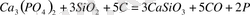
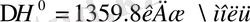
Бөлініп шыққан фосфор буы салқындатылып, қатты күйге аударылған фосфор, судың астына жиналады. Фосфорды фосфавриттен алады. Оны көмірмен (кокспен) және құммен араластырып, 1500С электр пешінде қыздырады:
2Са (РО) +10С+6SiO =6CaSiO +P =10CO↑
Якция кезінде фосфор буы су астындағы қабылдағышта конденсацияланады.
Қызыл фосфордың бертолле тұзымен қоспасы әлсіз үикелісте немесе қысқанда тұтынады:
6Р+5КСI =5KCI+3P O
Сондықтан қызыл фосфорды, негізінен бұрынғы ақ фосфордың орнына сіріңке өндірісіне қолданады.
Фосфордан едәуір мөлшері зиянды жәндіктерді жою үшін пайданылатын әр түрлі фосфор органикалық препараттар өндірісіне жұмсалад. Фосфордың оттекті қосылыстар, фосфор қышқылы және оның тұздары кеңінен қолданады.
Ақ фосфор көп қолданылмайды. Оның жанатын және түтіндейтін снаряттарда пайдаланылады. Қара фосфор өте сирек қолданылады. Фосфордың көп мөлшері әр түрлі зиянды насекомдарға қарсы қолданылатын хлорофос, тиофос сияқты пестицидтер дайындауға жұмсалады. Қызыл фосфор негізінен сіріңкенің бүйір жағында болатын коңырқай қоспаньщ құрамына кіреді. Жанғыш снарядтар мен бомбаларды, түтш шымылдығын тұзетін гранатаны ақ фосформен толтырады. Фосфордың жартысына жуығы қазіргі кезде синтетикалық жуғыш заттар жасауға қолданылады. Фосфор көп мөлшерде шырпы өндірісінде қолданылады. Ақ фосфор жанғанда будақ-будақ қалың қабатты ақ түтін (фосфор (V) оксиді) түзіледі, сондықтан оны «түтін шымылдығын» жасау үшін снаряд, бомбаларға салады. Зиянкес жәндіктерге қарсы дәрі жасауға фосфор-органикалық препараттар синтезіне қолданылады. Фосфордан едәуір мөлшері зиянды жәндіктерді жою үшін пайданылатын әр түрлі фосфор органикалық препараттар өндірісіне жұмсалад. Фосфордың оттекті қосылыстар, фосфор қышқылы және оның тұздары кеңінен қолданады.
Ақ фосфор көп қолданылмайды. Оның жанатын және түтіндейтін снаряттарда пайдаланылады. Қара фосфор өте сирек қолданылады. Фосфордың көп мөлшері әр түрлі зиянды насекомдарға қарсы қолданылатын хлорофос, тиофос сияқты пестицидтер дайындауға жұмсалады. Қызыл фосфор негізінен сіріңкенің бүйір жағында болатын коңырқай қоспаньщ құрамына кіреді. Жанғыш снарядтар мен бомбаларды, түтш шымылдығын тұзетін гранатаны ақ фосформен толтырады. Фосфордың жартысына жуығы қазіргі кезде синтетикалық жуғыш заттар жасауға қолданылады.
2. 3 Фосфордың қасиеттері.
Физикалық қасиеті . Фосфордың екі аллотропиялық түрі бар: ақ және қара фосфор, алайда олардың арасында-күлгін, қызыл түрлері бар.
Фосфордың атомдары Р 2 , Р 4 , не Р 2∞ полимерлі молекула болып бірігеді.
Р 2 молекулалары N 2 сияқты құрылған, бірақ 1000 0 С жоғары температурада ғана тұрақты, 2000 0 С артық температурада атомға ажырайды. 1000 0 С төмен жағдайда Р 4 молекулалары тұрақты, олар тетраэдр тәрізді болады.
Ақ фосфор (d-модификация) фосфор буын тез салқындатқанда түзіледі, қатты кристалдық зат, меншікті салмағы 1, 82 0 , t б 0 С=44, 1, t қ 0 С=275 сұйық, не бу күйінде 1000 0 -қа дейін молекуласы Р 4 одан жоғары температурада Р 2 айналады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz