Аналитикалық химияда сандық талдау мен титриметрияның теориясы, әдістері және есептеулері


Мазмұны
1. Кіріспе . . . 4
1. 1 Аналитикалық химияның талдау әдістері . . . 5
1. 2 Анализдің түрлері мен талдау әдістері . . . 6
2. Сандық анализдің теориялық негіздері және оның әдістері мен аналитикалық реакцияларға қойылатын талаптар . . . 8
3. Титриметрияның маңызы . . . 10
3. 1 Химиялық процестерге байланысты титриметриялық әдістің жіктелуі . . . 11
3. 2 Титриметриялық есептеулер. Химиялық реакциялардағы әрекеттесуші заттардың эквиваленттігі . . . 13
3. 3 Титриметриялық талдау әдісі . . . 16
3. 4 Титриметриялық анализ әдістерінің жіктелуі . . . 19
3. 5 Қышқылдық-негіздік тирлеудің мәні . . . 22
Қорытынды . . . 24
Қолданылған әдебиеттер . . . 25
Кіріспе
Аналитикалық химия - заттардың химиялық, кейде фазалық құрамына кіретін молекулалардың құрылымдық және кеңістік құрылысын анықтайтын әдістер туралы ғылым.
Аналитикалық химия заттың химиялық құрамын табуға қажетті әдістерді қарастырып, сол әдістердің теориялық негіздерін зерттеумен шұғылданатын химия ғылымының бір тарауы.
Аналитикалық химия-бұл заттардың құрамына кіретін атомдардың, молекулалардың, иондардың, яғни химиялық құрамын және солардың мөлшерін анықтайтын әдістер туралы ғылым. Заттың сапалық және сандық құрамы туралы мәліметтерді алу үшін, алдымен химиялық реакциялар жүргізіліп аналитикалық қасиеттерді іріктеу керек . Сондықтан аналитикалық химия студенттердің химиялық ойлауын қалыптастырып, анализді химияның ақырғы жетістіктеріне сүйеніп жүргізуді үйретеді, анализдің жаңа әдістемесін жасауға мүмкіндік береді.
Аналитикалық химияның маңызы:
- химиялық анализ жасау арқылы, атомдық масса, молекулалық масса, химиялық қосылыстардың формуласы белгіленеді.
- химиялық анализ ғылыми зерттеу жұмыстарында
- химиялық анализ өндірісте кең қолданылады
- химиялық анализ шикізаттың құрамын анықтау үшін
- анализге сүйеніп технологиялық режим тағайындау үшін
- дайын өнімнің сапасын анықтау үшін
Аналитикалық химия физикамен, геологиямен, металлургиямен, медицинамен, ауыл шаруашылығы ғылымдарымен тығыз байланысты.
Мысалы: ауыл шаруашылығы саласында - топырақтың, тыңайтқыштың, мал азығының құрамын білу үшін.
Қазіргі кезде аналитикалық химия жетістіктері тамақ өнеркәсібінде, дәрі-дәрмекті дайындауда, жасыл өсімдіктердің химиясын зерттеуде, қоршаған ортаны сақтау жұмыстарында көптеген мәселелерді шешуге қолданылады. Химия пәнінің мұғалімі және маманы үшін аналитикалық химияның негіздерін білу өте маңызды. Өйткені оны:
- өздігінен зертханалық тәжірибелерді жасауға, жүргізуге үйретеді;
- керек реактивті дұрыс таңдап алуына үйретеді;
- химиялық реакцияларды жүргізу үшін жағдайлардың маңыздылығын ұмытпауды үйретеді;
- реакция нәтижесі негізінде логикалық дұрыс қорытынды жасауға дағдыландырады[1] .
Аналитикалық химияның талдау әдістері
Аналитикалық химия - зерттелетін заттың табиғатына байланысты бейорганикалық және органикалық заттар анализі деп бөлінеді.
Атқаратын міндетіне байланысты химиялық анализдің химиялық құрамын анықтаудың екі түрі болады. Олар сапалық және сандық болып бөлінеді.
Зерттелетін зат қандай элементар бөлшектерден, атомдар тобынан, иондардан, не молекулалардан құралатынын сапалық анализ белгілейді.
Мысалы: H 2 SO 4 , H, S, O немесе 2H + , SO 4 2- .
Ал зертттелетін заттың құрамына кіретін жеке элементтердің, атомдар тобының, не иондардың мөлшерін немесе олардың сандық қатынасын анықтау сандық анализдің міндетіне жатады.
H: S: O = 2:1:4 W%(H) = 2, 04% W%(H + ) = 2, 04%
W%(S) = 32, 65% W%(SO 4 2- ) = 97, 96% W%(O) = 65, 31%. (1)
Химиялық анализ жүргізу нәтижесінде зерттелетін заттың химиялық формуласы белгіленеді[6] .
Анализдің түрлері мен талдау әдістері
Элементтік анализ - заттың құрамындағы элементтердің түрін және мөлшерін анықтау;
- фазалық анализ - зерттелетін заттағы фазалардың түрлерін және мөлшерін анықтау;
Мысалы: болат құрамындағы көміртегі графит (С) және карбит күйінде болады. Фазалық анализ жүргізу арқылы екі фазада да болатын көміртегінің мөлшері анықталынады.
- құрылымдық анализ - үлгінің құрылымын анықтау, молекулаға кіретін атомдардың кеңістіктегі орнын белгілеу (молекуланың геометриясын анықтау: тетраэдрді CH4, NH3, H2O, CH3OH, тригональды (sp2) этилен, бензол, сызықты (sp) ацетилен, CO2) ;
- молекулалық анализ - зат үлгісінің құрамында болатын тұтас молекулалар түрлерін анықтау. Мысалы: ауадағы СО2, N2, O2, NH3) ;
- функциональдық анализ - органикалық зат молекулаларындағы функциональдық топтарының бар жоғын анықтау: ОН - гидроксид, NH2- амин, NO(ІІ), NO2(IV) - нитро;
- «Жалпы» анализ - зерттелетін заттың жан - жақты зерттелуі,
Зерттелетін үлгінің мөлшеріне байланысты анализдеу Кесте 1
Жартылай
микроанализ
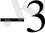 - 10
- 10
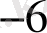
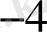
Ультромикро
анализ
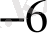 - 10
- 10
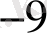
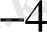 - 10
- 10
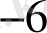
Субмикро
анализ
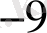 - 10
- 10
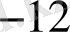
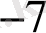 - 10
- 10
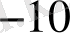
Анализдеу әдістері былай жіктеледі:
- химиялық (классикалық) әдіс;
- инструментальдық (физикалық және физика - химиялық) әдіс;
- биологиялық әдіс.
Анализге алынған заттың агрегаттық күйіне байланысты екі түрі болады:
- «дымқыл» анализдеу.
- «құрғақ» анализдеу;
Зерттелетін зат қатты зат болса, ондай анализдің түрін «құрғақ» деп атайды. «Құрғақ» анализдеу әдісінде реакциялардың орындалу әдістемесіне байланысты анализдеу екі түрге бөлінеді:
- құрғақ тұздарды үйкелеу (ысқылау) әдісі.
- пирохимиялық әдіс. Бұл әдісте затты жанарғы отында қыздырады.
Орындалу техникасына байланысты екі түрлі болады:
- жалын түсінің боялуы:
- түрлі - түсті шыны алу[5] .
Аналитикалық реакция түрлері.
Анализ жүргізу мақсатымен жасалған реакцияларды жалпы аналитикалық реакция деп атайды.
Бір топ катиондар белгілі бір реагентпен бірдей нәтиже беріп әрекеттесетін болса топтық реакция, ал әсер ететін реактивті топтық реагент деп атайды.
Жеке(жекелік) реакциялар деп әрбір ион үшін ерекше белгімен жүретін реакцияларды атайды.
Өзіндік реакциялар деп - тек бір ғана ионмен ерекше белгі беріп жүретін реакцияларды, ал реагентті - өзіндік реагент деп атайды[3] .
Сандық анализдің теориялық негіздері және оның әдістері мен аналитикалық реакцияларға қойылатын талаптар
Химиялық сандық талдау пәні - заттардың сандық құрамын анықтауға негізделген.
Сандық талдаудың міндеті - қосылыстың (анализденетін заттың) құрамына кіретін химиялық элементтердің (немесе оның топтарының) мөлшерін және анализденетін заттың құрам - бөліктерінің сандық қатынасын анықтау.
Сандық талдау әдісі жәрдемімен көптеген анықтауларды жүргізуге болады:
- Заттардың атомдық, мольдік эквиваленттік массасын белгілеу;
- Анализденетін зат құрылысына енетін құрамдас бөліктердің мөлшерін анықтау;
- Заттардың құрам-бөліктерінің ара қатынасын табу;
- Ерітінді құрамына кіретін заттардың мөлшерін анықтау.
Сандық талдау әдістерінің - химиялық, биологиялық, геологиялық, медициналық, экологиялық т. б. зерттеулер жүргізуде маңызы зор. Талдау әдісі - қоршаған орта объектілері: топырақ, су, ауаны ластайтын заттардың мөлшерін, құйманың, минералдардың, металлдардың, медициналық препараттардың, ғарыштық обьектілердің, тағамдық өнімдердің, айналада болатын улы заттардың, тыңайтқыштардың, және т. б. заттардың құрам - бөліктерінің мөлшерін анықтауда кеңінен қолданады.
Сандық әдістер зат құрамының тұрақтылық заңына, зат массасының сақталу заңына және эквиваленттік заңға негізделген.
Сандық талдау әдістері - химиялық, физикалық, физико - химиялық болып бөлінеді. Соңғы екі әдісті аспаптық (инструментальдық) анализ деп те атайды[2] .
Химиялық әдістердің негізіне химиялық реакциялардың бірнеше типтері: қышқылды - негіздік, тотығу - тотықсыздану, тұнба түзілу және комплекс түзілу жатады.
Талдаудың химиялық әдістері:
- гравиметриялық
- титриметриялық
- газдық анализдер болып бөлінеді.
Гравиметриялық және титриметриялық әдістердің маңыздылығы жоғары. Бұл аналитикалық әдістерді классикалық деп атайды. Көптеген жағдайда химиялық реакцияның жоғары жылдамдығы және толық жүруі, аналитикалық әдістің негізі ретінде химиялық әдістер біртіндеп инструментальдық әдістерге орын береді. Бірақ олар дәлділігі жағынан қалыспайды: анықтаудың салыстырмалы қателігі 0, 1 - 0, 2% - дан аспаса, ал инструментальдық әдістердің қателігі - 2 - 5 - 20%. Классикалық әдістер, анықтау дұрыстығын бағалау үшін стандартты болып табылады. Гравиметрия мен титриметрияның негізгі қолданылу аймағы - заттардың үлкен және орташа мөлшерін анықтау[1] .
Гравиметриялық әдіс - анықталынатын затты таза күйінде бөлуге және оны дәл өлшеуге негізделген. Көбіне мұндай бөлу жұмыстары тұндыру арқылы жүргізіледі. Анықталатын компонентті ұшқыш қосылыстар түрінде (айдау әдісі) бөлу сирек қолданылады. Кейбір жағдайда гравиметрия - аналитикалық тапсырмаларды шешудің тиімді әдісі болып табылады. Бұл салыстырмалы нақты әдіс. Анықтау қателігі 0, 1 - 0, 005% - дан аспайды.
Титриметриялық әдіс - химиялық реакцияға түскен екі заттың көлемін өлшеу арқылы анықталынатын заттың мөлшерін анықтауға негізделген. Реакцияға түскен заттың біреуінің концентрациясы дәл белгілі болады, оны титрант деп атайды. Реакцияның соңы индикатордың көмегімен және басқа тәсілдермен айқындалады. Реакцияға кеткен реактивтің концентрациясы мен көлемін біле отырып есептеулер жүгізіледі. Титриметриялық талдау әдісі эквиваленттер заңына негізделген[3] .
Анықтау қателігі 0, 1 - 0, 05% болады.
Газдық әдіс - анықталынатын газтәріздес заттардың көлемін өлшеуге негізделген. Анализденетін үлгінің көлемін өлшеу қатты және сұйық заттарға сіңіру немесе газды қоспаны жағу нәтижесінде жүргізіледі. Анализге алынған газ қоспасының мөлшеріне байланысты макро - (100 мл газ), жартылай микро - (2-10 мл), микроәдістер (1 мл) болып бөлінеді.
Титриметрияның маңызы
Титриметриялық анализ - химиялық реакцияға қатысқан анықталынатын зат пен реагент ерітіндісінің (титрант) көлемін (массасын) дәл өлшеу арқылы зат мөлшерін анықтауға негізделген сандық анализдің әдісі.
Ерітінді реагенттің концентрациясы дәл белгілі болу керек. Концентрациясы белгiлi реагент ерiтiндiсiн титрант немесе стандартты ерітінді деп атайды.
Реакцияға жұмсалған титранттың көлемін дәл өлшеу үшiн, концентрациясы белгiлi зат ерiтiндiсiн (титрантты) бюреткадан бiртiндеп, тамшылатып анықталатын А заттың ерiтiндiсiне қосады. Бұл процесс титрлеу деп аталады.
Сонымен титриметриялық анализде химиялық реакцияның аяқталу кезеңі немесе соңы эквиваленттік нүкте деп аталады.
Химиялық реакцияның соңғы нүктесін анықтау үшін анализденетін зат ерітіндісіне арнайы зат - индикатор қосады.
Титриметрияда қолданылатын химиялық реакциялар келесі талаптарға сай болу керек:
- реакция жоғары жылдамдықпен жүруі керек;
- реакция іс жүзінде соңына дейін жүруі керек;
- анықталынатын зат пен реагент (титрант) арасындағы реакция қатаң стехиометриялы (эквивалентті) болу керек;
- титрлеу процесі кезінде қосымша реакция жүрмеуі керек;
- ерітіндідегі қосымша заттар реакцияға кедергі жасамау керек;
- эквиваленттік нүктені белгiлеу (анықтау) әдiсi болу керек;
- эквиваленттік нүктені анықтау үшін арнайы индикатор болу керек.
Титриметриялық анализдің жетістіктері:
- анализ нәтижесінің дәлдігі жоғары (анықтау қателігі 0, 1%) ;
- анализдің орындалуы жылдам, әрі қарапайым;
- титрлеу процесін автоматтандыру мүмкіншілігі;
- бір ерітіндіден бірдей уақытта бірнеше затты анықтауға болады[5] .
Химиялық процестерге байланысты титриметриялық әдістің жіктелуі
Барлық титриметриялық әдістер қолданылатын химиялық реакция типтеріне байланысты үлкен екі топқа бөлінеді:
І. Ион алмасу реакцияларына негізделген - әдістер.
ІІ. Электрон жұптарының ауысуы реакцияларына негізделген - әдістер.
Бірінші топқа:
- Қышқылдық - негіздік әдіс
Қышқылдық - негіздік әдіс қолданылатын титрантқа байланысты екі топшаға бөлінеді:
- ацидиметрия - титрант ретінде қышқыл алынады, ал анықталынатын зат сілті.
- алкалиметрия - титрант ретінде сілті, ал анықталынатын зат ретінде қышқыл алынады.
- Комплексиметрия әдісі - берік комплексті қосылыстар түзілу реакцияларына негізделген:
Ag + + 2CN - = Ag (CN) 2 -
- Меркурометрия - титрант Hg(NO3) 2
- Комплексонометрия - титрант ЭДТА
- Цианометрия - титрант KCN
Қазіргі кезде көптеген металл иондарын анықтау үшін комплексонометрия әдісі кеңінен қолданылады, онда стандартты ерітінді ретінде органикалық қосылыс - комплексондар алынады.
- Седиметрия әдісі - нашар еритін қосылыстар, тұнба түзілу реакцияларына негізделген.
- Аргентометрия - титрант AgNO3
- Меркурoметрия - титрант Hg2(NO3) 2
- Рoдaнометрия - титрант NH4SCN
Екінші топқа - тотығу - тотықсыздану реакцияларына негізделген көптеген әдістер жатады, реакция барысында электрон жұптары ауысады.
Редоксиметрия әдісі қолданылатын титрантқа байланысты екі топшаға бөлінеді:
- оксидиметрия - титрант ретінде тотықтырғыштар қолданылады.
- редоксометрия - титрант ретінде тотықсыздандырғыштар қолданылады[1] .
Титрлеу әдісінің түрлері Кесте 2
Титрант
(концентрациясы белгілі ерітінді)
1
1
Қышқыл - негіздік титрлеу әдісі (бейтараптау протолитометрия, нейтралдау)
H 3 O + + OH - = 2H 2 O
2
2
Редоксиметрия әдісі (тотығу-тотықсыздану титрлеу)
aOx 1 + bRed 2 = aRed 1 + bOx 2
1. Оксидиметрия
2. Редоксометрия
а) Перманганотометрия
б) Иодометрия
в) Дихромотометрия
Г) цериметрия
Д) бромaтометрия
Ox
Red
Fe 2+ , NO 2 - , CNS -
KMnO 4 , MnO 2 , CI 2 , Na 2 SO 3
Red
Red
Red
Тотғыштар
Т-сыз - тар
KMnO 4
I 2 (ox)
KI (red)
K 2 Cr 2 O 7
Ce (IV)
KBrO 3
Комплексиметрия әдісі
Me + L = MeL
Ni 2+ , Co 2+ , Al 3+ ,
Zr(IV), Th(IV)
4
4
Седиметрия әдісі (тұндыра түсіру әдісі)
Me + X = MeX↓
Аргентометрия
Меркурoметрия
Рoдaнометрия
Галогенидтер,
радонид,
S 2- , CrO 4 2- , PO 4 3-
AgNO 3
Hg 2 (NO 3 ) 2
NH 4 CNS
Титриметриялық есептеулер. Химиялық реакциялардағы әрекеттесуші заттардың эквиваленттігі
- Элементтің эквиваленті
- Қышқылдың немесе негiздiң эквивалентi
Тотығу - тотықсыздану реакцияларындағы заттардың эквивалентi
Эквиваленттік фактор (f экв ) . Титриметриялық анализде ерітінділердің концентрациясын өрнектеу және ерітінділердің концентрациясын өрнектеудің әртүрі.
Мольдік концентрация. С м - деп белгілейді.
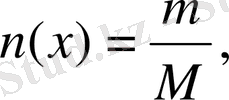 (2)
(2)
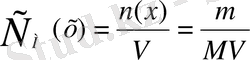 ; (3)
; (3)
Мұндағы, m - х заттың массасы (г), М - мольдік масса.
Эквиваленттің мольдік концентрациясы (С Н немесе С fэкв (Х), өлшем бірлігі мольэкв/л) - 1 л ерітіндіде еріген заттың моль эквивалент мөлшері.
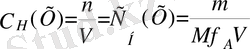 ; (4)
; (4)
Мұндағы, m -заттың массасы (г), Мf - эквиваленттің мольдік массасы.
Заттар өзара эквиваленттi мөлшерде әрекеттесетiндiктен, онда стехиометриялық әрекеттесетiн екi зат үшiн келесi катынас орындалады:
Анықталынатын ерітіндінің белгілі бір көлемін V Х титрлеу барысында эквиваленттік нүктені анықтауға кеткен титрант көлемін V Т өлшейді.
С Х V Х = С Т V Т ; (5)
Титранттың эквивалентінің мольдік концетрациясын біле отырып, анықталынатын ерітіндінің эквивалентінің мольдік концентрациясын келесі формуламен есептейді:
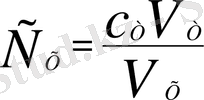 ; (мольэкв/л) (6)
; (мольэкв/л) (6)
мұнда с - эквиваленттің мольдiк концентрациясы, V - ерiтiндi көлемi[3] .
Концентрация мен эквиваленттің мольдік массасын қолдана отырып заттың массасы мына формуламен өрнектеледі:
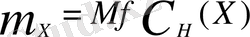 ; (г) (7)
; (г) (7)
Мұндағы, m х -заттың массасы (г), Мf - эквиваленттің мольдік массасы, С н (х) эквиваленттің мольдік массасы.
Стандартты ерітіндінің титрі (Т, г/мл) - 1мл ерітіндіде еріген заттың грамм массасы.
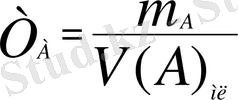 г/мл (8)
г/мл (8)
Мұндағы Т А - ерітіндінің титрі, m A - алынған заттың массасы, V А - ерітінді көлемі.
Ерітіндінің эквивалентінің мольдік концентрациясымен байланысты өрнектелген титр:
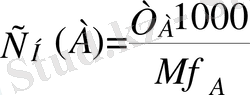 ; моль экв/л, (9)
; моль экв/л, (9)
бұдан титрді өрнектеу:
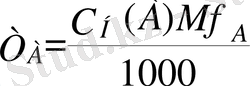 г/мл (10)
г/мл (10)
Анықталынатын компонент бойынша алынған титр Т А/В (г/мл) - 1 мл А стандартты ерітіндісімен әрекеттесетін В анықталынатын компоненттің грамм массасы.
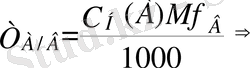
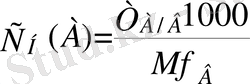 ; (11)
; (11)
Мұндағы: Т А/В - стандартты ерітіндінің анықталынатын компонент бойынша титрі, С Н (А) А стандартты ерітіндісі эквивалентінің мольдiк концентрациясы, Мf В - анықталынатын компоненттің эквиваленттік мольдік массасы. Титрлеу операциясын жүргізу жолдарына байланысты есептеу формулалары:
кесте 3
Тура титрлеу:
Х + Т →
Х сұй + Т →
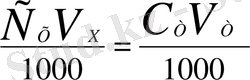
С
Х
V
Х
= С
Т
V
Т

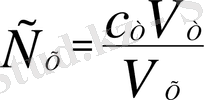 ;
;
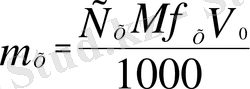
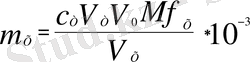
Х қ + Т →
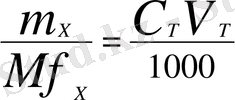

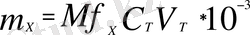
Керi титрлеу:
(X + Tарт) = T + B
(Xсұй + Tарт) = T + B
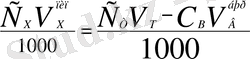 )
)

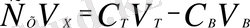

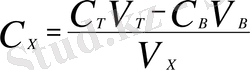
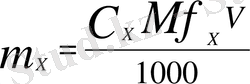
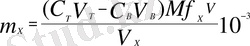
Жеке өлшенді алу әдісі:
(Xқ + Tарт) = T + B

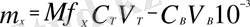
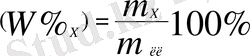
Орынбасу титрлеу:
(хсұй +А) → С + В
n(x) = nA = nC
= nB
(хсұйық +А ) → С + В
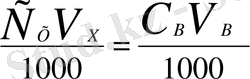
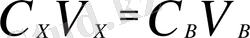

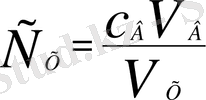
(хқатты +А ) → С + В
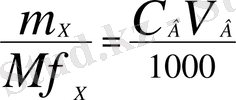

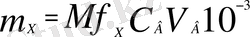
Титриметриялық талдау әдісі
Көлемдік анализ химиялық реакцияға кіріскен заттардың көлемдерін тікелей өлшеуге негізделген. Көлемдік анализді басқаша титриметриялық анализ дейді.
Титриметриялық анализде тирленген ерітінділер қолданылады. Концентрациясы өте дәл анықталатын ерітінділерді титрленген (қалыпты) ерітінділер, жұмыс ерітіндісі немесе титранттар деп аталады. Ерітіндінің бір куб сантиметріндегі (бір миллилитріндегі) еріген зат массасын титр дейді. Титрдің өлшемі г/см 3 (г/л) . Мысалы: калий гидроксиді ерітіндісінің титрі 0, 021 болса, ол бұл ерітіндінің әр миллилитрінде 0, 021г КОН бар екенін көрсетеді[5] .
Титрант ерітіндісін анықталатын зат ерітіндісіне біртіндеп қосу процесін титрлеу дейді.
Титрлеу кезінде әрекеттесетін реактивтердің артық мөлшерлері емес, бір-біріне эквивалент мөлшерін анықтайды. Осы кезде әрекеттесу процесі химиялық реакция теңдеуіне сәйкес болады. Сонымен, титрлеу арқылы химиялық реакцияның аяқталған кезені, басқаша айтқанда, эквивалент нүктесін анықтайды. Эквивалент нүктені, әдетте, индикаторлар түсінің өзгеруі, немесе электр өткізгіштік өлшеу және басқа да әдістер көмегімен анықталады. Эквивалент нүктесін тапқан соң титрлеуді тоқтатады. Реакцияға кеткен титранттың көлемі мен концентрациясы бойынша анықталатын заттың мөлшерін есептейді[4] .
Титрленген ерітінділер әр түрлі тәсілдермен даярлануы мүмкін. Осыған орай титрленген ерітінділерді стандартты (даярланған) және стандартталған (анықталған) деп екіге бөледі.
Стандартты ерітінділер. Оларға көтеген тұздар (натрий тетрабораты, натрий оксалаты, натрий хлориді, калий дихроматы), қымыздық қышқылы т. б. жатады. Оны даярлау үшін дәл өлшеніп алынған затты өлшеуіш колбаға салып ерітіп, суды белгіге жеткізеді. Еріген зат массасы (m, г) және өлшеуіш колбаға көлемі (V) бойынша ерітінді титрін Т есептейді:
Т= m/ V (12)
Титрі бойынша ерітінді нормальдылығын табу үшін титрді 1000-ға көбейтіп, эквивалентке (Э) бөледі:
N =
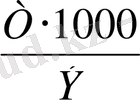 (13)
(13)
Мысалы: 0, 5312 г натрий карбонатын Na 2 CO 3 100мл-ге арналған өлшеуіш колбада ерітсек, түзілген ерітінді титрі:
Т=
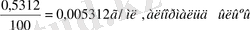 (14)
(14)
N=
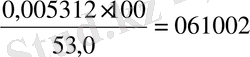 болады. (15)
болады. (15)
Заттың дәл өлшенген мөлшерінен ерітілген титрленген ерітіндіні стандартты (даярлаған) дейді.
Стандартты ерітінді даярлау үшін алынатын заттар химиялық таза, сақтағанда, қатты және сұйық күйде тұрақты, құрамы химиялық формулаларына сәйкес болуы тиіс. Осы талапқа сай қосылыстарды басқа ерітінділердің титрін анықтауға арналған стандартты бастапқы заттар немесе нормальдар деп атайды.
Мысалы: тұз қышқылының титрін анықтау үшін натрий тетрабораты Na 2 B 4 O 7 ·10H 2 O қолданылса, калий перманганаты ерітіндісінің титрін қымыздық қышқылының Н 2 С 2 О 4 · 2Н 2 О стандарт ерітіндісі арқылы табады.
Стандартталған ерітінділер. Көлемдік анализде, көбінесе, қышқылдар мен сілтілер, калий перманганаты, натрий тиосульфаты сияқты стандарт ерітінділерге қойылатын талапты қанағаттандырмайтын реактив ерітінділері титрант ретінде қолданылады. Олардың дәл концентрациялы ерітінділерін өлшенген мөлшерінен даярлауға болмайды. Өйткені, сақталғанда, ауада ол қосылыстар концентрациясы өзгеріп кетеді. Сондықтан бұл титрант ерітінділерді жуықтап алынған мөлшерінен даярлайды да, олардың дәл концентрациясын басқа стандартты ерітінді бойынша есептеп табады[3] .
Мәселен, тұз қышқылы ерітіндісінің дәл концентрациясы натрий тетрабораты стандартты ерітіндісі бойынша анықталады.
Сонымен, дәл концентрациясы нақты өлшенген мөлшерінен емес, басқа стандартты ерітінді бойынша анықталатын титрант ерітіндісін стандартталған дейді.
Химиялық анализде ерітінділерді фиксаналдардан немесе стандарт-титрден даярлайды. Фиксанал-1л 0, 1н не 0, 01н ерітінді даярлауға арналған шыны ампула. Фиксаналдан ерітінді даярлау оңай. Шыны ампуланы арнаулы тескішпен тесіп, дистилденген сумен шайқап 1л өлшеуіш колбаға салып ерітеді де, дистилденген муды белгіге дейін құяды.
Титриметриялық анализдегі есептеулер. Стандартталған ерітінділердің концентрациясы басқа стандартты ерітіндімен титрлеу арқылы анықталады. Стандартты ерітіндінің нормальдығы мен көлемі және стандартталған ерітінді көлемі бойынша нормальды ерітінділер қасиеттерін пайдаланып анықталады.
- Нормальдығы өзара тең ерітінділердің әрекеттесетін көлемдері де бірдей болады:
N 1 = N 2 онда V 1 = V 2 (16)
- Ерітінділер нормальдығы әр түрлі болса, әрекеттесуші заттар көлемдері мен нормальдықтары қатынасы кері пропорционал болады:
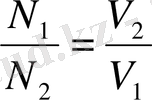 бұдан N
1
· V
1
= N
2
· V
2
(17)
бұдан N
1
· V
1
= N
2
· V
2
(17)
Осы формуланы пайдаланып титрант ерітіндісі бойынша басқа ерітіндінің белгісіз концентрациясын анықтайды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz