Азот және оның маңызды қосылыстары


. . . қаласы әкімдігінің білім бөлімінің «№ . . . орта мектебі» ММ
РЕФЕРАТ
Тақырыбы: «Азоттың маңызды қосылыстары»
Орындаған: . . . сынып оқушысы
. . .
Тексерген: . . .
. . . қаласы 2016 ж.
Жоспар:
Жалпы мәліметтер . . . 3
Азот қышқылы . . . 4
Аммиак . . . 5
Азоттың оксидтері . . . 6
Пайдаланған әдебиеттер . . . 8
Азот ( гр. ázōos - тіршіліксіз) - химиялық элемент - түссіз, иіссіз, дәмсіз - суда аз еритін газ. Бұл элемент ақуыздардың-нуклейін қышқылдарының-нуклеотидтердің және өмірде өте маңызды басқада көптеген органикалық қоспалардың құрамына енеді. [1] N - элементтердің периодты жүйесінің V тобындағы химиялық элемент, реттік нөмірі - 7, атом салмағы - 14. 0067. Табиғатта екі изотопы кездеседі: 14 N (99. 635%), 15 N (0. 365%) .
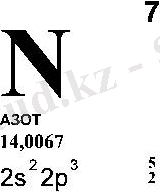
Азотты 1772 жылы ағылшын ғалымы Даниэль Резерфорд ашқан. Жер қыртысындағы азоттың мөлшері 0. 03%. Табиғатта азот дербес және қосылыстар күйінде кездеседі және негізгі қоры екі атомнан тұратын молекула түрінде ауа құрамында болады. Азоттың ауадағы салмақ үлесі 75. 6%, көлем үлесі 78. 1%. Жер қыртысының 1 т массасына 1 кг азоттан келеді, әрі ол бейорганикалық және органикалық қосылыстар күйінде кездеседі. Оның бейорганикалық қосылыстарының негізгілеріне натрий нитраты (чили селитрі), калий нитраты (үнді селитрі) жатады. Органикалық қосылыстар күйіндегі азоттың негізгі қоры барлық тірі ағзалардың ақуыздарында құрамына кіреді. Кезінде жанбайтын қасиетіне байланысты “тіршіліксіз” деп аталып кеткенімен азот тіршілікке өте керек элемент. Қалыпты температурада азот түссіз, иіссіз газ. Қайнау температурасы - 196 °C, қату температурасы - 210 °C. Су бір өлшем көлемінде (20 °C-та) 0. 0154 көлем азот ериді, яғни азоттың суда ерігіштігі оттектің ерігігтігінен төмен. Ауадан аздап жеңіл болады.
Периодтық жүйедегі орны. Азот екінші периодтың, бесінші топтың негізгі топшасының элементі, реттік нөмірі 7. Олай болса азоттың ядросында 7 протон мен 7 нейтронбар. Электрондарының жалпы саны да 7. Осы 7 электрон екі электрондық қабатта былай бөлініп орналасқан: 1s 2 2s 2 2p 3 .
Сондықтан азот қосылыстарында үш валентті, негізгі жағдайдағы қосылыстарында азоттың тотығу дәрежелері -3, 0, +3 болады, мысалы:
NH 3 , N 2 , N 2 O .
Қосылыс түзген кезде азот атомында бос d қабаты болмағандықтан 2s деңгейшесіндегі электрон жұбы ажырайды. Байланыс түзу үшін бір электрон электртерістілігі басымырақ элементке ауысып, азоттың тотығу дәрежесі +1, әрі қарай +2, +3, +4, +5-ке дейін жетеді.
Бұл тізбеде N 2 О мен NО тұз тұзбейтін оксидтер. Қалғандары қышқылдық оксидтер; оларға сәйкес қышқылдарының формулалары HNО 2 - азотты қышқыл, HNО 3 - азот кышқылы.
Азот қышқылы- HNO3
Құрылысы:
O
H - O - N
O
Алынуы:
Лабораторияда: NaNO3 + H2SO4 = NaHSO4 + HNO3
Өнеркәсіпте: 4NH3 + 5O2 = 4NO + 6H2O
2NO + O2 = 2NO2
4NO2 + 2H2O + O2 = 4HNO3
Физикалық қасиеті:
Азот қышқылы- өткір иісті, түссіз сұйықтық (ρ= 1, 52г/мл) . Өте ылғал тартқыш. Сақтаған кезде жылудың және жарықтың әсерінен азот қышқылы ыдырап, сарғыштау тартады.
4HNO3 = 4NO2↑ + 2H2O + O2↑
Химиялы қасиеті:
Азот қышқылы күшті тотықтырғыш. Қышқылдардың барлық қасиеттеріне ие болумен қатар өзіне тән қасиеттері бар. Ол электрохимиялық кернеу қатарында алтын мен платинадан басқа барлық металдарды ерітеді. Азот қышқылы сұйылтылған күйінде де тотықтырғыш болып табылады. Сондықтан сұйылтылған азот қышқылының ерітіндісімен кернеу қатарында сутекке дейін орналасқан металдар әрекеттескенде сутек бөлінбейді. Металдармен әрекеттескенде тотықсыздану өнімдері тотықсыздандырғыштың табиғатына және азот қышқылының концентрациясына тәуелді.
Азот қышқылының тұздары:
Азот қышқылының тұздарын нитраттар деп атайды. Олар металдарға, олардың оксидтері мен гидроксидтеріне қышқылмен әсер еткенде алынады. Суда жақсы еритін натрий, калий, кальций және аммоний нитраттары селитралар деп аталады. Азот қышқылының тұздарын қыздырғанда ыдырайды. Ыдырау өнімдері металдардың электрохимиялық кернеу қатарындағы орнына тәуелді.
Қолданылуы:
Азот қышқылы- химиялық өнеркәсіптің негізгі өнімдерінің бірі. Азот қышқылынан минералды тыңайтқыштар, қопарылғыш заттар, дәрілік заттар, бояулар, пластикалық заттар, жасанды талшықтар алынады.
Аммиа́к - NH 3 , сутегі нитриді, қалыпты жағдайда - өткір иісті (мүсәтір спирті иісті) түссіз газ.
Аммиак ауадан шамамен алғанда екі есе жеңіл. Аммиактың суда ерігіштігі жоғары - 1000 көлем суда 1200 көлем (0 °C кезінде) немесе 700 көлем (20 °C кезінде) NH 3 ериді. Тоңазытқыш техникада R717 деген атауға ие, мұндағы R - Refrigerant (хладагент), 7 - хладагент типі (бейорганикалық қосылыс), 17 - молекулалық массасы.
Физикалық қасиеттері:
Аммиак - түссіз, өткір иісті, ауадан екі еседей жеңіл, тұншықтырғыш газ. Балқу температурасы - 77, 8°С , қайнау температурасы - 33, 4°С .
Аммиак суда өте ерімтал, 1 көлем суда 700 көлем аммиак ериді. Аммиак суда ерігенде аммиак гидратын NH 3 ·H 2 O түзеді. Аммиактың судағы ерітіндісі аммиак суы немесе мусәтір спирті деген атпен дәріханада сатылады.
Аммиактың сумен әрекеттесуі.
Аммиак суда ерігенде, темендегі тепе-теңдік іске асады:
Аммиактың судағы ерітіндісі әлсіз негіздік қасиет көрсетеді.
Себебі соңғы тепе-теңдік сол жаққа қарай көбірек ығысатындықтан, судағы ерітіндіде гидроксид ионы ОН- аз болады. Өздеріңе белгілі негіздерден аммоний гидроксидінің айырмашылығы - мұнда оң зарядты ион аммоний NH 4 болады.
Егер аммиак пен оттек ағынын тұтандырса, аммиак оңай жанады:
а) өршіткі қатыспаса, бос күйдегі азот бөлінеді:


ә) өршіткі ( Pt қатысында) азот (II) оксидіне дейін тотығады:
Аммиак қышқылдармен әрекеттесіп, аммоний тұздарын түзеді.
Мысалы, екі шыны таяқшаны алып, біріншісін - аммиак суына, екіншісін - концентрациялы тұз қыішқылына батырып, екі таяқшаны бір-біріне жақындатса, ақ түтін пайда болады.
Ол - аммоний хлоридінің өте ұсақ кристалдары. Реакция тендеуі:
Аммиак басқа да күшті қышқылдармен әрекеттесіп, аммоний тұздарын түзеді.
Аммиактан минералдық тыңайтқыштар, дәрі-дәрмектер, қопарылғыш заттар, азот қышқылы және нитраттар өндіріледі, аммоний тұздары алынады. Аммиак төменгі қысымда (0, 7-0, 8 мПа) оңай сұйылады, ол буланғанда көп жылу сіңіретін қасиетіне сәйкес тоңазытқыш қондырғыларда реагент ретінде қолданылады.
Аммоний нитраты мен аммоний сульфаты, аммоний гидро- фосфаттары тыңайтқыш ретінде кеңінен қолданылады. Аммоний хлориді: дәнекерлеуге, гальвани элементін даярлауға, ал аммоний гидрокарбонаты: кондитер, тамақ өнеркәсібінде қолданылады. Аммоний нитраты NH 4 NO 3 мен алюминий және көмірдің коспасынан аммонал деп аталатын копарылғыш зат жасалынады.
Аммиак - өткір иісті, тұншықтырғыш газ. Өнеркәсіпте сутек пен азотты қосып, тікелей синтездеп, ал лабораторияда аммоний тұздарын сілтімен қосып қыздырып, аммиак алады. Аммиак суда жақсы еріп, аммоний гидроксидін, ал қышқылдармен реакцияға түсіп, аммоний тұздарын түзеді. Одан тыңайтқыштар - нитраттар, азот қышқылы, қопарылғыш заттар алынады.
Аммоний тұздарының барлығы суда жақсы ериді. Оларды қыздырғанда, аммиак бөле ыдырайды. Аммоний тұздары азот қышқылын алуға, тыңайтқыштар өндіруге, қопарылғыш заттар жасауға қолданылады.
Азоттың осксидтері - азоттың оттекпен қосылыстары. Азот тотығы (монооксид), NO - түссіз газ; қайнау t - 151, 8 o С, балқу t - 163, 6С; қосып алу, тотығу реакцияларына бейім. Азоттың шала тотығы (гемиоксид), N 2 O - түссіз газ; қайнау t - 89, 5 o С, балқу t - 102, 4 o С. Сумен, қышқылмен, сілті ерітінділерімен әрекеттеспейді, тотықпайды. Медицинада наркоз (“шаттандырғыш газ”) ретінде пайдаланады. Азоттың қос тотығы (диоксид), NO 2 - қоңыр түсті газ, қайнау t - 21, 15 o C, балқу t - 11, 2 o С. Ол азот қышқылын өндіру үшін және сұйық ракета отыны мен қопарылғыш заттардың тотықтырғышы ретінде пайдаланылады. Азотты ангидрид, N 2 O 3 - қоңыр қызғылт түсті газ, қайнау t - 13, 5 o C; балқу t - 102 o С; сумен азотты қышқыл (HNO 2 ), сілтілермен нитриттер түзеді. Азот ангидриді, N 2 O 5 - түссіз кристалл, сумен қосылып азот қышқылын (HNO 3 ) түзеді. Жалпы азот оксидтері - физиологиялық актив заттар. Сондықтан ағза үшін зиянды. Азот әр түрлі оксидтер түзеді:
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz