Мыс пен мырыштың қасиеттері, алынуы және қолданылуы: байыту мен флотация технологиялары


Кіріспе3
1 Мыс және мырыш элементі4
1. 1 Мыстың қасиеттері мен қолданылуы4
1. 2 Мырыш элеметінің қасиеттері7
2 Мыс және мырыш элементінің алыну мен қолданылуы10
2. 1 Мыстың алынуы мен қасиеттері10
2. 2 Мырыштың алынуы мен қолданылуы15
Қорытынды18
ҚОЛДАНЫЛҒАН ӘДЕБИЕТТЕР19
КіріспеСоңғы уақытта өндірістік өңдеуге, қарапайым байыту жағдайында жұқа ұсақталуды қажет ететіндіктен, минералдардың маңызды бөлігі қалдыққа кететін, қиын байтылатын полиметаллды рудалар келіп түсетін болған. Сол себептен көмірлі аса жұқа заттардың құрамы көп болғандықтан, негізгі реагенттер адсорбат ретінде жоғалады.
Осыған байланысты металдардың концентратқа ауысудың технологиялық көрсеткіштерін жоғарылатуға мүмкіндік беретін, көміртекті заттардың эффективті модификаторлары, флотациялық әрекеттің синергетикалық эффектісіне ие композициялық жинағышты қолдану негізінде қиын байытылатын полиметалл кендерінің флотациясы үшін жаңа эффективті модифицирленген реагенттерді құру өзекті мәселе болып табылады.
Қазақстан Республикасының дамыған тау-металлургиялық комплексімен көптеген байыту фабрикалары әрекет етеді, дегенмен олардың эффективті флотореагенттерге деген сұранысы үнемі артып келеді. Қазіргі уақыттағы отандық флотациялық реагенттердің өндірісі, әсіресе жинағыштар мен көпірткіштердің өндірісі шектеулі. Өзіндік реагенттерді енгізуде белсенді саясатты шетелдік фирмалар жүргізіп келеді. Алыстан келетін реагенттер көп жағдайда жоғары сапалы емес, түрлі кендер типтерін байытуда шектеулі қолданысқа ие. Осы орайда, республикада бар шикізаттан отандық өндірісті флотореагенттерді байыту фабрикаларының тәжірибесіне енгізу үшін өндіру қажеттілігі туындап отыр. Берілген жұмыста физико-химиялық зерттеулер комплексі негізінде Майқайын кен орнының мыс-қалайы кендерін байыту кезіндегі жинағыштар қоспасының флотациялық қабілетін бағалау қарастыралады.
Минералды шикізат сапасының төмендеуі мен экологиялық нормаларды сақтау қажеттілігі, органикалық химия мен флотация теориясында соңғы жетістіктерді қолданатын, принципиалды жаңа реагентті режимдерді құрастыру қажеттілігі пайда болды. Эффективті байытудың маңызы артуынан басқа, реагентті режимдерге қойылатын минималды токсикалық, минералдардың максималды селективтілігі, реагенттердің шығымы мен бағасына деген талаптарға тіреледі. Флотацияның технологиялық көрсеткіштері қолданылатын флотореагенттердің ассортименті мен сапасына тәуелді. Осыған байланысты қиын полиметалл шикізатын эффективті байытуға мүмкіндік беретін жаңа флотореагенттерді алу мен қолдану маңызды мәселе болып табылады.
Жұмыстың мақсаты - мыс, мырыш кендерін байыту кезіндегі қоспасының флотациялық қабілетін бағалау болып табылады.
Берілген жұмыстың мақсаты металдық мырыштың күкірт қышқылының сулы ерітіндісінде еру кинетикасынның температураға, ерітінді құрамына байланысын, ерітіндіде мырышқа қарағанда электротерістілігі жоғары кейбір металдардың қоспаларының әсерін анықтау.
1 Мыс және мырыш элементі 1. 1 Мыстың қасиеттері мен қолданылуыМыс , Cu - элементтердің периодтық жүйесінің І-тобындағы химиялық элемент, атомдық нөмірі 29, атомдық массасы 63, 546. Табиғатта тұрақты екі изотопы бар: 63 Cu және 65 Cu. Жер қыртысындағы массасы бойынша мөлшері 4, 7. 10-3%. Негізгі минералдары: халькопирит, халькозин, ковеллин, малахит, азурит. Пластикалық қызыл түсті металл, кристалл торы қырлары центрленген кубтық, тығыздығы 8, 94 г/см 3 , балқу t 1084, 5°С, қайнау t 2540°С, тотығу дәрежесі +1, +2. Құрғақ ауадағы бөлме температурасында тотықпайды. Қыздырғанда ауада CuО және Cu 2 О-ға дейін тотығады, галогендермен, S, Se, HNO 3 , H 2 SO 4 -пен әрекеттеседі. Аммиак, цианидтермен, т. б. кешенді қосылыстар түзеді. Сульфид концентратын балқытып, одан түзілген мыс штейнін қара мысқа дейін тотықтырып, оны жалынмен не электролиттік әдіспен тазарту арқылы; гидрометаллургиялық әдіс - құрамында мысы бар минералдарды күкірт қышқылымен (немесе NH 3 ерітіндісімен) өңдеп, одан әрі электролиздеу арқылы алады. Мыс кабельдердің, электр қондырғылары мен жылу алмастырғыштардың ток өткізгіш бөлігін жасау үшін пайдаланылады; қорытпалардың (латунь, қола, мыс-никель, т. б. ) құраушысы ретінде қолданылады.
Құрамынан мыс алынатын табиғи шикізат. Оның құрамына мысы бар 240-тан аса минерал кіреді. Олардың ішінде өнеркәсіптік негізгілері: халькопирит (құрамындағы мыстың мөлшері 34%), борнит (63, 3), ковеллин (66, 4), халькозин (79, 8), теннантит (57), тетраэдрит (52, 3), энаргит (48, 3), куприт (88, 8), тенорит (79, 8), малахит (57, 7), азурит (55, 3), хризоколла (36, 1), брошантит (56, 2), атакамит (59, 5) . Мысты құмтас кен орындарында мыстың мөлшері көп болады. Қазақстанда бұл кен типтері басты орында (мысалы, Жезқазған кен орны) . Минералдық және химиялық құрамдарына байланысты мыс кендерінің технологиялық сорттары сульфидтік, тотыққан, аралас болып ажыратылады. Сонымен қатар мыс кендері сом және сеппелі-тарамшалы болып бөлінеді. Қазақстанда мыс кендерінің ірі кен орындарына Жезқазған, Қоңырат, Ақтоғай, Жаманайбат, т. б. жатады.
Пайдалы қазылымдарды байыту өнімі, не шикізатты химиялық өңдеудің өнімі. Бұл өнімдерде пайдалы концентрат мөлшері бастапқы шикізаттағыдан көп болады. Олар байыту фабрикасынан тікелей пайдалануға не металлургиялық өңдеуге жіберіледі. Металлургиялық өңдеуге жіберер алдында оларды флотациялық байытудан өткізеді. Мыс кенін байыту барысында негізгі алынатын өнім, құрамындағы мыс 55%-ға жететін (көбінесе 10%-дан 30%-ға дейін) мыс концентраты болып есептелінеді. Ал флотация кезінде мыстың концентратқа өту шығымы 80%-дан 95%-ға дейін болады. Байыту барысында мыс концентратынан басқа қосымша пиритті және түсті металдар концентраттары (мырышты, молибденді, т. б. ) алынады. Қазақстанда мыс шикізат көздері Орталық, Шығыс (Кенді Алтай) және Оңтүстік Қазақстан облыстарында шоғырланған. Соңғы жылдары мыс-мырыш күрделі концентраттарын балқытып, ұсатып өңдеу, автогенді балқытып өңдеу тәсілдеріБалқаш мыс зауытында жүргізілуде. [1] [2]
Гидротермалық және ол көбінесе мысты минералдардың жер бетінде ыдырауынан шығады. Мыстың кейінгі жаратылысын көрсету үшін халькопирит атты мысты минералдың ыдырауын келтірейік: CuFeS 2 - * FeSO 4 ->-Cu. Осы ыдыраудың нәтижесінде мыспен қатар малахит, азурит минералдары да пайда болады.
Уралда (Орта Уралда), Қазақстанда Қоңырат, Жезқазған, Ақбастау), Өзбекстанда Алмалықта бар. Шет мемлекеттегі кеніАҚШ-та Жоғары Көлдер аймағында (Мичиган штатында), Африкада (Родезия) бар.
Дүние жүзінде 70-тен астам түсті металл балқытылады. Оларды 14 сала өндіреді. Олардың барлығы қосылыптүсті металлургияны құрайды. Түсті металдардың көп бөлігі аз уақыттан бері ғана пайдаланыла бастады. Ғылыми-техникалық революцияның нәтижесінде олар кеңінен қолданысқа түсті. Реактивті ұшақтар, ғарыш кемелерін, атом реакторларын жасау үшін ерекше қасиеттері бар, мүлдем жаңа конструкциялық мателиалдарды қажет етті.
Ондай қасиеттер тек түсті металдарда ғана бар. Қорғасын, никель және қалайыжемірілуге (коррозия), титан ыстыққа төзімді келеді, ал күміс, мыс және алюминий жоғары электр өткзгіштігімен ерекшелінеді. Сондықтан, олардың қолдану аясы өте ауқымды: медициналық аспаптар мен материалдардан бастап күрделі электроника мен ядролық техника осы металдардан жасалады және әр металл «өз кәсібін тапқан». Адамдар металдардың ішінде алғашқы болып мысты рудадан тез еритін, оңай бөлінетін болғандықтан ерте кезден қолдана бастаған. Ескі замандарда негізінен қалайы мен мыс қосындысы нәтижесінде қола алынып, қару-жарақ дайындалған. Бұл адамзат тарихында қола дәуірі ретінде белгілі. Мыстың латынша Cuprum атауыКипр аралына байланысты онда біздің заманымызға дейінгі ІІ мыңжылдықта мыс рудниктері қолданылып балқытылған. Страбон жазбаларында мыс Эбвей жеріндегі Халкида қаласының атымен Халкос деп аталған. Осы сөзден ескі грек тілінде мыстан және қоладан жасалған заттар, ұсталық өндіріс, ұсталық заттар мен құймалар атаулары шыққан. Мыстың екінші латыншы атауы AES (санскр, ayas, гот тілінде air, неміс тілінде err, ағылшынша ore) руда немесе рудник дегенді білдіреді. Еуропа тілдерінің үнді-герман теориясында қолданылып, орыстың «медь»(полякша miedr, чех тілінде - med) ескі немісше smida (металл) және shmied (ұста, ағылшынша smith) сөздерінен шығарады. Әрине, бұл сөздердің түбірлерінің туыстығына дау жоқ, бірақ та бұл екі сөзде гректің рудник, копь деген сөзінен бір-біріне байланыссыз түрде шыққан. Осы сөздерден басқада туыс атаулар шыққан - медаль-медальон(французша medaile) . Орыстың ескі жазбаларында мыс және мыстан жасалған деген сөздер кездеседі. Алхимиктар мысты Венера (Venus) деп атаған. Қазақстанда да мұндай атаулар ерте заманннан бар. Олардың атауларын ерте кезде өмір сүрген ата-бабаларымыз қойған, және де осы күнге дейін сол аттарын сақтап қалған. Мысалы: Мыстау, Мыстөбе, Жезді тағы басқа сол сияқтылар. Көптеген түсті металдардан сапасы жөнінен бастапқы материалдардан да асып түсетін қорытпалар жасалады.
Мыстың қалайымен (қола), мырышпен (жез), никельмен (мельхиор), алюминиймен (дюралюминий) қорытпалары бұрыннан қолданылып келсе, ал берилий қоласы ҒТР дәуірінде пайда болды.
Периодтық жүйедегі орны және атом құрылысы: Мыс - I топтың қосымша топшасындағы металл. Мыс атомының электрондық формуласы:
+29Cu 1s2 2s2 2p6 3s2 3p6 3d10 4s1
Мыс атомындағы s-электрондардың біреуі сыртқы (төртінші) энергетикалық деңгейден d-деңгейшесіне ауысқандықтан, мыс қосылыстарында +1 тотығу дәрежесін (мысалы, Cu +1 2 O) және +2 тотығу дәрежесін (мысалы, Cu +2 O) көрсетеді. Табиғатта таралуы: Мыс табиғатта негізінде байланысқан түрде кездеседі, мысалы мынадай минералдардың: мыс жылтыры Cu 2 S, куприт Cu 2 O, мыс колчеданы CuFeS 2 , малахит (CuOH) 2 CO 3 құрамына кіреді. (Осы жерде және әрі қарай химиялық формуламен минералдардың негізгі бөліктері көрсетілген) . Алынуы: Мыстың өндірістік алыну процесін (мыс жылтырынан) қарапайым түрде былай көрсетуге болады
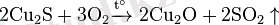
Мыс оксиді әрекеттеспей қалған мыс (I) сульфидімен Cu 2 S реакцияға түседі. Осы процестің нәтижесінде мыс түзіледі:
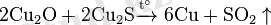
Бұл жолмен алынған мыста қоспалар болады. Таза мысты электролиз әдісімен алады. Физикалық қасиеттері: Мыс - ақшыл-қызғылт түсті, жеткілікті дәрежеде жұмсақ, созылғыш. Балқу температурасы - 1083 °С. Ол - өте жақсы ток өткізгіш (тек күмістен кейін) . Химиялық қасиеттері: Құрғақ ауада қалыпты температурада мыс мүлде өзгермейді деуге болады. Температураны жоғарылатқанда мыс жай да, күрделі заттармен реакцияға түседі. Жай заттармен өзара әрекеттесуі:
1. 2 Мырыш элеметінің қасиеттері

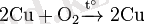
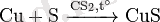
Күрделі заттармен өзара әрекеттесуі:
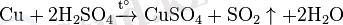
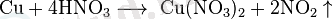
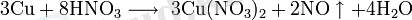
Мырыш (лат. Zincum ), Zn - элементтердің периодты жүйесінің II-тобындағы химиялық элемент, асыл металдардың бірі. Реттік нөмірі 30, атом массасы 65, 39. [1] Мырыш ерте заманда жез түрінде белгілі болған, таза түрі 16 ғасырда алынған. Жер қыртысындағы массасы бойынша мөлш. 8, 3×10 -3 %. Ол полиметалды сульфид кендерінің құрамында кездеседі. Негізгі минералдары: сфалерит (мырыш алдамышы) және вюрцит, смитсонит, каламин, цинкит. Мырыш гексагональды тығыз қапталған торы бар күміс түсті ақ металл, тығызд. 7, 133 г/см 3 , балқу t 419, 5°С, қайнау t 906°С. Тотығу дәрежесі +2. Ылғал ауада және суда 200°С-қа дейін тұрақты, тотығуға гидроксикарбонатты беттік пленкасы кедергі жасайды; қышқылдар және сілтілермен, аммиак және аммоний тұздарымен, ылғал күйіндегі Cl 2 , Br 2 -мен, қыздырғанда О 2 -мен әрекеттеседі. Құрамында М. бар концентраттарды күйдіріп, әрі қарай алынған күйдіргіні Н 2 SO 4 -пен сілтісіздендіру және ZnSO 4 ерітіндісінен Мырышты электрлік тұндыру арқылы алынады. Мырыш жез, нейзильбер, томпак, тағы басқа қорытпалардың құраушысы; болат және шойынды мырыштау үшін (бұл кезде коррозияға қарсы қаптама түзіледі), ұшақтар мен автомобильдердің майда бөлшектерін, химиялық ток көздерінің электродтарын жасауда, күміс пен алтынды қорғасыннан бөлуде қолданылады.
Мырыш қосылыстары - мырыш элементі түзетін химиялық қосылыстар. Мырыштың оттекті қосылыстарының маңыздысы мырыш (ІІ) оксиді ZnO - түссіз кристалл, балқу t 1975ӘС. Су, спирт, эфирде ерімейді, ал қышқылдарда, сілтілерде ериді. Табиғатта “цинкит” деген атпен белгілі. ZnO - мырыш буларын ауада немесе оттекте жағу және табиғи ZnS-ті күйдіру арқылы алынады. Ол бояғыштарда ақ пигмент (мырыш әгі), электроникада шала өткізгіш материал ретінде, тағы басқа мақсаттарда қолданылады. Мырыш гидроксиді Zn(OH) 2 - мырыштың ерігіш тұздары мен сілтілер арасындағы реакцияда түзіледі. Ол ақ түсті тұнба, қышқылдар және сілтілерде ериді. Аммиак ерітіндісінде еріп, кешенді қосылыстар түзеді. Мырыш тұздарының маңыздылары: ZnS, ZnCl2, ZnSO4, Zn(СН3CОО) 2. Мырыш сульфиді ZnS - түссіз кристалл, балқу t 1775ӘС, суда ерімейді, қышқылдар әсерінен ыдырайды, литопон деген ақ бояу құрамына кіреді. Табиғатта сфалерит (мырыш алдамышы) және вюрцит минералдары түрінде кездеседі. ZnCl2 немесе ZnSO4 ерітінділерінен натрий немесе аммоний сульфидімен тұндыру арқылы алынады. Шала өткізгіш материал ретінде, тағы басқа қолданылады. Мырыш хлориді ZnCl2, түссіз кристалл, балқу t 318ӘС, қайнау t 732ӘС, суда (20ӘС кезінде 100 г-да 367 г), суда, спиртте, эфирде ериді, өте гигроскопты. Мырыш сульфидін (ZnS) натрий хлоридімен (NaCl) қыздыру және тұз қышқылын Zn, ZnСО3 немесе ZnО-мен әрекеттестіру арқылы алынады. Ол негізінен қағаздарды ағартуда, улағыш ерітінділердің құраушысы ретінде, ағашты шіруден сақтау мақсатында қолданады. Мырыш сульфаты ZnSO4 - түссіз кристалл, суда ериді (20ӘС кезінде 100 г-да 54, 1 г) . Ерітінділерден мырыш купоросы (ZnSO4⋅7Н2О) түрінде кристалданады. Zn немесе ZnO-ін Н2SO4-пен әрекеттестіру арқылы алынады. Мырышты электролиз арқылы алуда және мырыштауда электролит құраушысы, матаны бояуда улағыш, флотореагент, микротыңайтқыш ретінде, тағы басқа қолданылады. Мырыштың тағы бір маңызды қосылысы мырыш ацетаты Zn(СН3CОО) 2 - балқу t 235 - 237ӘС кристалл, суда (20ӘС кезінде 100 г-да 30 г немесе 100ӘС-та 44, 6 г), спиртте ериді. Ол Zn немесе ZnО сірке қышқылымен әрекеттескенде алынады. Органик. синтез өнеркәсібінде - катализатор ретінде, медицинада, тағы басқа қолданылады. Мырышорганикалық қосылыстар - құрамында Zn-С байланысы бар қосылыстар. Негізгі типтері: R2 Zn, RZnНаl. Олардың Аlk2Zn қосылысы - сұйық, Аr2Zn - кристалл, RZnHal - балқымайтын ақ зат, органик. еріткіштерде ериді. Аlk2Zn (С4-ке дейін) - ауада өздігінен жанады; су, спирт, қышқылдар және аминдермен қарқынды әрекеттеседі. Оны ZnHal2-ні магнийорганик. қосылыстармен (немесе Ar2Hg) не алкилгалогенидтерді Zn-Сu қорытпаларымен әрекеттестіру арқылы алады. [1]
Мырыш - Д. И. Менделеевтің периодтық системасындағы екінші топ элементі, реттік номері 30 және атомдық массасы 65, 38. Мырыш - латын тілінен аударғанда «ақ» деген мағынаны береді. Металды мырыш көкшіл-ақ түсті болады. Оның балқу температурасы 419, 5 0С, қайнау температурасы 905, 4 0С. Мырыш гексоганальді жүйеде кристалданады. Құйылған металдың тығыздығы 7, 13 г/см3, ал балқыған металл тығыздығы 6, 92 г/см3 болады.
Мырыштың пластикалық қасиеті температураға байланысты өзгереді. Мырыш бөлме температурасында омырылғыш, ал 100-150 0С-да созылмалы және жеңіл беттерге жайылады. (0, 05 мм дейін) 250 0С температурада ол қайта механикалық өңдеуге жарамсыз болады.
Мырыштың көп мөлшері (40%) - құбырларды, сымдарды және де басқа металл өнімдерін мырыштауға шығындалады. Өйткені мырыш темірді коррозиядан жақсы сақтайды.
Мырыш - латунь және бронзы балқымаларын алу үшін қолданады. Тағы құрылыс материалдар ретінде, құрғақ батарей дайындау үшін пайдалынады. Мырыштың химиялық қосылыстары резина, пластмасс, бояу, қағаз т. б өндірістерде қолданады.
Табиғаттағы мырыш
Табиғатта 60-қа жуық мырыштың минералдары белгілі. Ең көп таралғаны мырыштың күкіртті және оттекті қосылыстары. Олардың ішіндегі өнеркәсіпке қажетті минералдары: сфалерит немесе мырыш алдамшысы (ZnS), марматит (mZnS*nFeS), смитсонит (ZnCO3), және (Н2Zn2SiO5) .
Мырышты минералды кендерде кадмий, индий, талий, галлий, күшән, қалайы, селен, сынап, висмут, кобальт, германи, алтын, күміс және тағы басқа элементтер болады. Бұл кендерде мырыш өте аз 0, 5-15%-дейін жетеді.
Барлық сульфитті мырышты кендерді флотациялық байытуға ұшыратады, кеннің құрамына байланысты мырышты, қорғасынды, мысты концентраттар алынады.
Бұл концентраттар 40% мырыш сонымен қатар 1, 5% қорғасын сульфиді және оксиді, 9, 5% темір, 1, 03% мыс, 0, 23% кадмий, 31, 3% күкірт, 0, 42% күшән.
2 Мыс және мырыш элементінің алыну мен қолданылуы 2. 1 Мыстың алынуы мен қасиеттеріМыс тағы да әр түрлі құймалар өндіруде қолданылады. Мыстың қосылыстары да кең түрде қолданылады, мысалы: мыс (ІІ) сульфатының кристаллогидраты (мыс купорасы) CuSO 4 ∙5H 2 O өсімдіктердің зиянкестері мен ауруларына қарсы күресте пайдаланылады: мыс (ІІ) гидроксиді Cu(OH) 2 органикалық қосылыстағы альдегидтік топты анықтау үшін тотықтырғыш ретінде қолданылады:
O O
CH 3 - C ∕∕\ +2Cu(OH) 2 □(→┴t ) CH 3 - C ∕∕\ + 2CuOH+H 2 O
H OH
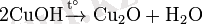
Қасиеттері
Физикалық қасиеттері
Мыс қызғылт-сары түсті, жұмсақ металл. Ауада жылдым тотығып, ашық қызыл-сары рең береді. Мыс жұқа түрінде көгілдір-жасыл түске ие. Мыс куб тәріздес көпбұрышты торшадан құралған. Кеңістікте тобын F m3m, a = 0, 36150 нм, Z = 4 құрайды. Мыс өте жоғары жылу және электр өткізгіштігімен(электрөткізгіштік-күмістен кейін 2 орында, 200С та өздік өткізгіштік 55, 5-58МСм/м) белгілі. Екі тұрақты изотобы бар. 63 Cu және 65 Cu. Бірнеше радиоактивті изотоптары да кездеседі. Ең көп сақталынатын изотобы 64 Cu, оның жартылай ыдырау периоды 12, 7 сағ. Бұл екі нұсқамен ыдырап, басқа заттар түзіледі. Мыстың әртүрлі құймалары белгілі: мырыш пен латун, қола мен қалайы, мельхиор мен никель, бабит пен қорғасын және тағы басқа.
Мыстың аналитикалық қасиеттері
Дәстүрлі түрде мыс әлсіз қышықыл ерітіндіден қышқылсутек көмегімен бөлінетін Ерітінділерде мыс және ионометриялық түрде анықталады. Ерітінділерде мыстың өте аз мөлшерде кинэтикалық тәсілмен анықталады.
Химиялық қасиеттері
Ауада ылғалсыз және диоксид көмірсутегі болмаған жерде өзгермейді. Су қосылған тұз . Оттегі қоспасының нәтижесінде ерітіндіге айналады. Мыс концентрленген күкірт және азот қышқылымен, патша арағымен, оттегімен, галогендермен, халькогендермен, металл еместердің оксидтерімен тотығады. Қыздыру нәтижесінде галогенсутектермен әрекеттеседі. Мыс ылғалды ауада негізгі мыс карбонатын(II) құрап, тотығады:
Табиғатта кездесуі
Мыс табиғатта таза және қосылыс түрінде кездеседі. Мыстың өндірісте қажеттілігі халькопирит CuFeS 2 немесемыс колчеданы халькозин Cu 2 S және борнит Cu 5 FeS 4 сияқты түрінде қолданылады. Сонымен бірге мыстың басқа да минералдары ковеллин CuS, куприт Cu 2 O, азурит Cu 3 (CO 3 ) 2 (OH) 2 , малахит Cu 2 CO 3 (OH) 2 түрінде кездеседі. Мыс кейде таза түрінде де кездеседі. Кейбір жерлерде 400 тоннаға дейін анықталған. Мыс сульфиттері негізінен орташа температураны гидротермальды жерлерде пайда болады. Мыстың кейбір бөліктері құмтөбелермен шөлдерде кездеседі. Бұндай жерлер Ресейде Чита облысында - Удокан кен орнында, Қазақстанның Жезқазғанында, Орталық Африканың мыс белдеуінде, Германияның Мансфельд кен орнында бар. Бұдан басқа мысқа бай ккен орындары Чилиде (Эскондида және Кольяуси) және АҚШ(Моренси) . Мыс рудасы көбіне ашық әдіспен өндіріледі. Ал рудадағы мыстың мөлшері 0, 3-1% ға дейін құрайды.
Зияндылығы
Мыстың кейбір қоспалары ас пен суда ШРК-сы көп болған жағдайда өте зиянды. Ішетін суда мыс 2 мгс/л-ден аспауға тиіс (14 күннің ішіндегі орташа өлшемі), бірақ мыстың судағы жетіспеушілігі де болмағаны дұрыс. Осыған байланысты ДСҰ 1998 жылы былай деп хабарлама жасады: «Адам ағзасына келтіретін кауіпі бойынша мыстың көптігінен аздығы асып түседі». 2003 жылғы ДСҰ-ның интенсивті тексеруі нәтижесінде мыстың зияндылығы туралы көзқарастарын өзгертті. Осыған байланысты асқазан жолдары қызметінің бұзылуына мыс әсер етпейді деп есептелінді. Гепатоцеребральды дистрофия (Вильсон-Коновалов ауруы) ағзада мыстың көптеп жиналуымен байланыстыпайда болатындықтан қорқыныш болатын. Өйткені оны бауыр өтке бөліп шығармайтын. Бұл ауру ми мен бауырдың зақымдануына әкеліп соғады. Бірақ та аурудың пайда болуына мыстың ағзаға қабылдануы туралы себеп-салдар қолдау таппады. Тек қана бұл аурумен ауырған адамдардың ас пен су құрамындағы мыстың көптігіне өте сезімталдығы ғана анықталды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz