Атом құрылысы: Резерфорд тәжірибелері, Ритц комбинациялық принципі және Бор-Зоммерфольдтің квантталу ережелері


қазақстан республикасының білім және ғылым министрлігі шәкәрім атындағы семей мемлекеттік университеті
сөж
Тақырыбы: Резерфорд тәжірибелері, Ритцтің комбинациялық принципі, Бор-Зоммерфольдтің квантталу ережелері.
Тексерген:
Орындаған: Қабышев Е. М.
Топ: т-323
2015ж.
Резерфорд тәжірибелері: Атомның алғашқы үлгілерінің бірін Дж. Томсон ұсынды. Бұл үлгіде атом радиусы ~10 −10 К) м оң зарядталған шар ретінде қарастырылады. Шардың ішінде тепе-теңдікжағдайының маңында электрондар тербеліп тұрады. Электрондардың теріс зарядтарының қосындысы шарға біркелкі таралған оң зарядты теңестіреді, сондықтан тұтас алғанда атом электрлік бейтарап бөлшек болады. Кейінгі зерттеулер бұл модельдің дұрыс емес екенін көрсетті, сондықтан Томсон моделі қазір тек тарихи тұрғыдан қарастырылады.
Атомның ішінде электр зарядтарының орналасу тәртібін анықтау үшін 1911 жылы Резерфорд өзінің шекірттері Г. Гейгер және Э . Марсденмен бірге альфа-бөлшектершоғын өте жұқа алтын фольгадан өткізіп, бірнеше тәжірибелер жасады. Осы тәжірибелерді зерделеу нәтижесінде атомның ядролық, басқаша айтсақ, планетарлық моделі өмірге келді.
Тәжірибенің нәтижесінде альфа-бөлшектердің басым көпшілігі фольгадан өткенде алғашқы бағыттан aуытқымайтыны (φ≈1-2°) анықталды. Бұл нәтиже, негізінен, Томсон моделіне сүйеніп жасалған есептеулермен дәл келді. Бірақ, альфа- бөлшектердің мардымсыз аз бөлігі 90°-тан артық бұрышқа ауытқитыны, яғни олар фольгаға соғылып, кері бағытта ұшатыны таңдандырды. Сегіз мыңға жуық бөлшектердің біреуі ғана осындай үлкен бұрышқа ауытқиды екен! Мұны Томсон моделі негізінде түсіндіру тіпті мүмкін болмады.
Тәжірибеде алынған нәтижелерді зерделей отырып Резерфорд өз моделін ұсынды. Ол атомның оң заряды оның ортасында орналасқан радиусы шамамен 10 −15 м өте аз көлемге жинақталған деген қорытындыға келді. Бұл орталық бөлшекті Резерфорд ядро деп атады. Атомның массасы түгел дерлік ядрода шоғырланған. Ядроныайнала әр түрлі орбиталармен электрондар қозғалып жүреді. Ең шеткі электрон орбитасының радиусы атомның радиусына тең, R a ≈10 −10 м. Бұл үлгі Күн жүйесініңқұрылымына ұқсайтын болғандықтан, оны атомның планетарлық моделі деп те атайды. Модель бойынша атом көлемінің басым көпшілік бөлігі "бос" болып шығады, ядроның радиусы атомның радиусынан 100 000 есе кіші. Орбиталардағы электрондардың теріс зарядтарының қосындысы ядроның оң зарядына тең, атом электрлік бейтарап.
Атомның ішіндегі бос кеңістік "өте үлкен". Сондықтан, фольга арқылы өткенде альфа-бөлшектерінің көбі ядродан алыс өтеді де, шашырамайды. Электрондар альфа-бөлшектен 8 мың еседей жеңіл болғандықтан, оның қозғалыс траекториясын өзгерте алмайды. Тек ядроға тікелей қарсы келіп қалған альфа-бөлшектер ғана онымен әсерлесіп, кері ұшады. Мұндай бөлшектер саны ядро радиусының атом радиусына қатынасымен анықталады.
Жоғарыда біз тәжірибеге тек сапалық талдау жүргіздік. Резерфорд сонымен қатар өз моделінің және Томсон моделінің негізшде есептеу жұмыстарын жүргізді, олардың нәтижесі Резерфорд үлгісінің дұрыстығын көрсетті. Бірақ классикалық физика тұрғысынан мұндай атомның орнықты болуы мүмкін емес. Бұдан бұрын айтылғандай, зарядталған бөлшек үдемелі қозғалса, міндетті түрде сәулеленуі (электромагниттік толқындар шығаруы) керек. Бұл сәулеленудің жиілігі электронның ядро маңында айналу жиілігіне тең болуы тиіс. Электрон ядроны айнала дөңгелек орбитамен қозғалса, оның центрге тартқыш үдеуі бар. Олай болса, электрон сәуле шығара отырып, өз энергиясын азайтуы тиіс. Энергияның (орбиталық жылдамдықтың) азаюы электронның ядроға кулон күшінің әсерінен біртіндеп жақындап, ақыры оған құлап түсуіне әкеп соғады. Бұған бар болғаны 10 −8 с-ка тең уақыт кетеді екен және классикалық теория бойынша мұндай атомның сәулелену спектрі тұтас болу керек, ал шын мәнінде атомдық спектрдің сызықтық болатынын алдыңғы тақырыпта айтып кеттік.
Сайып келгенде, бұл жерде классикалық физиканың заңдары жүрмейтін болып шықты. Тіпті жоғарыда әңгіме болған атомның планетарлық моделі, дәл айтқанда ол бар болғаны нағыз атомның механикалық үлгісі екеніне біртіндеп көзіміз жетеді. [1]
Атомдық-эмиссиялық спектрлердің теориялық негіздері . Біздің атом құрылымы жайлы түсінігіміз көбінесе жарық спектрлерін оқып-үйренуімізге негізделген. Сыртқы электрондық қабықшалар туралы мәлімет оптикалық спектр арқылы алынады, ал оның ішкі құрылымы жайлы мәлімет рентген спектрі бойынша тұжырымдалады. Зат тек өзінің қозуына жеткілікті энергияны қабылдағанда ғана сәуле шығара бастайды, яғни қоздыру энергиясы сәуле шығару энергиясына айналады. Қозу көбінесе жоғарғы температурада өзіне жеткілікті үлкен кинетикалық энергиясы бар атомдардын соқтығысуы кезінде пайда болады. Алайда атомдар қозуы ол жарықты сіңірген атомдардың электрондарымен соқтығысуынан да туындайды. Қоздырылған атомдардың шығарған жарығының дисперсиялық (латыншада - дисперсия - таралу, бытырау) ыдырауы эмиссиялық (эмиссия - шығару, шашылу) спектр береді. Әрбір зат үшін бір мезгілде үш түрлі спектр байқалады: сызықша. жолақша, тұтас. Сызықшасы әр түрлі элементтердің атомдары мен иондардың ішіндегі электрондар ауысуы нәтижесінде туындайды. Жолақты спектрлер молекулаға тән және ол молекуладағы электрондық тербелмелі және айналу энергиясының өзгеріс нәтижесі болып табылады. Кейде жолақты спектр құрылымын анықтау қиын болғандықтан, оны тұтас спектр ретінде қабылдайды. Мұндай тұтас немесе үзіліссіз фон қыздырылған газдарда әркез болатын бос электрондардың өзге ион маңынан өткенде, онымен әсерлесіп, өз жылдамдығын өзгертуі нәтижесінде пайда болады. Бұл жарық энергиясының сәуле шығаруына келтіреді. Оң зарядталған ионның электронды кармауы да энергияның сәуле шығаруына келтіреді. Сәуле шығарған бос электрондар энергиясының басқа да мәндері болуы мүмкін, өйткені бұл жағдайда атомдық жүйеге тән белгілі бір кванттық деңгейге және оған сәйкес болатын сызықты спектр жоқ. Демек, әркез сызықты және жолақты спектрмен қатар бос электрондар тудыратын үздікті спектр де болады. Сонымен қатар тұтас спектрдің сәуле шығаруынын басқа да механизмі, айталық, жарық кезіндегі (электродтар бөлшегі) қызған қатты бөлшектердің жарқырауы болуы мүмкін. Тұтас спектр түрлі қыздыру құралдарынан туындауы ықтимал. Спектрлік талдауда атомдық, ал кейде молекулалық спектр жиі пайдаланылады. Ал тұтас спектрлер әрқашан да бөгет болады.
Атомдар шығаратын сызықтық спектрде жіңішке спектр сызықтары серияларға топтастырылған. Бір серияның шегінде сызықтардың орналасуы белгілі бір заңдылыққа бағынады. Бірінші сериялы спектрлерін Бальмер (1885) сутек атомының спектрінен ашты. Жалпы алғандағы спектрлік сызықтың толқындық саны келесі қатынасқа бағынады:
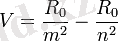
мұндағы R
0
- Рндберг тұрақтысы;
m және n - жай қатардағы бүтін сандар және n - m. Бір спектрлік серияның шегінде m - тұрақты сан және n-нің әрбір мәніне осы сериядағы бір сызық сәйкес келеді. Бұл эмпериялық тұрғыда сутек спектрінен табылған заңдылықты спектроскопиялық терм-Т деп аталатын түсінікте өрнектеуге болады:
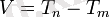
Кез келген молекула, атом немесе иондар үшін спектрлік сызықтардың толқындық саны екі спектроскопиялық терминнің айырмасы ретінде есептелінеді, әрбір атом көптеген серияларға жататын термнің белгілі мәні болады. Екі термнің айырмасы бір спектрлік сызықтың толқындық санын анықтайды (мұны Ридберг-Ритцтің комбинациялық принципі дейді) . Берілген атомдар (иондар) не молекулалар үшін спектрлік сызықтың жиілігінен гөрі спектроскопиялық терм тән. Спектроскопиялық термнің физикалық мәнін анықтағанда, жарық таралған кездегі атом энергиясының бір бөлігі сыртқа шығатын фотон энергиясына айналатынын ескеру кажет. Кванттық теория бойынша атом энергиясының шығыны мынаған тең: ΔЕ = (Е 1 - Е 2 ) . мұндағы Е 1 және Е 2 - бастапқы күйдегі атомның (сәуле шығару алдында) және соңғы күйдегі (фотон бөлініп шыққаннан кейінгі) сәйкес энергиялары:
hv = Е 1 - Е 2 ; v = 1/λ = v/c; v = E h /hc - E k /hc,
мұндағы v - жиілік; λ - толқын ұзындығы; с - жарық толқынының таралу жылдамдығы, ол см/с-ка тең; h - Планк тұрақтысы; v - толқындық сан, ол әдетте кері сантиметрмен орнектеледі (см −1 ) .
Соңғы екі өрнекті былай жазамыз:
E h /hc = T H және E h /hc = T K
Сөйтіп, спектроскопиялық терм белгілі бір күйдегі атомның (ионның, молекуланың) энергия өлшемі екен. Атом спектрлерінің сызықты болуы, атомның сәуле шығару энергиясының сіңірілуі басқаша емес, тек белгілі бір мәнде ғана екенін көрсетеді. Бұдан атомның кез келген мөлшерде энергияны шығармайтыны, бөліп бермейтіні, энергиялық ауысу тек белгілі бір дискрентті мөлшерде ғана жүретіні шығады. Байқалатын спектрлік сызықтың атомда кездесетін екі күйдегі энергияның айырмасы екенін ескерген жөн. Бұл тәсілмен кванттық күйдегі абсолют мәнін анықтау мүмкін емес. Осының салдарынан энергияны белгілі бір күйден бастап есептеу қабылданған, онда да бұл сәуле жарықтың шығарылуы мен сіңірілуіне себепші оптикалық электронның атомнан едәуір қашықтықта тұруына қарай болады. Мұндай күй - нөлдік санақ нүктесі. Ол температурасы Т 0 = 0 ионданған күй энергиясына сәйкес. Кванттық механика бойынша атомдағы әрбір электронда n, i, m, s кванттық сандармен сипатталатын белгілі бір энергетикалық күй болады. Паули принципі бойынша атомда барлық кванттық саны бірдей екі электрон кездеспейді. Атомдағы барлық электрондардың жиынтығы олардын барлық күйін біртіндеп жазу арқылы сипаттайтын электрондық қабықша пішімін құрастырады. Мысалы, натрий атомының электрондық құрамы 1s 2 2s 2 2p 6 3s 1 . Атомның бүкіл электрон жүйесіндегі энергия әрбір электронның кванттық санына сәйкес вектор қосындысы ретінде анықталатын L, S және I кванттық сандарымен сипатталады. Кез келген тұйықталған электрондық қабықша үшін (s 2 , p 6 , d 10 , f 14 ) жалпы орбиталдық момент L = 0. Әр түрлі мәндегі 0, 1, 2, 3 . . . атомның энергетикалық күйі үлкен әріппен белгіленеді: S, P, D, F, Q… Спиндік момент қосындысының шамасы термнің қайталануын анықтайды, олардың мультиплеттілігі: r = 2S + 1. Атомдағы электрондар қабықшасының жалпы моменті ішкі кванттық санымен анықталады, ал оның өзі L мен S векторлар қосындысы: J = L + S Спектроскопиялық термді кванттық тұрғыдан түсіндіру спектрлік атом құрылымын зерттеуде маңызды құралға айналды.
Атомда негізгі күйдегі электрондар мейлінше кіші энергияға ие болады. Осындай ансамбльдегі атом жарық көзі (доға, ұшқын, жалын) арқылы іске асатын қоздырылған күйіне көшкенде, соқтығысу процестері нәтижесінде бұл энергия барлық атомдар арасына тарайды. Соқтығысу жүргенде атомнан атомға ауысатын энергия мөлшері кең аралықта өзгеруі мүмкін. Нәтижеде қарастырып отырған ансамбльдегі атомдардың әрқайсысы әр түрлі қоздырылған күйде болады. Келесі энергияның шығуы жоғары жатқан энергетикалық деңгейде ғана емес, кез келген төменгі энергетикалық деңгейде жүруі мүмкін. Осы процестердің қорытындысында әр түрлі жиілікте жарықтың сәуле шығаруы болады. Сондықтан да элементтің атомдық эмиссиялық спектрі өте күрделі болуы мүмкін. Қоздырылған күйде болатын атомдар санына қатынасы Больцман формуласымен есептеледі:
N(m) N(n) = g(m) g(n) exp[-(E m -E n ) /kT]
мұндағы N(m), N(n) - n және m күйдегі атомдар саны, g(m), g(n) қарастырылып отырған күйдегі есептеулі салмақ, К - Больцман тұрақтысы.
Бұл теңдеуден жоғары қозу энергиясы термге ауысқанда, қозған атом саны] күрт кемитін көрінеді. Мұнымен қатар, әдетте, осы термдерден сәуле шығару ықтималдылығы азаяды. Осыған сәйкес спектрлік сериядағы бірінші сызы әркез айқын да, оның сәуле шығару интенсивтілігі ең жоғары мәнде болады. Атомның ең төменгі күйімен байланысты спектрлік сериялардың бірінші сызығы сәуле шығару (резонанс сызықтары) спектрлеріндегі ең айқыны. Спектроскопияда сәуле шығарғанда жалпы соңғы, ал сіңіргенде басталу күйлері бірдей спектрлік сызықтарды бір серияға жатқызады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz