Дәрілік препараттарды анықтауда комплексті қосылыстардың қолданылуы


Оңтүстік Қазақстан Мемлекеттік
Фармацевтика Академиясы

ФГЗ және химия кафедрасы
РЕФЕРАТ
Тақырыбы: Комплексті қосылыстар дәрілік препараттарды анықтауда қолдану.
Орындаған:Жанкозин Н. Ж.
Тобы: 204 «Б» ФК
Қабылдаған:Шыназбекова Ш. С.
Шымкент 2016 ж
Жоспар
I Кіріспе
II Негізгі бөлім
2. 1 Комплексті қосылыстардың құрылысы
2. 2 Комплексті қосылыстардың номенклатурасы
2. 3 Комплексті қосылыстардың изомериясы
2. 4 Комплексті қосылыстардың классификациясы
2. 5 Комплексті қосылыстардың биолгиялық маңызы
III Эксперименттік бөлім
Өмірге қажеттімаңызды комплексті қосылыстар
IV Қорытынды
Кіріспе
Комплексті қосылыстар деп - кристалдық күйде де, еріген кезде де құрамында бірнеше лиганд тобымен байланысқан орталық атомнан тұратын, комплексті ион деп аталатын құрылым түзетін күрделі химиялық қосылыстарды айтады.
Комплексті қосылыстар заттардың үлкен класын қамтиды, олар өндірістің әртүрлі салаларында кеңінен қолданылады. Мысалы, аналитикалық процестерде иондардыанықтау үшін, комплекс құрылу әдісі арқылы элементтердің түсті қосылыстар түзу мүмкіншілігін қолданады; металлургияда - металдарды бөлу және таза түрінде алу, электрохимиялық процесте - айналы тұнбалар алу және т. б.
Комплексті қосылыстар деп, кристалдық тордың түйіндерінде күрделі бөлшектер оналасқан, бір атомның (ионның) электронейтралды молекулаларды немесе әраттас зарядталған иондарды өзіне координациялау (тарту) арқылы құрылған және зат балқығанда немесе ерігенде өзінің күрделі құрылысын сақтауға қабілеті бар қосылыстарды айтады.
Комплексті қосылыстар жайындағы Вернердің жұмысы кординациялық теория деп аталады. ХХ ғасырдан бастап комплексті қосылыстарды жете тексерген көп теориялар бар, бұл салада үлкен еңбек сіңірген орыс ғалымдары Д. И. Менделеев, Н. С. Курнаков, әсіресе Л. А. Чугаев және академик И. И. Черняев.
2. 1 Комплексті қосылыстардың құрылысы
А. Вернер пікірі бойынша қосылыстарды бірінші ретті(қарапайым) және жоғары ретті деп екі топқа бөлуге болады. Жоғары ретті қосылыстар бірінші ретті қосылыстардың өзара бірігуі нәтижесінде түзіледі. Олардың кейбіреулері қатты күйінде де және еріген күйінде де тұрақты болады, ал енді біреулері қатты күйінде тұрақты болғанымен, ерітіндіде құрам бөліктеріне ыдырап кетеді.
Координациялық сан - ол орталық комплекс түзуші ионның айналасында координацияланатын лигандтар саны. Координациялық сан комплекс түзушінің тотығу дәрежесінен үлкен.
Координациялық сан комплекс түзуші мен лигандалардың табиғатына және өлшеміне тәуелді. Лигандының координациялық сыйымдылығы ол комплекстің ішкі сферасындағы орын саны. Бұл бос орында лиганда орналасады. Көптеген лигандалар үшін координациялық сыйымдыоығы 1-ге, өте сирек жағдайда 2-ге тең болады. CI
 , Br
, Br
 , I
, I
 , N H
, N H
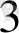
 , CN
, CN
 комплексте бір координациялық орынды алады және оларды монодентатты лигандалар деп атайды.
комплексте бір координациялық орынды алады және оларды монодентатты лигандалар деп атайды.
N
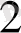 H
H
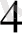 , аминосірке қышқылы, SO
, аминосірке қышқылы, SO

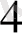 , CO
, CO
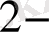
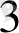 , этилендиаммин екі координациялық орынды алады және бидентатты деп аталады.
, этилендиаммин екі координациялық орынды алады және бидентатты деп аталады.
Кешен қосылыстарды зерттеп, олардың құрылысын, химиялық байланыс табиғатын және түзілу принциптерін түсіндіретін координациялық теорияны 1893 жылы швейцария химигі А. Вернер ұсынған. Бұл теория бойынша кешен қосылысы ішкі және сыртқы сфералардан тұрады. Ішкі сферасын тік жақшаның [ ] ішіне жазады және оның құрамына: комплекс түзуші (әдетте металл катионы немесе нейтралды атом) және оның айналасында лигандалар (латын сөзден "Ііgаrе" - байланыстыру) деп аталатын иондар немесе молекулалар орналасқан. Лигандалардың саны - координациялық сан (к. с. ) орталық комплекс түзуші атомның валенттілігімен анықталады.
Комплекс түзушінің табиғатына және валенттілігіне байланысты координациялық саны әдетте екі еселенген валенттілігіне тең, кейде одан аз болуы да мүмкін.
Cr+3, Fe+2, Fe+3, Ni+2, Ni+3, CO+2, CO+3, AI+3, Au+3, Nb+4,
Ta+4, Zr+4, Ge+4, Ti+4,
Комплекс түзушілерге d -f элементерге жататын ауыр металдар, сирек металдар және р-элементтердің металдары жатады: Мn, Сr, Ғе, Со, Nі және т. б.
Лигандаларға қышқыл қалдығы аниондары (ацидо-иондар) I-, СI-, Вr-, Ғ-, СN-, СNS-, NO2-, S2О32-, гидроксо-иондар ОН- т. б., сонымен қатар полюсті бейтарап молекулалар - NН3, Н2О, СО, NO т. б. жатады.
Комплекс ионның, яғни ішкі сфераның заряды, құрамына кіретін барлық иондар зарядтарының алгебралық қосындысы арқылы есептеліп табылады:
[Сr(NН3) 6] 3+ [НgІ4] 2-
+3+0*6=+3 +2-1*4=-2
Комплекс түзуші атомның тотығу дәрежесі нольге тең болуы
мүмкін. Карбонильді кешендерінде [Ni(СО) 4] және [Ғе(СО) 5],
никель(О) және темір (0) .
ВҒ3 + NН3 = [В(NH3) Ғ3]
Комплексті ион ретінде бейтарап бөлшек болуы мүмкін:
[В(NН3) Ғ3] - бейтарап кешен, В(ІІІ) - комплекс түзуші, NН3 және Ғ-- лигандалар, координациялық сан 4-ке тең, сыртқы сферасы жоқ.
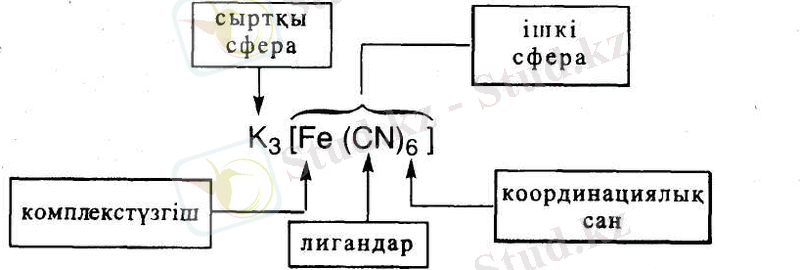
Комплекс түзушінің айналасына, соның әсері жететіндей жақындатқанда жиналған, яғни координацияланған иондары, не молекулаларды лигандтар (Iigare - байланыстыру), адденттер деп атайды. Міне, осылар (комплекс түзуші мен лигандар) бірігіп, коплексті қосылыстардың ішкі сферасын құрайды. Ішкі сфераға араласпай қалған иондар комплекс түзушіден аысырақ орналасады, олар комплексі қосылыстың сыртқы сферасын құрайды.
Ішкі сферадағы бөлшектер бірімен -бірі берік байланысқан, оны комплексті ион немес комплекс деп атайды; олар ерітіндіде немесе балқыған кезде өзінің иондық ерекшелігін сақтайды. Комплексті қосылыстардың формуласында координациялық сфера (ішкі сфера) квадратты жақшаға алынады.
K4[Fe(CN) 6] ↔︎4K++[Fe(CN) 6] 4-
Периодтық жүйедегі d-элементтер комплекстзгіштерге жатады.
Маңызды лигандаларға мыналар жатады:
а) дипольды қасиеттері бар бейтарап молекулалар: Н2О, NH3, NO, CO
б) иондар: CN-, NO2-, CI-, Br-, I-, OH-, CO32-, S2O32-
Комплекс - түзгіш валенттілікпен (зарядымен) сонымен қатар, ішкі сферада өзімен байланысқан, лигандалардың мөлшерін көрсететін кординациялық санмен сипатталады.
Комплексті қосылыстың ішкі сферасының сыртында орналасқан иондар сыртқы кординациялық сфераны құрайды. Сыртқы сфераның иондарына металдардың, қышқыл қалдықтарының иондары және т. б. жаьады.
Мысалы, комплексті қосылыста K4[Fe(CN) 6] 4K+ - сыртқы сфера; [Fe(CN) 6] 4 - ішкі сфера немесе комплексті ион.
Косплексті ионның заряды керісінше белгімен алынған сырқы координациялық сферада орнаасқан иондардың зарядынан қосындысына тең. Мысалы, K4[Fe(CN) 6] төрт К+ ионы бар, жалпы заряды +4, [Fe(CN) 6] 4 - ионының заряды -4 тең.
Комплекстүгіштің заряды керісінше таңбамен алынған, сыртқы сферада орналасқан иондардың және лигандалар зарядының алгебралық қосындысына тең. Мысалы, K[Fe(CN) 6] темір ионының заряды -(-6+4) =+2 тең, яғни 6CN- және 4K+ зарядтарының керісінше таңбамен алынған қосындысына тең.
Кейбір комплексті қосылыстарда сыртық сфера болмайды - олардың ішкі сфераға кіретін иондарының теріс заряды, комплекс - түзгіштің оң зарядына тең.
Мысалы: [Pt(NH3) 2CI4] [Co(NH3) 3CI3] және т. б. Кейбір жағдайларда комплекс-түзгіш пен игадалар зарядталмаған бөлшектерден тұрады, мысалы, [Fe(Co) 5] .
Қазіргі кезде комлексті қосылыстардағы байланыстың табиғатын қарастыратын үш теориялық әдіс бар: валенттік байланыс әдісі, кристалдық өріс теориясы, молекулалық орбитальдар әдісі.
Комплексті қосылыстарды атау барысында оның лигандалардың аталуына басты назар аударылады. Теріс зарядты лигандалар сол ион атауына «о» әріпін қосу арқылы жасалады (1-кесте) . Ал, оң зарядты лигандаларға «ий» жалғауы (NO+ - нитрозилий, NO2+ - нитроилий) жалғанады.
Бейтарап молекулалар үшін дәстүрлі кең тараған атаулары пайдаланылады. Бейтарап және радикал ретінде (метил, фенил т. с. с. ) қабылданған лигандалар атауына ештеңе жалғанбайды. NH3 - аммин деп аталады.
Лигандалардың аталуы
Кең тараған кейбір лигандалардың аталуы:
H2O 0
аква
CO 0
карбонил
NH3 0
аммин
Комплексті қосылыс құрамында бірнеше түрлі лигандалар қатар келген жағдайда, ағылшын-американдық басылымдарда оларды алфавит жүйесінде орналаасуына қарай атау жүргізіледі.
Бұл ереже орыс тіліндегі оқулықтармен сәйкес келе бермейді. Осы тұрғыда IUPAC жүйесінде бинарлы қосылыстарды жазу, лигандаларды орналастыру барысында электртерістілік мәнінің азынан өсу ретіне қарай орналастырған болатынбыз, сондықтан осы жағдайды назарла ұстаған жөн.
Комплексті қосылыстарды атау барысында - комплексті қосылыстың катионына басымдылық беріледі.
Комплексті бөлшек үшін лигандалар аталуы жазылу ретіне кері, электртерістілігі жоғарысынан төменіне қарай айтылады.
Катион аталып біткен соң, орталық комплекстүзгіш атомның тотығу дәрежесі рим санымен жақша ішінде көрсетіледі де, ілік септігі жалғауында анион айтылады.
Мысалы: [Co(NH3) 5CI] CI
Мұндағы, катион [Co(NH3) 5CI] 2+ - комплексті бөлшек.
Комплексті бөлшек құрамындағы лиганда NH3 - бейтарап молекула, ал хлор теріс зарядты ион. Қосылыс былайша аталады: хлоропентааммин кобальт (ІІІ) -тің хлориді.
Комплексті катион бірінші айтылады. Ал, лигандалар аталуында электрлік терістіліктің кему реті сақталады (СІ → NH3)
Лигандалар санын көрсетуде латынның моно (1) ; ди (2) ; три (3) ; тетра (4) ; пента (5) ; гекса (6) ; гепта (7) ; окта (8) ; нона (9) ; дека (10) ; дидека (11) және додека (12) тіркестері пайдаланылады.
Егер, лиганд құрамы күрделі болса, онда бис (2) ; трис (3) ; тетракис (4) қосымша тіркестері пайдаланылады.
Мысалы:
Fe(C2C6H5) 2 (CO) 4 - тетракарбонил бис (фенилэтинил) темір (ІІ) .
K4[Ni(C2C6H5) 4] - калийдің тетракис (фенилэтинил) николаты (0)
[Co (NH2(CH2) 2NH2) 2(NO2) 2]
Мұндағы, лиганданың біреуі этилендиаминді атау барысында ди - тіркесі пайдаланылды және осы лиганданың комплекс құрамына екеуі кіріп тұр. Демек, бұл қосылыс былайша аталады: динитритобис (этиилендиамин) кобальт (ІІ) .
Fe(C5H5) 2 - бис (циклопентадиенил) темір.
3. Комплексті бөлшек анион болып келсе, орталық комплекстүзгіш атомға «ат» жұрнағы жалғанады да, тотығу дәрежесі рим санымен жақша ішінде көрсетіледі.
Комплексті бөлшек катион түрінде келсе, комплекстүзгіш сөз соңының алдында тотығу дәрежесі рим санымен жақша ішінде көрсетіледі. Аталу барысында ретімен лиганд анион, лиганд молекула, комплекстүзгіш атом, тотығу дәрежесі және сөз соңында анион айтылады.
Мысалы:
NH4[Cr(NH3) 2(SCN) 4] - аммонийдің тетрароданидодиаммин хроматы (ІІІ) .
[Co(NH3) 5CI] CI2 - хлоропентааммин кобальт (ІІІ) хлориді.
Комплексті анион SCN- түрінде роданидті (тиоцианат), ал NCS- изородонидті (изотиоцианит) деп аталады.
Катионды комплексті қосылыстардың аталуына мысалдар:
[Fe(H2O) 5Cl] (ОН) 2
хлоропентаакватемір(III) гидроксиді
[Co(NH3) 5SO3] NO3
(III) нитраты
Комплексті аниондарды атауға мысалдар:
[Zn(OH) 4] 2- тетрагидроксоцинкат-ионы
[Ag(S2O3) 2] 3- ди(тиосульфато) аргентат(I) -ионы
[Cr(CN) 6] 3- гексацианохромат(III) -ионы
[Al(H2O) 2(OH) 4] - -ионы
[Co(NH3) 2(NO2) 4] - (III) -ионы
[Fe(H2O) (CN) 5] 3 - пентацианоакваферрат(II) -ионы
Бейтарап комплексті бөлшектердің аталуына мысалдар:
ИЮПАК жүйесінде комплекстүзгіштің тотығу дәрежесі рим санымен жақша ішінде көрсетілсе, координация ілімінің негізін қалаушы Вернер ұсынысы бойынша тотығу дәрежелері жұрнақ арқылы ескерілген болатын, яғни:
Комплекстүзгіштің тотығу дәрежесі +1 +2 +3 +4 +5 +6 +7 +8
Жұрнақ түрі - а -о -и -е -ан -он -ин -ен
Мысалы: [Ag(NH3) 2] + - диаммин аргента - ион
[CoSCN] + - монороданокобальто - ион
[SbCI6] - гексахлоростибанат - ион
2. 2 Комплекстік анион үшін де ілік септігі жалғауында катион аталады да 1. 1 - ереже сақталады.
Мысалы:
К3[Co(NО2) 6] катионы калий, ал анионы [Co(NО2) 6] 3-
Аталуы: калийдің гексанитрокобальтаты (ІІІ) .
Na2[CuBr2CI2] - натрийдің дихлородибромокупраты (ІІ)
Лигандалары бейтарап комплекстүзгіш атом үшін, лиганда санымен комплекстүзгіш атом аталады.
Ni(CO) 4 - никельдің тетракарбонилі.
Анион да, катион да комплексті бөлшек болып келген жағдайда анион - катионның анықтауышы болады, яғни катион бірінші айтылады. Мұнан соң кәдісгі бинарлы қосылыстардағыдай анион айтылады. Мысалы:
ZnCI2 - мырыш (катион) хлориді (анион) . Дәл осылай,
[Pt(NH3) 4] [PtCI4] - тетраамминплатина (ІІ) -нің тетрахлорплатинаты (ІІ) . Орысша: тетрахлорплатинат (ІІ) тетраамминплатины.
[CIF2] [SbF6] - дифторохлор (ІІІ) -тің гексафторостибаты (V) . Орысша: гексафторостибат (V) дифторохлора (ІІІ)
[Co(NH3) 6] [Cr(CN) 6] - гексаамминкобальт (ІІІ) -тың гексацианохроматы (ІІІ) . Орысша: гексацианохромат (ІІІ) гексаамминкобальта (ІІІ) .
Көпядролы лиганда көпіршесі арқылы байланысқан комплексті қосылыстар атауы.
Егер, байланыстырушы лиганданың екі жанындағы комплекстүзуші атоммен лигандалар бірдей, яғни симметриялы болып келсе, атауды қысқа түрде де келтіруге болады.
Мысалы: К4[(ox) 2Co(OH) 2Co(ox) 2] - калийдің ди (µ - гидроксо) бис (диоксолато) кобальтаты (ІІІ) .
Қосядролы комплексті қосылыстар үшін де жжоғарыдай атаулар пайдаланылады.
Мысалы:
[Co2(NH3) 8(NH2) NO2] (NO3) 4 - (ІІІ) -тің нитраты.
K2[CI4Re - ReCI4] - калийдің - бис (тетрахлорренаты (ІІІ) ) .
K4[Co2(ox) 4(OH) 2] - калийдің (ІІІ) .
Кластерлер аталуы. Комплекс түзуші атомдар өзара тікелей байланысып келген көпядролы қосылыстар клаастерлер деп аталады. Қарапайым кластер формуласы:
[(L) M - M(L) ] .
Мұндағы: L - лиганд, М - комплекс түзуші элемент.
Мысалы: [(Co) 5Re - Mn (Co) 5] - пентакарбонилмарганец - пентакарбонил рений (Mn- Re) .
2. 3 Комплексті қосылыстардың изомериясын төмендегідей түрде жіктеуге болады.
2) Гидраттық изомерия - су молекуласының комплекс құрамында CrCl3 6H2O формуласы мен өрнектелетін кристалогидраттық күлгін, күлгін - жасыл түсті үш изомериясы бар. Күлгін түсті изомердегі барлық су молекулалары ішкі сферада орналасқан, ал күлгін - жасыл және жасыл түсті измерлердебір және екі из молекулалары сыртқы сферада орналасқан.
[Cr(H2O) 6] Cl3 [Cr+3(H2O) 5Cl] Cl2*H2O [Cr(H2O) 4Cl2] Cl2*2H2O
күлгін күлгін - жасыл жасыл
Бұл изомерлердің судағы ерігіштіктеріне - иондарын қосқанда күлгін түсті изомердің ерітіндісінде үш хлор ионы күлгін жасыл түсті изомерлердің ерітіндісінде екі хлор ионы, ал жасыл түсті изомердің ерітіндісінде бір ғана хлор ионы тұнбаға түседі.
3) Иондық изомерия - комплексті қосылыстың ішкі және сыртқы қабатындағы ион лигандалардың орналасуымен өзгешеленеді.
Изомерия деп аталатын құрамы және молекулалық массасы бірдей, ал молекулалық құрылысы, химиялық және физикалық қасиеттері әртүрлі қосылыстар болатын құбылысты айтады.
Изомерия құбылысы комплексті қосылыстарда өте кең тараған.
Иондық изомерия - аниондардың ішкі сфера мен сыртқы сфераға әртүрлі таралуынан болады.
CoBrSO4*NH3 -ң қызыл-күлгін және жасыл түсті екі изомері бар.
Қызыл - күлгін түсті изомерлердің ионы сыртқы сферасында болады, ал қызыл түстіде ион ішкі сферада болады.
[Cо(NH3) 5Br] SO4 [Cо(NH3) 5SO4] Br
Қызыл - күлгін қызыл
Құрамы бірдей, бірақ сулы ерітіндіде әртүрлі иондарға диссоциац-н қосынды иондық изомерия деп аталады.
[Cо(NH3) 5Br] SO4 [Cо(NH3) 5Br] 2++ SO42-
[Cо+3(NH3) 5SO42-] Br [Cо+3(NH3) 5SO42-] ++Br -
Қазіргі кезде, иондық изомерияға жататын көптеген изомерлер белгілі. Мысалы,
[Pt(NH3) 4Сl2] Br2 [Pt(NH3) 4Br2] Cl2
[Pt(NH3) 4SO4] (OH) 2 [Pt(NH3) 4(OH) 2] SO42-
[Cо(NH3) 5NO3] SO4 [Cо(NH3) SO42-] NO3
[Cо(NH3) 4ClNO3] Cl [Cо(NH3) 4Cl2] NO3
4) Тұздық изомерия. Лигандалары - бейорганикалық заттар, бірақ құрылысы бірдей заттарды тұздық изомерия деп аталады.
Мысалы, оған кобальттық катионды тұзы [Cо(NH3) 5NO2] x және кобальттық изооксан тотұзы [Cо(NH3) 5NO3] x жатады.
Ксантотұздар нитроқосылыстарға R-NO2 сәйкес келсе, ал изооксантотұздар нитритті эфирге сәйкес келеді. R-O-N=O
5) Байланысу изомериясы ( тұздық изомерия) - комплесті атоммен меганданың құрамындағы атомдардың байланысу реті бойынша өзгешеленеді. Мысалы, NO2- лигандасы азот атомы арқылы байланыс түзсе нитро, ол оттегі атомы арқылы байланыс түзсе нитрито - изомерлі қосылыстар түзіледі. NO2- (ONO-) нитро (нитрито)
[Cо(NH3) ONO] [NO3] 2 - нитритопетаамин кобальт (ІІІ) нитраты
[Cо(NH3) 5NO2] [NO3] 2 - нитропентаамин кобальт (ІІІ) нитраты
Ксантотұздар сары түсті және минералды қышқылдарымен ыдырамайды. Ал, изоксантотұздар түсі - ақшыл қоңыр және минералды қышқылдардың әсерінен азотты қышқылды HNO2 бөліп ыдырайды. Азотты қышқылдардың түзілуі O-N=O тобының бар екендігін көрсетеді. Сондықтан изоксанто тұздардың түсі ақшыл - қоңыр түсті болады. Шындығында да азот арқылы байланысқан. Кобальттың барлық қосылыстарының түсі сары.
6) Координациялық изомерия - екі түрлі лигандтардың екі комплестүзушінің айналасына әртүрлі болады. Мысалы:
[Cr(NH3) 6] [Cо(CN) 6] [Co(NH3) 6] [Cr(CN) 6]
I II
І - изомерде Co3+ - тың айналасына аммиак молекулалары, ал ІІ - изомерде CN- аниондары координацияланған.
2. 4 Комплексті: қосылыстар үшін жіктеудің бірнеше жүйесі бар.
1. Қосылыстарды белгілі кластарға жатуы бойынша былай бөлінеді:
А) комплексті қышқылдар - H2 [SiF6], H [AuCl4] ;
Б) комплексті негіздер - [Ag (NH3) 2] OH, [Co (En) 3] (OH) 3;
В) комплексті тұздар - K2 [HgJ4], [Cr (H2O) 6] Cl3
Лигандтардың табиғаты бойынша:
K3 [Al (OH) 6]
Na2 [Zn (OH) 4]
K4 [Fe (CN) 6]
K2 [HgJ4]
Na3 [Co (NO2) 6]
Бейтарап молекулалар:
CO, NO, H2O, NH3 т. б.
[Ag (NH3) 2] Cl
[Cu (NH3) 4] SO4
[Co (H2O) 6] SO4
[Cu (H2O) 4] (NO3) 2
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz