Мырыш(II) және кадмий(II) унитиолатты комплекстерінің термиялық ыдырауы: кинетика, термодинамика және түзілу өнімдерінің жартылайөткізгіштік қасиеттері


ӘДЕБИЕТТІК ШОЛУ
1. 1 II топ металл иондарының құрамында O, S, N- бар төменмолекулалы лигандтармен комплекстүзуі
2. 1 Келешектің көкжиегі нанотехнологияның дамуы мен жетістіктері
1. 2 Құрамындағы күкірт бар лигандаларының металдармен координациялық қосылыстар термолиз зерттеудің қазіргі жағдайы.
2 ЭКСПЕРИМЕНТТІК БӨЛІМ
2. 1 Зерттеу әдістерінің сипаттамасы
2. 2 Кинетикалық параметрлерді есептеу
3 НӘТИЖЕЛЕР ЖӘНЕ ОНЫҢ ТАЛҚЫЛАУЛАРЫ
3. 1 Мырыш (ІІ) және кадмий (ІІ) унитиолатты комплекстерінің термиялық ыдырау реакциялардың термодинамикасы
3. 2 Мырыш (ІІ) және кадмий (ІІ) унитиолатты комплекстерінің термиялық ыдырау реакциялардың кинетикасы
КІРІСПЕ
Өзектілігі.
Қазіргі заманда координациялық химияның дамуының маңызды бағыты - органикалық лигандалар мен металл комплексті қосылыстардың термиялық ыдырауы, құрамында күкірт бар лигандалармен. Осындай органикалық лигандаларының бірі-унитиол натрий
2, 3-, қазіргі уақытта оны әртүрлі техника мен ғылым облыстарында қолданылады, нақты айтқанда бағалы минералдарды селективті еріту үшін гидрометалургияда, рудаларды байытқанда жинағыш фотореагент ретінде, аналитикалық химияда жасырыну реагент, гальваникада, медицинада антидот ретінде қолданылады. Металл иондарымен комплексті қосылыстарының унитиолын жан-жақты зерттеулі теориялық мәнді мәніне қарағанда практикалық маңыздылығы жоғары. Металл унитиолатты комплекстерінің термиялық тұрақтылықты зерттеу практиканың негізі болып табылады, себебі кинетикалық параметрлерді білуі термиялық ыдырау процесінің химизміне көз ашады, ол күрделі гетерогенді және көп сатылы процесс болып табылады. Бұрын белгілі және жаңа металл унитиолатты комплексті қосылыстарының термиялық тұрақтылықты зерттелуі олардың қосымша қасиеттері және құрылысы туралы мәліметтер береді. Әдебиеттерде металл унитиолатты комплекстерінің термиялық ыдырау процестер және термиялық тұрақтылық туралы берілген мәліметтер шектеулі. Металл унитиолатты комплекстерінің термиялық ыдырау өнімдері жартылайөткізгіш фаза болуы мүмкін және маңызды практикалық қосымша мәнісі бар. Бұл жұмыс мырыш кадмий унитиолатты комплексінің термиялық ыдырау процестерін зерттеуге арналған.
Қазіргі замандағы химияның жартылайөткізгіштің маңызды міндеті эффективті материалды алу үшін жаңа жолдарды іздестіру. Олардың оптикалық, электрофизикалық және басқа өзіне тән қасиеттерімен негізделеді. Жай, арзан, эффективті синтез әдісін құру үшін, алдын-ала берілген қасиеттерімен жаңа жартылайөткізгіш фазалар синтездің ғылыми негіздерін өндеу керек. Егер металл унитиолатты комплексінің ыдырау жолымен жартылайөткізгіш қосылыстарды алатын болсақ, қоспалар бар болуымен және стехиометриялық құрамы бұзылуы, жартылай өткізгіштің түзілуі маңызды мән береді, себебі сапалық, мөлшерлік құрамымен, әр түрлі табиғатымен сипатталатын заттардың түзілуімен қатты дене-газ фаза шекарасындағы бөлікте ағатын жоғарыда көрсетілген ыдырау процесі көп сатылы және күрделі гетерогенді процесс болып табылады. Осындай жағдайларда қоспалар бар болуымен әр түрлі кристалдық тордың бұрмалауы, түрлі стехиометриялық құрамымен және электрофизикалық, оптикалық қасиеттерімен сипатталатын жартылайөткізгіштің қосылыстарын алуға болады.
Зерттеудің мақсаты мен міндеттері.
Осы жұмыстың мақсаты
мырыш(ІІ) және кадмий(ІІ) унитиолатты комплексінің термиялық ыдырау процесінің кинетикалық және термодинамикалық заңдылықтарын зерттеу.
Осы мақсаттарға сәйкес келесі міндеттер қойылды:
- термолиз процесінің кинетикасын зерттеу;
- термолиз процесінің термодинамикасын зерттеу;
- термодинамика және кинетика сиапаттамалары арасындағы өзара байланысын анықтау;
Зерттеу объектісі: мырыш(ІІ) және кадмий(ІІ) унитиолатты комплексті қосылыстар және термиялық ыдыраудың өнімдері.
Зерттеу пәні: мырыш(ІІ) және кадмий(ІІ) унитиолатты комплексінің термиялық ыдырау процестер.
Жұмыстың жаңашылдығы: мырыш(ІІ) және кадмий(ІІ) унитиолатты комплекстерінің термолизінің нәтижесінде сульфидтер және оксидтер түзіледі. Зерттеулер бойынша металл сульфидінің жартылайөткізгіштік қасиеттері бар. Соңғы жылдарында жартылайөткізгіштер жаңа техникада маңызды материал болып табылады. Жартылайөткізгіш - бұл тоқтың электронды механизмен бейметалл өткізгіштері. Олардың металдармен ұқсастықтары бірдей электронды механикалық өткізгішке жатады. Жартылайөткізгіш және металл арқылы электр тоғының ұзақ жүруі олардың физикалық және химиялық қасиеттерін өзгертпейді.
Жұмыстың тәжирибелік маңыздылығы. Қатты фазадағы координациялық қосылыстардың түзілу термиялық химизмді түсіну үшін жұмыста алынған эксперименттік және есептеулер мәліметтері металл мен унитиол комплексті қосылыстар химиясында үлкен үлес болып табылады. Металл унитиолатты комплексінің термолиз процесінің кинетика және термодинамикасын зерттеу нәтижесінде алынған мәліметтер анықтамалықтар ретінде қолданылуы мүмкін. Жұмыста мырыш(ІІ) және кадмий(ІІ) унитиолатты комплекстерінің ыдырау үрдістерінің химизмі зерттеліп көрсетілген.
Жұмыстың құрылымы. Дипломдық жұмыс беттен тұрады. Жұмыс кіріспеден, екі эксперименттік бөлімнен, қорытындыдан, пайдаланған әдебиеттер тізімінен тұрады. Жұмыста 12 суреттер және 8 кестелері келтірілген.
ӘДЕБИЕТТІК ШОЛУ
1. 1 II топ металл иондарының құрамында O, S, N- бар төменмолекулалы лигандтармен комплекстүзуі
Периодтық жүйедегі II топта бериллий және магний типтік элементтерімен бірге, кальций және мырыш топшасындағы металдар орналасқан. Барлық элементтерге +2 тотығу дәрежесі тән.
Периодтық жүйедегі II топтың негізгі топшасында орналасқан элементтердің негізгі сипаттамалары Ве - Ra қатарында заңды өзгереді, яғни атомдық және иондық радиустары өседі, иондану потенциалы төмендейді, атомдық массалары өседі, “металдық” және қышқылдық-негіздік қасиеттері артады [1] .
М 2+ - лиганд тәрізді иондық байланыс түзуін, бериллий және осы топтағы басқа барлық металл катиондары үшін қатаң, инертті газ типті аз деформацияға ұшырайтын электрондық қабаты бар болуымен түсіндіруге болады. М 2+ ионында лигандтпен донорлы-акцепторлы байланыс түзуге “бос” энергетикалық ұяшығы және де π-дативті байланыс түзуге электрон жұбы жоқ. Осыған байланысты, осы топтағы элементтердің комплексты қосылыстары ион-иондық немесе ион-дипольды әрекеттесу арқылы түзіледі. Сондықтан Ве 2+ - Ва 2+ қатарында, өзінің мөлшерінің кішкентай және заряд тығыздығының үлкен болуына байланысты, Ве 2+ ионының комплекстүзгіш қасиеті жоғары екенін айтуға болады. Ең тұрақсыз комплекс түзетін Ва 2+ ионы болып келеді [2] .
Ве 2+ ионы әртүрлі комплекстүзгіш лигандтармен құрамы, құрылымы және тұрақтылығы әртүрлі комплекстер түзеді [3] .
Be 2+ ионның уыттылық болуы, тығыздығы жоғары оң зарядтың болуына байланысты. Бұл қасиетіне сәйкес Be 2+ ионы барлық лигандтармен комплексты қосылыс береді. Комплекстердің тұрақтылығы, ең алдымен лигандтың донорлы атомының табиғатымен анықталады. Лигандтың донорлық атомы ретінде келесі элементтер жатады (электртерістігі өсу қатарында орналасқан) : As, P<C, Sc, S, J<Br<N, Cl<O<F. Екінші топ металл иондары, әсіресе Be 2+ , Пирсон бойынша қатаң қышқылдар, яғни олар осы қатардың оң жағында жатқан, яғни O, N- донорлық атомдармен әрекеттеседі.
Ве 2+ ионы азот-донорлық лигандтқа қарағанда, оттегі-донорлық лигандтпен берік байланыс түзеді. Бірақ, Ве 2+ [Be(NH 3 ) 4 ] Cl 2 аммиакты комплексының термодинамикалық және термиялық тұрақтылығы жоғары болғанымен, суда (оттегі - донорлық лиганд) тез айрылады. Мұны, аммиакка қарағанда судың үлкен полярлығымен түсіндіруге болады. Бұл жерде негізінен аммиактағы азот атоымының донорлы қабілетіне байланысты емес, себебі Ве 2+ ионында донордың электрон жұбына ұсынатын бос орбиталь жоқ. Пирсон бойынша, яғни “қатаң” Ве 2+ және “қатаң” оттегі бұл жерде үлкен энергетикалық ұтады. Осы себептен, Ве 2+ ионы үшін оттегі - донорлық лигандтпен комплекстері тән.
Осы топшадағы иондардың оттегі, азот және күкірт бар лигандтармен комплекстүзу туралы әдебиеттерді талдау барысында маңызды төменмолекулалы лигандтарды бөлуге мүмкіндік береді. Осы қосылыстардың ішінде, берілген топшадағы иондармен жақсы комплекстүзетін салицил (HO-C 6 H 4 -COOH) және сульфосалицил (HO-C 6 H 3 -(SO 3 H) (COOH) қышқылдары болып келеді. Әр қышқылдың өзіне тән қасиеттері болғанымен, комплекске түсу қабілеті бірдей. Сульфосалицилат анионы 3 протонды қосып алады және рН-метрлік титрлеу қисығымен 3 протондану константасы есептелді, ол 1 суретте көрсетілген [3] .
1 суретте көрініп тұрғандай, титрлеу қисығында бірінші және екінші бейтараптану қисығының арасында иілу нүктелері жоқ, ол екінші және үшінші протондану константасыларының өте жақын екенін көрсетеді (сульфосалицил қышқылының бірінші және екінші диссоциациялану константасы) . Константалар Шварценбах әдісімен есептелген. Төменде протондану константасы келтірілген: lgК 3 <1; lgК 2 =2, 64; lgК 1 =11, 62 (I=0, 1) .
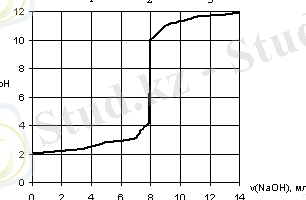
1 сурет - Сульфосалицил қышқылының рН-метрлік титрлеу қисығы
1 кесте - Периодтық жүйедегі II топ металл иондарының салицил және сульфосалицил қышқылдарымен комплекстерінің тұрақтылық константалары
Be 2+
Ca 2+
Cd 2+
Zn 2+
BeSal 12, 37; BeSal 2 22, 00
CaSal 13, 8
CdSal 5, 55
ZnSal 6, 85
Be 2+
Cd 2+
Zn 2+
BeSsal 11, 7; BeSsal 2 20, 8
CdSsal 4, 65
ZnSsal 6, 05; ZnSsal 2 10, 65
1 кестеде салицил және сульфосалицил қышқылдары мен кейбір металл иондардың тұрақтылық константалары көрсетілген [3] . 1 кестеде көрініп тұрғандай, Ве 2+ ионы салицил және сульфосалицил қышқылдарымен ең берік комплекс береді.
Ве 2+ ионының оксиқышқылдармен комплекстерін зерттеу бірнеше жұмыстарда қарастырылған [4-5] . Ион алмасу және рН-метрлік титрлеу әдістерімен салицил қышқылының бериллий ионымен рН∼3, 6-4, 3 аралығында тұрақты бейтарап комплекс BeSal және рН∼6-9 теріс зарядталған комплекс BeSal 2 2- түзілетіні анықталды. Фенол және гидроксил топтарындағы сутегі атомының орнын бериллий ионының орынбасуы арқылы алынған салицилатты комплекс хелатты қосылыстарға жатады:
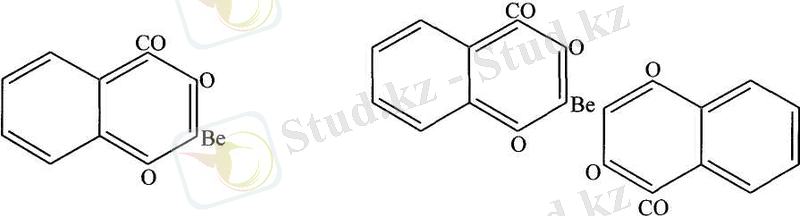
Ерітіндіден берилий салицилаты Ве(С 6 Н 4 ОСОО) ⋅2Н 2 О және ВеОН(С 6 Н 4 ОНСОО) ⋅2Н 2 О гидраты түрінде бөлініп алынған.
Сулфосалицил қышқылы С 6 Н 3 (SO 3 H) ОНСООН берилиймен құрамы 1:1 және 2:1 комплекстерін береді. [Be(SSal) ] - комплексы қышқыл ортада түзіледі, ал комплекс [Be(SSal) 2 ] 4- рН>8, 0 кезінде түзіледі. Олардың тұрақтылық константалары 1 кестеде берілген.
Бериллийді салицил және сульфосалицил қышқылдарымен спектрофотометрлік және титрлеу әдістерімен анықтайды. Салицилаттар мен сульфосалицилаттарды, басқа элементтерді анықтау кезінде, бериллийдің түссіз немесе берік комплекстүзілуіне байланысты, бериллийді бөліп алу үшін қолдануға болады.
25 0 С температурада, pH=2, 7-8 және иондық күш 1М (NaClO 4 ) ерітіндісінде потенциометрлік титрлеу әдісімен Ве 2+ ионның гидролиздену процесі және де Be 2+ мен салицил қышқылы H 2 L арасындағы комплекстүзілу процесі зерттелген [6] . H 2 L қатысуынсыз мынандай гидрокомплекстер [Be 2 (OH) ] 3+ (I), [Be 3 (OH) 3 ] 3+ (II), [Be 6 (OH) 8 ] 4+ (III) түзілетіні көрсетілген. H 2 L-дың артық мөлшерінде [Be(HL) ] + (IV), [Be(HL) 2 ] (V), [Be(HL) ] - (VI), BeL (VII), [BeL 2 ] 2- (VIII), [Be(OH) L] - (IX) және [Be 3 (OH) 3 L 3 ] 3- (X) комплекстер түзілетіні байқалған. Түзілген комплекстердің lgK тепе-теңдік константалары есептелген, олар сәйкесінше мына мәндерге тең: -3, 52; -8, 70; -26, 82; +2, 88; +1, 56; +3, 78; +0, 84; -0, 84; -3, 86; -7, 9 және -16, 2. Авторлармен мынандай қорытынды жасалған, ерітіндіде H 2 L қатысуынсыз ІІ, ал H 2 L қатысуымен VI-VIII комплекстер басым болады.
Бериллийдің алифатты о-қышқылдарымен комплекстеріне мысалы ретінде лимон қышқылымен комплексін алуға болады. рН 3 пен 4 аралығында құрамы 1:1 /BeH 2 Cit/ + , /BeHCit/ және /BeCit/ үш комплекс түзіледі. Мұндағы Cit - [(CH 2 COO) 2 C(OH) COO] 3- лимон қышқылының анионы. Комплекстердің зарядтарынан көрініп тұрғандай, комплекстүзілу кезінде гидроксил тобындағы сутегі қатыспайды. Оның себебі, лимон қышқылындағы ОН - топтың қышқылдығы, салицил қышқылындағы фенолды топтағы ОН - топтың қышқылдығына қарағанда төмен болуына байланысты. Сонымен қатар, pH>8 кезінде лимон қышқылының молекуласына екі атом бериллийден тұратын комплекс алынады [7] .
25 0 С температурада және иондық күш 0, 5 (NaClO 4 ) ерітіндісінде потенциометрлік титрлеу әдісімен Ве 2+ H 3 Q [мұндағы H 3 Q=нитрилоүшсірке (H 3 Q 1 ) метил нитрилоүшсірке (H 3 Q 2 ), (H 3 Q 3 ) (H 3 Q 4 ), нитрилоүшпропионды (H 3 Q 5 ) ] қышқылдармен комплекстүзілуі зерттелген [8] . Авторлармен [BeQ 1 ] - , [BeQ 2 ] - [BeQ 3 ] - , [Be(HQ 2 ) ], [Be(HQ 3 ) ], [Be(H 2 Q 3. ] + және [Be(Q 5 ) ] - құрамды комплекстер түзілетіні дәлелденген және сәйкесінше (берілген комплекстердің ретіне байланысты) олардың тұрақтылық константалары (lgK) есептелінген: - 6, 84; 7, 39; 1, 79; 8, 10; 1, 96; 1, 37; 9, 25; 2, 37 және 9, 23. [BeQ] - құрамды комплекстің тұрақтылық константалары H 3 Q молекуласындағы пропион тобының санының өсуіне сәйкес мына қатарда өседі: H 3 Q 1 <H 3 Q 2 <H 3 Q 3 <H 3 Q 4 =H 3 Q 5 . H 3 Q лигандасы тетрадентатты түрінде комплекске түседі және бериллий атомы N атомы және карбоксил топтағы үш О атомымен координациялық байланыс түзеді. Бериллий атомы тетраэдрлік құрылымды болады, қарастырылып отырған жұмыста келесі қорытынды жасалды, Ве 2+ үшін бесмүшелі хелатты циклге қарағанда алтымүшелі хелатты цикл тұрақтылау болып келеді.
298, 15К температурада, иондық күштері 0, 1 және 0, 3 моль/л (ТЭАСl - тетраэтиламмоний хлорид фонында) ерітінділерінде потенциометрлік титрлеу әдісімен кальций және магний тартратты комплекстері зерттелді [15] . Потенциометрлік анықтау с М 0 :с L 0 =1:1, 1:2, 1:5 (М - металл, L - Tar лиганды) қатынастарын қолданып, шарап қышқылымен тұрақтылық константалары алынды. 2 кестеде шарап қышқылымен Са 2+ және Mg 2+ металл иондарының, бір индивидуалды параметрі бар теңдеу бойынша концентрациялық тепе-теңдік константаны қолданып есептелген термодинамикалық константалардың мәндері келтірілген [9] .
2 кесте - ТЭАCl фонында, 298, 15К температурадағы кальций және магний тартраттарының тұрақтылық (lgβ) және шарап қышқылының диссоциациялану константаларының (рК) логарифмы.
Кальцийдің хелатты қосылыстары зерттелген [10] . Бейтарап ерітіндіде пиколин қышқылы (1 - n - нитрофенол - 3 метил - 4 нитро - 5 пирозолин) кальций ионымен қызғылт сары кальций пикролат тұнбасын береді, 7 - иод - 8 - оксихинолин - 5 сульфон қышқылымен Са 2+ ионы сарықызыл түсті хелатты комплекс түзеді. Кальций гидроокисіне ацетилацетонмен әсер еткен кезде қиын еритін кальцийдің ацетилацетонаты түзіледі.
Н
2
Tar
 Equation. 3 Нtar
-
+Н
+
Equation. 3 Нtar
-
+Н
+
HTar
-
 Equation. 3 Tar
2-
+Н
+
Equation. 3 Tar
2-
+Н
+
3, 03±0, 03
4, 43±0, 03
2, 83±0, 03
3, 98±0, 03
2, 76±0, 02
3, 82±0, 02
Ca
2+
+Tar
2-
 CaTar
CaTar
Ca
2+
+HTar
-
 CaHTar
+
CaHTar
+
Mg
2+
+Tar
2-
 MgTar
MgTar
Mg
2+
+HTar
-
 MgHTar
+
MgHTar
+
2, 89±0, 04
1, 68±0, 04
2, 45±0, 04
1, 47±0, 04
2, 00±0, 03
1, 20±0, 03
1, 56±0, 03
1, 02±0, 03
1, 70±0, 03
1, 06±0, 03
1, 23±0, 03
0, 85±0, 03
0, 1 М КCl сулы ерітіндісінде, I концентрациясы 10 -3 М тең және 1:1 құрамды I:CaCl 2 және I:CuCl 2 молекулалық қатынаста потенциометрлік титрлеу әдісімен 1 амино-этан-1, 1-дифосфон қышқылының (I) диссоциациялану константасы (К) мен Ca 2+ және Cu 2+ (К Ca , К Cu ) иондарының I - мен салыстырмалы тұрақтылық константалары есептелген [11] . I - үшнегіздік қышқылға жатады. Гандерсон-Гассельбах теңдеуінің көмегімен диссоциацияның әрбір сатысындағы рК есептелген, олардың мәндері сәйкесінше: рК 1 =3, 41, рК 2 =5, 75, рК 3 =8, 90, рК 4 =10, 70 тең. Комплекстердің тұрақтылық константалары график түрінде анықталған: lgK Ca =4, 31, lgK Cu =10, 40.
Толуол немесе диэтил эфир ортасында триэтилендиаминнің [1, 4-диазобицикло-(2, 2, 2) -октан-(ТЭДА) ] металдардың тетрагидроборатымен nM(BH
4
)
2
⋅L (M=Mg, Ca, Sr, n=2) құрамды комплекстер синтезделініп алынды [19] . Алынған қосылыстар элементті анализбен, ИҚ-спектроскопиялық және дифференциалды термиялық анализбен (ДТА) талданды. Ковалентті тетрагидроборат үшін В-Н-байланысының көпірше және шеткі валентті тербелісіне сәйкес, 2000-2500 см
-1
ауданында жататын жолақтар жүйесі тән.
 ионы 2300 см
-1
кезінде өте жақсы байқалатын жұтылу жолағын береді. ВН
3
⋅L қосылысының спектрінде 2200-2400 см
-1
аралығында бірнеше жұтылу жолақтары байқалады. 2М(ВН
4
)
2
⋅ТЭДА қосылысының спектрлерінде, мұндағы М=Mg, Ca, Sr, В-Н байланысының валентті тербеліс ауданында индивидуалды сілтілік-жер металдарының спектрлеріне ұқсас. Бұл
ионы 2300 см
-1
кезінде өте жақсы байқалатын жұтылу жолағын береді. ВН
3
⋅L қосылысының спектрінде 2200-2400 см
-1
аралығында бірнеше жұтылу жолақтары байқалады. 2М(ВН
4
)
2
⋅ТЭДА қосылысының спектрлерінде, мұндағы М=Mg, Ca, Sr, В-Н байланысының валентті тербеліс ауданында индивидуалды сілтілік-жер металдарының спектрлеріне ұқсас. Бұл
 ионының металл ионымен координациясы өзгермейтінін көрсетеді. Барлық комплекстердің ИҚ-спектрінде триэтилендиаминнің С-Н, С-С және С-N байланыстарының тербеліс жиілігіне сәйкес жолақтар бар. Бастапқы тетрагидробораттың жолақтарына қарағанда, 2M(BH
4
)
2
⋅ТЭДА қосылыста ν
as
(B-H) жолағының ығысуы байқалады, яғни металл атомы лигандпен координациялық байланысқа түседі және осыған байланысты иондық байланыс күшейеді. Бұл қорытынды 420 см
-1
жұтылу жолағының пайда болуымен дәлелдеуге болады, себебі бұл тербеліс металл-азот байланысты көрсетеді. Сонымен, органикалық еріткіш ортада Периодтық жүйедегі II топ элементтерінің ТЭДА 2M(BH
4
)
2
⋅ТЭДА құрамды комплексты қосылыс береді.
ионының металл ионымен координациясы өзгермейтінін көрсетеді. Барлық комплекстердің ИҚ-спектрінде триэтилендиаминнің С-Н, С-С және С-N байланыстарының тербеліс жиілігіне сәйкес жолақтар бар. Бастапқы тетрагидробораттың жолақтарына қарағанда, 2M(BH
4
)
2
⋅ТЭДА қосылыста ν
as
(B-H) жолағының ығысуы байқалады, яғни металл атомы лигандпен координациялық байланысқа түседі және осыған байланысты иондық байланыс күшейеді. Бұл қорытынды 420 см
-1
жұтылу жолағының пайда болуымен дәлелдеуге болады, себебі бұл тербеліс металл-азот байланысты көрсетеді. Сонымен, органикалық еріткіш ортада Периодтық жүйедегі II топ элементтерінің ТЭДА 2M(BH
4
)
2
⋅ТЭДА құрамды комплексты қосылыс береді.
25, 35, 45 и 55 0 С температурада және иондық күші 0, 1 (KNO 3 ) ерітіндісінде, комплексон және металл ионы ерітіндісін рН-метрлік титрлеу әдісімен автор [20] жұмысында мына реакция бойынша М 2+ +nL 2- =ML n 2-2n (n=1 және n=2) β-оксиэтилиминодисірке қышқылының (H 2 L) сілтілік-жер металл иондарымен комплекс түзілетіні анықталды. Комплекстердің тұрақтылық константалар логарифмының температурадан кері сызықты тәуелділігі көмегімен 298, 15К температурадағы ∆ r Н 0 , ∆ r S 0 шамалары есептелінді.
ML үшін олардың мәні:
Мg : 37, 41±0, 07 кДж/моль және 189, 8±0, 4 Дж/ моль⋅ К
Са : -6, 86±0, 07 кДж /моль және 189, 8±0, 4 Дж/ моль⋅ К
Sr : -21, 80±0, 50 кДж /моль және 3, 2±0, 1 Дж/ моль⋅ К
Ba : -16, 21±0, 26 кДж /моль және 12, 3±0, 4 Дж/ моль⋅ К
ML n 2+ үшін сәйкесінше: 4, 86±0, 42 және 72, 9 ±0, 9
-37, 40±0, 5 және -53, 4±0, 7
-9, 35±0, 07 және 30, 0±0, 6
0 және 59, 4±1, 3.
Көптеген краун-эфирлер сілтілік металдармен және әсіресе сілтілік-жер металдармен жақсы комплекске түсетіні туралы [12] автор жұмысында айтылған. Азакраун эфирлер сілтілік ортада Li + , Ba 2+ , Sr 2+ иондарына жоғары талғамдылық көрсетеді.
Сілтілік және сілтілік-жер металдарды бөліп алу, айырып алу және концентрлеу процесін зерттеу, белсенділігі жоғары қалдықтар мен сәулеленген ядролық отындарды радиохимиялық технологиямен өңдеудің дамуына байланысты болып келеді. Негізгі радиоактивті жылу бөлетін элементтерді - 90 Sr, 137 Сs - нитратты ерітінділерден жою, экологиялық апат пен ұзақ уақыт сақтау үшін белсенділігі жоғары қалдықтардың көлемін төмендетеді. Бұл жерде қиын мәселердің бірі - сілтілік және сілтілік-жер металдардан тұратын химиялық құрамы күрделі ерітіндіні өңдеу. Қойылған міндеттерді шешу үшін қиын жолдардың бірі - азотқышқылды ерітіндіден Mg, Ca, Sr, Ba және Сs иондарын бөліп алу кезінде талғамдылығы мен пәрменділігі жоғары функцияланған краун-эфирлер класына жататын макроциклды қосылыстармен шайғындау процесін қолдану болып келеді [13] . Азотқышқылды ерітіндісінен сілтілік және сілтілік-жер металдар нитраттарының краун-эфирлерімен шайғындау процесіндегі таралу коэффициенті анықталды, мұндағы краун-эфирлердің циклдерінің саны (18 атомнан 22 атомға дейін) және циклде оттегі атомдарының саны тұрақты, ал шеткі фенилды және циклогексилды орынбасушылар әртүрлі болуымен айырмашылығы бар. Фенилды және циклогексилды орынбасушыларынан тұратын 18-краун-6 туындылары сілтілік металдар үшін пәрменді шайғындатқы болып табылатыны анықталды. Бір және екі циклогексилды фрагменттерден тұратын 18-краун-6 эфир туындыларымен Sr-ды сілтілік және сілтілік-жер металдарынан талғамды бөліп алуға болады.
II топ қосылыстарымен ЭДТА комплекстері кең және жан-жақты зерттелген [14] . ЭДТА ерітіндісін титрлеу қисығында үш буферлі аудан бар. Бірінші аудан бір мезгілде өтетін диссоциациялану процесіне сәйкес келеді:
H 4 edta ↔︎ Н 3 edta - + H + ;
Н 3 edta - ↔︎ H 2 edta 2- + H + ,
Екінші аудан Нedta 3- , үшінші аудан edta 4- аниондарының түзілуіне сәйкес келеді (2 сурет) .
Бейтараптану қисығынан есептелінген диссоциациялану константалары келесі мәндерге ие: pК 1 =1, 996, рК 2 =2, 672, рК 3 =6, 161, рК 4 =10, 262.
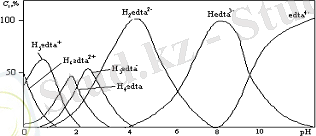
2 сурет - Ортаның рН-ына байланысты ЭДТА-ның әртүрлі анионды формасын анықтау
Периодтық жүйедегі II топ негізгі топшасындағы металл катиондарының ЭДТА-мен әрекеттесуі ерекше қызықтырады, себебі суда жақсы еритін тұрақты комплекстер түзеді (3 кесте) . Берілген металл иондарының комплексонаттары сулы ерітіндінің рН = 4-12 аралығында түзіледі. Иондық радиустың өсуімен ЭДТА, ДТПА және ЦГДТА комплекстердің тұрақтылығы монотонды өспейді. Мынандай қатар ұсынуға болады: Ca 2+ >Mg 2+ ≈ Вe 2+ ≈Sr 2+ >Ba 2+ . Ал НҮС-пен тұрақтылықтың өзгеруі басқаша болады: Вe 2+ >Са 2+ >Mg 2+ >Sr 2+ >Ba 2+ .
3 кесте - Периодтық жүйедегі II топ металдарының ЭДТА-мен комплекстерінің тұрақтылық константалары lgК (20 0 С, I=0, 1) .
3 кестеде көрініп тұрғандай, кальций комплексонаты магний комплексонатына қарағанда тұрақты, яғни оны ЭДТА максималды дентантылығын сақтай отыра, металл-лиганд әрекеттесу пәрменділігінің төмен болуымен түсіндіруге болады [14] .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz