Молекулалық-кинетикалық теория және термодинамика: идеал газдар мен күй теңдеулері


МОЛЕКУЛАЛЫҚ ФИЗИКА ЖӘНЕ ТЕРМОДИНАМИКА
Тақырып: Молекула-кинетикалық теорияның негіздері
Зерттеудің статистикалық және термодинамикалық әдістері
Физиканың молекулалық физика және термодинамика бөлімдері денелерді құрайтын орасан көп молекулалар мен атомдарға байланысты денелерде жүретін макроскопиялық процестерді зерттейді. Бұл процестерді зерттеу үшін екі әдіс қолданылады: статистикалық (молекулалық-кинетикалық) және термодинамикалық . Бірінші әдіс молекулалық физиканың негізінде, ал екінші әдіс термодинамиканың негізінде қолданылады.
Молекулалық физика - заттың құрылымын және қасиеттерін барлық денелер үздіксіз хаосты (тәртіпсіз) қозғалатын молекулалардан тұратынына негізделген молекулалық-кинетикалық тұрғыдан зерттейді.
Молекулалық физика қарастыратын процестер өте көп молекулалардың әсерінің нәтижесі болып табылады. Саны өте көп молекулалардың қозғалыс заңы статистикалық заңдылық болғандықтан статистикалық әдістің көмегімен зерттеледі. Бұл әдіс макроскопиялық жүйенің қасиеті жүйені құрайтын бөлшектердің қасиеттерімен, олардың қозғалыс ерекшеліктерімен және осы бөлшектердің динамикалық сипаттамаларының орташа мәндерімен (жылдамдық, энергия және т. б. ) анықталатындығына негізделген. Мысалы, дененің температурасы оны құрайтын молекулалардың тәртіпсіз қозғалысының жылдамдығымен анықталады, бірақ кез-келген уақыт аралығында түрлі молекуланың жылдамдығы әр түрлі болғандықтан оны молекулалардың қозғалыс жылдамдығының орташа мәні арқылы өрнектеуге болады. Демек, денелердің макроскопиялық сипаттамаларының молекулалардың саны өте көп болғанда ғана физикалық мағынасы болады, бір молекуланың температурасы туралы айтуға болмайды.
Термодинамика - термодинамикалық тепе-теңдік күйдегі макро-скопиялық жүйелердің жалпы қасиеттерін және бір күйден екінші бір күйге өту процестерін зерттейді. Бұл өзгерулердің негізінде жатқан микропроцестерді термодинамика қарастырмайды. Термодинамикалық әдістің статистикалық әдістен өзгешелігі осында. Термодинамика тәжірибе нәтижесінде тағайындалған заңдарға сүйенеді.
Молекулалық-кинетикалық теориямен салыстырғанда термодинамиканың қолданылу аймағы кең, себебі физика мен химияда термодинамикалық әдіс қолданылмайтын аймақ жоқ деуге болады. Екінші жағынан, термодинамикалық әдіс заттың микроскопиялық құрылысы, құбылыстың механизмі туралы мағлұмат бермейді, тек заттың макроскопиялық қасиеттері арасындағы байланысты орнатады. Молекулалық-кинетикалық теория және термодинамика зерттеу әдістерімен ерекшелене отырып, бірін-бірі өзара толықтырады.
Термодинамикалық жүйе - өзара әсерлесуші, әрі өзара ғана емес басқа денелермен де (сыртқы ортамен) әсерлесуші және энергия алмасушы макроскопиялық денелердің жиынтығы. Термодинамикалық әдістің негізі - термодинамикалық жүйенің күйін анықтау болып табылады. Жүйенің күйі термодинамикалық параметрлермен (күй параметрлері) беріледі. Термодинамикалық параметрлер (күй параметрлері) деп термодинамикалық жүйенің қасиеттерін сипаттайтын физикалық шамалардың жиынтығын айтады. Күй параметрлері ретінде температура, қысым және меншікті көлем қарастырылады.
Температура - термодинамикада ғана емес, жалпы физикада маңызды ролі бар негізгі түсініктердің бірі. Температура - макроскопиялық жүйенің термодинамикалық тепе-теңдік күйін сипаттайтын физикалық шама. Қазіргі уақытта екі температуралық шкала қолданылады: термодинамикалық - Кельвин бойынша (К) және Халықаралық практикалық - Цельсий градусы (°С) бойынша.
Халықаралық практикалық шкалада
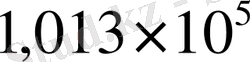 Па қысымдағы судың қату және қайнау температуралары 0 және 100°С (реперлік нүктелер) .
Па қысымдағы судың қату және қайнау температуралары 0 және 100°С (реперлік нүктелер) .
Термодинамикалық температура мен Халықаралық практикалық шкала бойынша температура арасындағы байланыс мына түрде жазылады:
T = 273, 15 + t.
Меншікті көлем υ - бірлік массаның көлемі. Дене біртекті, яғни ρ = const болғанда, υ = V/m = 1/ρ. Тұрақты массада меншікті көлем жалпы көлемге пропорционал болғандықтан, біртекті дененің макроскопиялық қасиеттерін көлеммен сипаттауға болады.
Жүйенің күй параметрлері өзгеріп отырады. Термодинамикалық параметрлердің өзгеруіне байланысты болатын термодинамикалық жүйедегі кез-келген өзгеріс термодинамикалық процесс деп аталады. Егер макроскопиялық жүйенің күйі уақыт өтуіне байланысты өзгермесе, онда жүйе термодинамикалық тепе-теңдікте болады (қарастырылып отырған жүйенің сыртқы жағдайы өзгермейтін болса) .
Идеал газдың молекулалық-кинетикалық теориясы. Идеал газ заңдары. Молекулалық-кинетикалық теорияда идеал газ моделін пайдаланады. Бұл идеалдандырылған модель бойынша:
- ыдыс көлемімен салыстырғанда газ молекуласының көлемі ескермейтіндей аз болуы керек;
- газ молекулаларының арасында өзара әсер күштері болмауы керек;
- газ молекулаларының ыдыс қабырғасымен және өзара соқтығысуы абсолют серпімді болуы керек.
Идеал газ моделін нақты газдарды зерттегенде қолдануға болады, себебі қалыпты жағдайда (мысалы, оттегі мен гелий) төмен қысымда және жоғары температурада нақты газдардың қасиеттері идеал газға жақын болады. Идеал газ теориясына молекуланың меншікті көлемін және молекулалық күштерді ескеретін түзетулер енгізе отырып, нақты газдар теориясына көшуге болады.
Молекулалық-кинетикалық теориядан бұрын тәжірибе нәтижесінде идеал газды сипаттайтын бірнеше заңдар ашылды, соларға тоқтала кетеміз.
тұрақты температурада берілген газ массасы үшін қысымның Бойль- Мариотт заңы: көлемге көбейтіндісі тұрақты шама:
рV = const (1. 1)
T = const, m = const.
Тұрақты температурада заттың қасиетін сипаттайтын р және V шамаларының арасындағы тәуелділікті көрсететін қисық изотерма деп аталады. Изотермалар гипербола болып табылады, процесс кезінде температура жоғары болса, графикте гиперболалар да жоғары орналасады (сурет 1) .
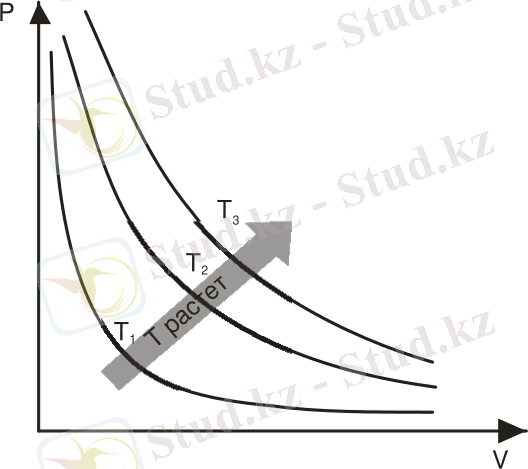
Сурет 1
Гей-Люссак заңы: 1) тұрақты қысымда берілген газ массасының көлемімен температурасы сызықты өзгереді:
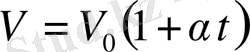 (1. 2)
(1. 2)
р = const, m = const.
2) тұрақты көлемде берілген газ массасының қысымымен температурасы сызықты өзгереді:
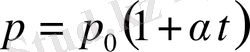
V = const, m = const. (1. 3)
Бұл теңдеулердегі
t
-Цельсий шкаласы бойынша температура,
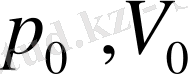 -
0°С
-тағы қысым мен көлем, коэффициент
α = 1/273, 15
-
0°С
-тағы қысым мен көлем, коэффициент
α = 1/273, 15
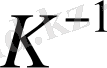 .
.
Тұрақты қысымда өтетін процесс изобаралық процесс деп аталады. Координаталары V, t болатын диаграммада бұл процесс изобара деп аталатын түзу сызықпен бейнеленеді (сурет 2) .
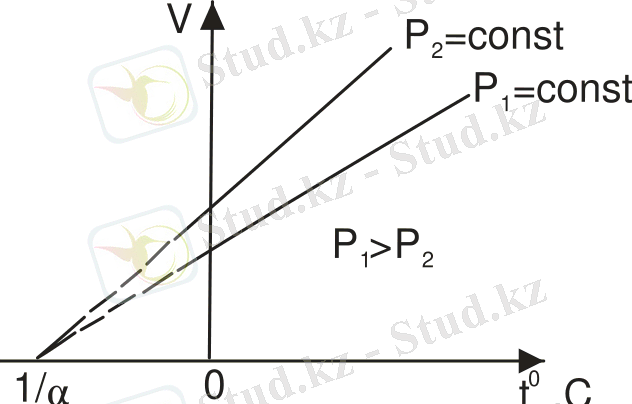
Сурет 2
Тұрақты көлемде өтетін процесс изохоралық процесс деп аталады. Координаталары p, t болатын диаграммада бұл процесс изохора деп аталатын түзу сызықпен бейнеленеді (сурет 3) .
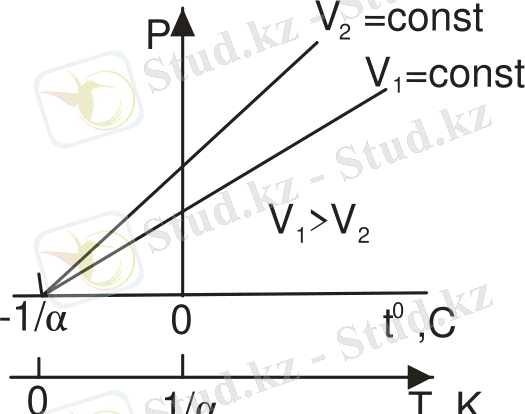
Сурет 3
Изобара мен изохоралар температура осін t = -1/α = - 273, 15°С нүктесінде қиятыны (2) және (3) өрнектерден шығады, ол 1+ αt = 0 шартынан анықталады. Егер санақ басын осы нүктеге жылжытсақ, онда Кельвин шкаласына көшуге болады (сурет 4) :
T = t + 1/α.
(2) және (3) өрнектерге термодинамикалық температураны енгізу арқылы Гей -Люссак заңын өзгертіп жазуға болады:
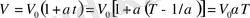 ,
,
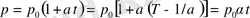 ,
,
немесе
р = const, m = const үшін
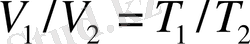 (1. 4)
(1. 4)
V = const, m = const үшін
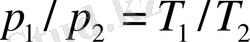 (1. 5)
(1. 5)
Мұндағы 1 және 2 индекстері бір изобарада немесе изохорада орналасқан күйлерге сәйкес келеді.
Авогадро заңы:
кез-келген газдың молі бірдей температурада және қысымда бірдей көлем алады. Қалыпты жағдайда бұл көлемнің мәні
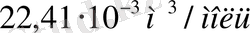 болады.
болады.
Авогадро тұрақтысы заттың бір моліндегі молекулалар санын көрсетеді:
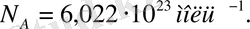
Дальтон заңы: идеал газ қоспасының қысымы қоспаның құрамындағы газдардың парциал қысымдарының қосындысына тең, демек
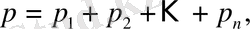 (1. 6)
(1. 6)
мұндағы
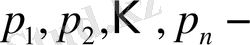 парциал газ қысымдары.
парциал газ қысымдары.
Клапейрон-Менделеев теңдеуі . Идеал газдың күйі термодинамикалық параметрлермен: қысым р, көлем V және температурамен T анықталады. Бұл параметрлердің арасындағы байланыс күй теңдеуі деп аталады, күй теңдеуінің өрнегі
f (p, V, T) = 0,
мұндағы әр айнымалы өзге екеуінің функциясы болып табылады. Бойль-Мариотт және Гей-Люссак заңдарын біріктіре отырып, француз физигі Б. Клапейрон идеал газ үшін күй теңдеуін қорытып шығарды.
Массасы еркін алынған газдың алатын көлемі
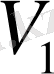 , қысымы
, қысымы
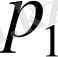 , температурасы
, температурасы
 болсын. Дәл осындай массалы газдың басқа екінші күйі
болсын. Дәл осындай массалы газдың басқа екінші күйі
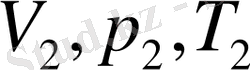 параметрлермен сипатталсын (сурет 4) .
параметрлермен сипатталсын (сурет 4) .
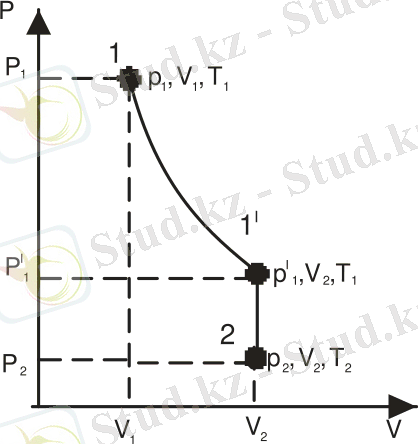
Сурет 4
Газ 1 күйден 2 күйге екі процесс арқылы өтеді:
1) изотермиялық (изотерма 1-1´),
2) изохоралық (изохора 1´-2) .
Бойль-Мариотт (1. 1) және Гей-Люссак (1. 5) заңдарына сәйкес жазамыз:
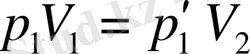 ,
,
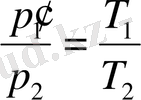 .
.
Бұл теңдеулерден
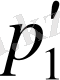 шамасын алып тастап, төмендегі теңдеуді аламыз.
шамасын алып тастап, төмендегі теңдеуді аламыз.
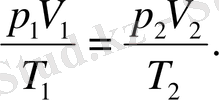
1 және 2 күй еркін таңдап алынғандықтан, берілген газ массасы үшін
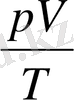 шамасы тұрақты болады, демек
шамасы тұрақты болады, демек
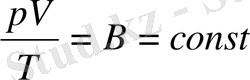 . (1. 7)
. (1. 7)
(1. 7) өрнегі Клапейрон теңдеуі болып табылады, мұндағы В - газ тұрақтысы, түрлі газ үшін әртүрлі мәндер қабылдайды.
Орыс ғалымы Д. И. Менделеев Клапейрон теңдеуін Авогадро заңымен біріктірді, молярлық
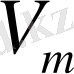 көлемді қолданып, (1. 7) теңдеуін бір моль газ үшін жазды. Авогадро заңы бойынша бірдей қысымда және температурада барлық газдың молі бірдей молярлық көлем
көлемді қолданып, (1. 7) теңдеуін бір моль газ үшін жазды. Авогадро заңы бойынша бірдей қысымда және температурада барлық газдың молі бірдей молярлық көлем
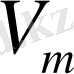 алады, сондықтан
В
тұрақтысы барлық газ үшін бірдей болады. Барлық газ үшін ортақ тұрақты
R
әрпімен беріліп, молярлық немесе
универсал газ тұрақтысы
деп аталады. Теңдеуді
алады, сондықтан
В
тұрақтысы барлық газ үшін бірдей болады. Барлық газ үшін ортақ тұрақты
R
әрпімен беріліп, молярлық немесе
универсал газ тұрақтысы
деп аталады. Теңдеуді
 (1. 8)
(1. 8)
идеал газ ғана қанағаттандырады, сондықтан (1. 8) теңдеуі Клапейрон-Менделеев теңдеуі деп аталады.
Қалыпты жағдайдағы газ молі үшін (
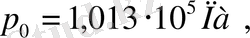
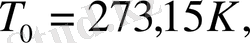
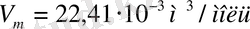 ) (1. 8) формуласынан табылған молярлық газ тұрақтысының сандық мәні
) (1. 8) формуласынан табылған молярлық газ тұрақтысының сандық мәні
R = 8, 31 Дж/(мольК) .
Газ моліне арналған (1. 8) теңдеуінен массасы
m
газ үшін жазылған Клапейрон-Менделеев теңдеуіне көшуге болады. Егер берілген қысым мен температурада газдың бір молінің алатын көлемі
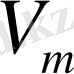 болса, онда сол жағдайдағы массасы
m
газдың алатын көлемі
болса, онда сол жағдайдағы массасы
m
газдың алатын көлемі
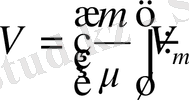 , мұндағы μ- молярлық масса (заттың бір молінің массасы) . Молярлық массаның өлшем бірлігі - килограммның мольге қатынасына (кг/моль) тең. Массасы
m
газ үшін
Клапейрон-Менделеев теңдеуінің
өрнектелуі:
, мұндағы μ- молярлық масса (заттың бір молінің массасы) . Молярлық массаның өлшем бірлігі - килограммның мольге қатынасына (кг/моль) тең. Массасы
m
газ үшін
Клапейрон-Менделеев теңдеуінің
өрнектелуі:
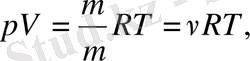 (1. 9)
(1. 9)
мұндағы
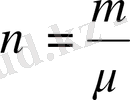 - зат мөлшері.
- зат мөлшері.
Идеал газдың күй теңдеуін (1. 8) Больцман тұрақтысын енгізу арқылы да жазуға болады:
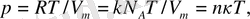
мұндағы
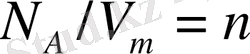 - молекулалардың концентрациясы (бірлік көлемдегі молекулалар саны),
- молекулалардың концентрациясы (бірлік көлемдегі молекулалар саны),
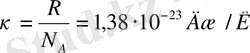 -Больцман тұрақтысы. Сонымен,
-Больцман тұрақтысы. Сонымен,
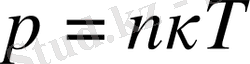 (1. 10)
(1. 10)
теңдеуі бойынша идеал газдың қысымы берілген температурада газ молекулаларының концентрациясына (немесе газдың тығыздығына) тура пропорционал екен. Бірдей температурада және бірдей қысымда барлық газдардың бірлік көлемдегі молекулаларының саны бірдей болады. Қалыпты жағдайда
 көлемдегі молекулалар саны
Лошмидт саны
деп аталады:
көлемдегі молекулалар саны
Лошмидт саны
деп аталады:
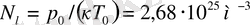 .
.
Идеал газдың молекулалық-кинетикалық теориясының (МКТ ) негізгі теңдеуі. Молекулалық-кинетикалық теорияның негізгі теңдеуін қорытып шығару үшін біратомды идеал газды қарастырамыз. Газ молекулалары хаосты, тәртіпсіз қозғалады делік. Молекулалар арасындағы өзара соқтығысу олардың ыдыс қабырғасына соқтығысуымен салыстырғанда ескермейтіндей аз және молекулалардың ыдыс қабырғасымен соқтығысуы абсолют серпімді деп қарастырамыз.
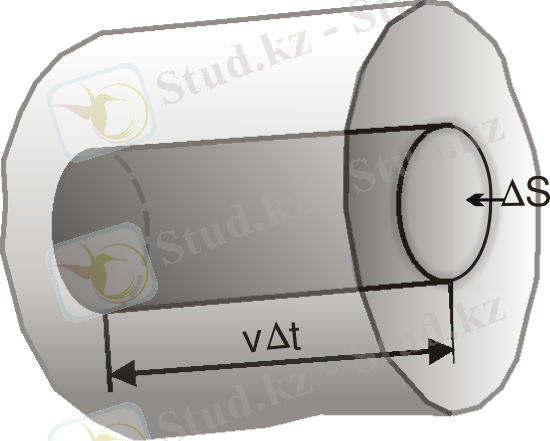
Сурет 5
Ыдыстың қабырғасынан ∆S элементар аудан бөліп алып, осы аудаңға түсетін қысымды есептейік. Аудаңға перпендикуляр қозғалатын молекуланың әрбір соқтығысқанда оған беретін импульсін жазайық:
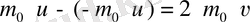
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz