Д. И. Менделеев және химиялық элементтердің периодтық жүйесі: ашылу тарихы, құрылымы және маңызы


КІРІСПЕ
Атом-молекулалық теориядан кейінгі химия тарихындағы ерекше маңызды ірі табыс Д. И. Менделеев ашқан периодтық заң болды. Осы заң негізінде элементтердің периодтық системасы жасалды. Периодтық заң - жаратылыстың негізгі заңдарының бірі, оның ашылуы химияда жаңа дәуір туғызды. Периодтық заң химиялық элементтерді, олардың қосылыстарын зерттеуге, заттың, құрылысының қалай екенін іздеуге теориялық негіз болды. Осымен бірге атомның құрылысының күрделілігін теория және эксперимент арқылы зерттеу процесіндегі ашылған жаңалықтар периодтылық мазмұн терең түсінуге мүмкіншілік туғызды.
Элементтерді жүйеге келтіру мәселесін орыстың ұлы ғалымы Д. И. Менделеев (1834-1907 ж. ) шешті. Ол 1869 жылы периодтық заңды ашып, 1871 жылы анықтамасын берді және сол заңның негізінде элементтердің периодтық жүйесін жасады. Элементтерді жүйеге келтірудің негізі етіп олардың атомдық массаларын алды. [1]
НЕГІЗГІ БӨЛІМ
2. 1 Д. Менделеев периодтық жүйесі
 Х1Х ғасырдың екінші жартысында алпыстан астам химиялық элементтер ашылып, олардың қасиеттері және ол элементтердің қосылыстарының қасиеттері зерттелді. Осындай толып жатқан материалдарды бір жүйеге келтіру қажет болды.
Х1Х ғасырдың екінші жартысында алпыстан астам химиялық элементтер ашылып, олардың қасиеттері және ол элементтердің қосылыстарының қасиеттері зерттелді. Осындай толып жатқан материалдарды бір жүйеге келтіру қажет болды.
Элементтерді жүйеге келтіру мәселесін орыстың ұлы ғалымы Д. И. Менделеев (1834-1907 ж. ) шешті. Ол 1869 жылы периодтық заңды ашып, 1871 жылы анықтамасын берді және сол заңның негізінде элементтердің периодтық жүйесін жасады. Элементтерді жүйеге келтірудің негізі етіп олардың атомдық массаларын алды.
Д. И. Менделеев сол кезде белгілі химиялық элементтерді атомдык массаларынын, өсу ретімен бір қатарға орналастырып, олардың касиеттері белгілі бір элементтердің санынан кейін қайтадан қайталап отыратынын байқаған. Элементтердің қасиеттерінің өзгеруін және периодты түрде өзгеруін литийден кальцийге дейінгі элементтер қатарынан көруге болады. Элементтің астына атомдық массасы мен жоғары оксидінің формуласы жазылған.
Li Be - В С N О F Na Mg Al Si P 7 9' 11 12 14 16 19 23 24 27 28 3!
BeO B2O3 CO, NaO5Na2O MgO Al2Oa SiO2 P2O5
S Cl К Са . . . 32 35, 5 39 40 SO3 СЬО7-КаО СаО . . .
Периодтық жүйені жасауда Д. И. Менделеев элементтерді атомдық массаларын негізге алумен қатар, олардың касиеттері де ескеріп отырды. Кейбір жағдайларда кестедегі элементтерді атомдық массалары өсу ретімен орналасу тәртібі бұзылғаны байқалады. Мысалы, теллурдың атомдық массасы иодтан ауыр болса да, оны иодтан бұрын, қасиеттері ұқсас элементтермен бірге, алтыншы топқа орлаластырған.
Д. И. Менделеев болжаған үш элемент онын тірі кезінде 1875 жылы француз Лекок де Буабодран № 31 элемент галлийді, 1979 жылы швед Нильсон № 21 элемент скандиді, 1886 жылы неміс Винклер № 32 элемент германийді ашты.
Д. И. Менделеев болжаған жаңа элементтердің ашылуы және олардың қасиеттерінің тәжәрибе нәтижелерімен сәйкес келуі периодтық заңды бүкіл дүние жүзі ғалымдарының дауына әкелді.
Д. И. Менделеев периодтық заң ары қарай жаңа мәліметтермен толықтырылуы және дамуға тиіс деп түсінді.
Элементтердің периодтық жүйесі Д. И. Менделеевтің периодтық заңының графикалық көрінісі.
Периодтық заң - атом ядросы зарядтарының артуына байланысты химиялық элементтер қасиеттерінің периодты өзгеретінін тұжырымдайтын табиғаттың негізгі заңы. Бұл заңды 1869 ж. Дмитрий Менделеев ашты. Ол оның толық тұжырымдамасын 1871 ж. жариялады. Бұл заң элементтердің периодтық жүйесімен тығыз байланысты және бірін-бірі толықтырып, түсіндіреді. Ядроның заряды (Z) жүйедегі элементтердің атомдық нөміріне тең. Z өсуі бойынша орналасқан элементтер Z(Н, Нe, Lі, Be…) 7 период түзеді. 1-периодта - 2 элемент, 2 мен 3-те - 8-ден, 4 пен 5-те - 18-ден, 6-да - 32 элемент, 7-де - 23 элемент белгілі. Периодта элементтердің қасиеттері сілтілік металдардан инертті газдарға өткенде заңды түрде өзгереді. Вертикальды бағаналар - қасиеттері ұқсас элементтердің топтары болып табылады. Топтың ішінде элементтердің қасиеттері де заңды түрде өзгереді (мысалы, сілтілік металдарда Lі-ден Fr-ға дейін химиялық активтілік өседі) . Z = 58 - 71, сол сияқты Z = 90 - 103 элементтерінің қасиеттері ұқсас болғандықтан лантаноидтар және актиноидтар қатарларына топтастырылған. Элементтер қасиеттерінің периодтылығы атомның сыртқы электрон қабаттарының конфигурациясының периодты қайталануына байланысты. Менделеевтің периодтық заңы мен элементтердің периодтық жүйесіне сүйене отырып, ғалымдар атом құрылысы және химиялық байланыс теорияларын жасады; жер қыртысы мен ғарыштық нысандар зерттелді. Бұл заңның барлық жаратылыстану, техника, технология саласындағы ғылымдар үшін философиялық мәні зор. [2]
2. 2 Д. Менделеев және периодтың ашылу тарихы

Дмитрий Иванович Менделеев - 27 қаңтарда 1834 жылы Тобольск қаласында Иван Павлович Менделеев (1783-1847), жанұясында дүниеге келді.
Әкесі Тобольск гимназиясының директоры және танымал ұстаз болатын. Жанұяда Дмитрий он жетінші бала болып дүниеге келді. Жастайынан бұғанасы қатпай жатып жетім болып қалды. Дмитрий Иванович Менделеев жастайынан табиғатты сүюге, еңбек етуге талпынған шын талант иесі. Д. И. Менделлевтің анасы -Мария Дмитриевна. Анасы бар өмірін балалаларына арнаған, өздігінен сауаттанған адам.
Санкт-Петербург Бас педагогикалық институтын бітірген (1855) . Ғылыми-зерттеу жұмыстарының негізгі бағыты жалпы химия, химиялық технология, физика, экономика, ауыл шаруашылығы, метрология, т. б. салаларға арналған. Ол изомерия құбылысын зерттеп (1854-56), сұйықтықтың тығыздығын анықтайтын құрал - ареометр құрастырды (1859) . “Органикалық химия” деген алғаш орыс тілінде оқулық шығарды (1861) . Сұйықтардың қайнауының абсолют температурасын (1860), гидраттық теорияны (1865 - 87), жаратылыстың негізгі заңдарының бірі - периодтық заңды ашты (1869) . Сонымен қатар молекуланың массасын табудың Клапейрон - Менделеев теңдеулерін шығарды. Мұнайдың ауыр металдар карбидтерінен түзілу гипотезасын (1877), көмірді жер астында газға айналдыру идеясын (1880) ұсынды.
Мәселен, календарь, сағат немесе көбейту таблицасы тәрізді адам қажет етпей тұра алмайтын бір заттар болады. Химияның дәл сондай «көбейту таблицасы» химиялық элементтердің периодты системасы болып табылады. Оны 1869 жылы Д. И. Менделеев жасады.
Менделеев ауыл шаруашылығымен айналысты, сауда ісін зерттеді, түтінсіз дәрі құрамын жасап шығарды, әуеде ұшу ісіне де көңіл аударды . . . Оның Толық шығармалар жинағы қалың-қалың жиырма бес томнан тұрады. Ол дүние жүзінің көптеген елдерінің академиялары мен ғылыми қоғамдарына құрметті мүше болып сайланды. [3]
Менделеевтің дүние салуы - бүкіл ел қабырғасын қайыстырған ауыр қаза болды. Мыңдаған адам оны ақырғы сапарға аза тұтып шығарып салды. Менделеев Петербургтегі Волково зиратына жерленді. Азалы шеруге қатысушылар өздерімен бірге элементтердің периодты системасының үлкен кестесін алып жүрді. Ол Менделеевтің өзінен кейінгі ғалымдар ұрпағына қалдырған өсиеті сияқты еді.
Периодтық жүйесінің ашылу тарихы.
Алғашқы кестеде Менделеев әлі ашылмаған бірнеше элементтер бар екенін болжап, оларға кестеде тиісті орын қалдырып, кейбір қасиеттерін күні бұрын айтып берді. Сондай болжанған “экоалюминий” (1875 ж. француз химигі П. Лекок де Буабордан ашқан қазіргі галлий Ga), “экабор” (швед ғалымы Л. Нильсон 1879 ж. ашқан скандий Sc) және “экасилиций” (1886 ж. неміс ғалымы К. Винклир ашқан германий Ge) элементтері кейін ашылды. Сонымен қатар Менделеев марганецке (қазіргі технеций Тс және рений Re), теллурге (полоний Ро), йодқа (астат At), цезийге (франций Fr), барийге (радий Ra), танталға (протактиний Ра) ұқсас элементтердің бар екенін айтқан. Күні бұрын болжанған қасиеттер мен анықталған қасиеттердің дәл келуі Менделеевтің периодты заңын дүние жүзі ғалымдарына танытты. Радиоактивтік ыдыраудың (1806), рентген сәулелерінің (1895) ашылуы, неміс физигі М. Планктің сәуле шығарудың кванттық теориясын (1900), ағылшын физигі Э. Резерфордтың атомның планетарлық моделін (1911) жасауы, Н. Бордың атомның құрылыс теориясын ұсынуы (1913) атомның күрделі табиғаты мен периодтық жүйе құрылымының физ. мәнін түсіндірді. Ағылшын физигі Г. Мозли еңбектерінің нәтижесінде Менделеев ұсынған әр элементтің рет нөмерінің оның ядро зарядымен тең болуы, сондай-ақ атомдағы электрондар санының анықталуы, олардың орналасуындағы периодтық заңның тұтастай ішкі сырын ашты. Бор теориясын әрі қарай неміс физигі А. Зоммерфельдтің дамытуы, кейін швейцариялық физик В. Паули принципінің шығуы электрондық әр қабықта орналасу заңдылығын анықтады. Қазіргі Э. п. ж. 126 хим. элементті қамтиды, олардан трансуран элементтері (Z - 93 - 110) және кейбір элементтер Z - 43 (Tc), 61 (Pm), 85 (At), 87 (Fr) жасанды жолмен алынған. Менделеев периодтық жүйені жасағаннан бері оны кеңістікте немесе жазықтықта орналастырудың графиктік әр түрлі нұсқалары ұсынылғанмен, Менделеевтің ықшамды қысқа және ұзын периодты кесте түріндегі нұсқасы көбірек қолданылады. [4]
2. 3 Периодтық жүйе маңызы және құрылымы
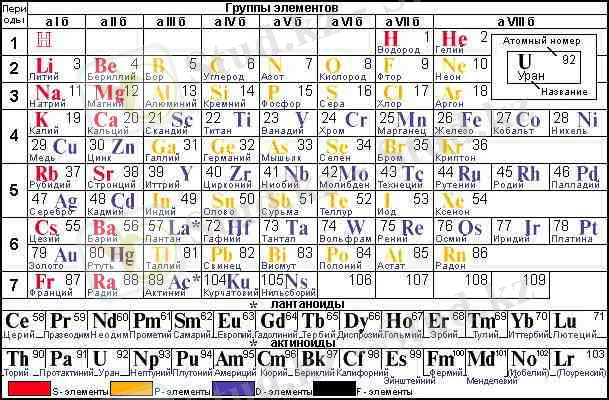
Қазіргі кездегі периодтық жүйеде барлық элементтер рет бойынша нөмірленген. Элементтердің нөмерін реттік немесе атомдық нөмер деп атайды. Химиялық элементтердің периодтық жүйесін құрастырудағы негізгі принцип - барлық элементтердегі периодтар мен топтарға бөліп орналастыру. Әр топ өз кезегіндегі негізгі (а) және қосымша (б) топшаларға бөлінеді (периодты кестенің ұзын түрін қара) . Топшалардағы элементтер өзара химиялық қасиеттері жағынан өте ұқсас.
Периодтар
Период деп сілтілік металдан басталып инертті газбен аяқталатын элементтер тобын айтады. Периодтар горизонталь қатардан тұрады. Периодтық жүйеде 7 период бар, олар рим сандарымен белгілеген, I, II және III периодтар бір қатардан тұрады және кіші периодтар деп аталады, ал IV, V, VI, VII периодтар екі қатардан тұрады, оларды үлкен периодтар деп атайды. Бірінші периодта-2 элемент, екінші және үшіншіде-8-ден, төртінші мен бесіншіде-18-ден, алтыншыда-32, жетіншіде(аяқталмаған) -32 элемент бар. Әрбір период, біріншіден басқасы, сілтілік металдан басталып, инертті элементпен аяқталады.
Әр периодта 2, 8, 18, 32 элемент болады.
Бірінші периодтың ерекшелігі - онда екі элемент қана Н, Не орналасқан. Сутектің сілтілік металдарға да, галогендерге де ұқсайтын ортақ қасиетіне байланысты оны көбіне Іa кейде VІҚа топшаға да орналастырады.
Екінші периодтта 8 элемент ( Lі - Ne) бар. Ол сілтілік металл литийден Lі басталады, одан кейінгі ІІ валентті Ве металл, ал ІІІ валентті В элементтінің металдық қасиеті кеміп, ІV валентті көміртектен бейметалдар басталады, олардың (N, О, F) тотығу дәрежелері теріс. Период инертті газ - неонмен (Ne) аяқталады.
Үшінші периодта да 8 элемент орналасқан (Na - Ar) . Олардың қасиеттерінің өзгеру сипаты екінші период элементтеріне ұқсас, дегенмен Mg-мен Al-дің Ве-мен В-ға қарағанда металдық қасиеті басымдау, сондай-ақ бейметалдар - P, S, Cl-дың екінші периодтағы “ұқсастардан” айырмашылығы олар өздеріне тән ең жоғары оң валенттіктерін көрсете алады. Менделеев 2 және 3-период элементтерін типтік элементтер деп атаған, себебі олардың бәрі де табиғатта кең таралған.
Алғашқы 3 периодтың элементтері негізгі топшаларға (а) ғана кіреді. Қазіргі технологиялар бойынша бұл периодтардың алғашқы екі элементі (сілтілік және сілтілік-жер металдар) Қа-, ІҚа- топшаларды құрайтын s-элементтерден тұрады (кестеден қызыл түске боялған), қалған алтауы (B - Ne, Al - Ar) ІІҚа, VІІҚа-топшаларды құрайтын р-элементтерден тұрады (кестеде сары түсті) . Кіші периодтар деп аталған бұл үш период элементтерінің рет нөмірі артқан сайын атом радиустары кішірейіп, кейінгі атомның сыртқы қабығындағы электрондар саны көбейгенде, олардың өзара ығысуының күшеюінен атом радиустары ұлғая бастайды. Ең үлкен радиус периодтың басында орналасқан сілтілік металға тән. Осындай заңдылық иондар радиусының өзгеруінен де байқалады.
Төртінші периодта 18 элемент бар ( К - Кr), ол - үлкен периодтардың алғашқысы. Мұнда сілтілік және сілтілік-жер металдардан кейін ауыспалы деп аталатын 10 элемент (Sc - Zn) орналасады. Бұларды d - элементтер деп атайды (кестеде көк түсті), олар да қосымша топшаларға кіреді. Ауыспалы элементтер түгелдей металдар, Fe - Co - Nі триадасынан басқасы өздеріне тән ең жоғары валенттіктерін көрсетеді. Соңғы алты p-элементтер (Ga - Kr) негізгі топшаға (a) кіреді, қасиеттерінің өзгеруі бұрын айтқан ІІ және ІІІ период элементтеріне ұқсас.
Бесінші периодта 18 элемент (Rb - Xe) бар, құрылысы төртінші периодқа ұқсас. Одан айырмашылығы ауыспалы элементтер де, ксенон да (Xe) өзіне тән ең жоғары оң валенттіктерін көрсете алады. Соңғы галоген - иодта аздаған металдық қасиет пайда болады.
Алтыншы периодта 32 (Cs - Rn) элемент бар. Онда ауыспалы 10 элементпен (La, Hf - Hg) қатар 14 f - элементтер, лантаноидтар (кестеде жасыл түсті) орналасқан.
Жетінші периодта да францийден (Fr) басталатын 32 элемент болуға тиісті, бірақ ол әлі аяқталмаған (12 элемент әлі табылған жоқ) . [5]
Мұнда да алтыншы периодтағыдай 89-элементтен кейін 14 f - элементтер - актиноидтар орналасқан (Th - Lr) . Олардың тотығу дәрежесі лантаноидтардан де жоғары болады (ІІІ - VІІ) . Лантаноидтар мен актиноидтар кестенің түрі ықшамды болу үшін төменірек жеке екі қатар етіп орналастырылған. Оларды кестедегі өздерінің заңды орнына қойып горизонталь периодтарды ұзартсақ периодтық түр шығады. Онда атомдардың электрондық құрылымына сай ұқсастығын анығырақ байқауға болады. Қысқа кестедегі топ нөмірі, жалпы алғанда, ондағы элементтердің валенттігі электрондар санына сай келеді. Бір топшадағы элементтердің ұқсастығы олардың валенттік қабаттарының электрондық конфигурациясының периодты түрде қайталанып келіп отырғандығымен түсіндіріледі. Элементтер қасиеттерінің периодты түрде қайталануы олардың электрондық құрылымының периодты қайталануымен сай келетіні де осыдан. Атомдардағы электрондық конфигурацияның қалыптасуын жалпы былай көрсетуге болады:
Қатарлар
Периодтарда араб сандарымен белгіленген 10 қатар кіреді. Үлкен периодтардың жұп қатарларында (төртінші, алтыншы, сегізінші және оныншы) тек металдар тұр және бұл қатарлардағы элементтердің қасиеттері аздап қана өзгереді. Үлкен периодтардың тақ қатарларындағы (бесінші, жетінші, тоғызыншы) элементтің қасиеттері қатардағы типтік эдменттердегі сияқты солдан оңға қарай өзгереді.
Менделеев II және III период элементтерін типтік деп атады. Бұл элементтердің қасиеттері типтік металдан екідайлы элементтерге одан бейметалл мен инертті газға қарай заңдылықпен өзгереді. Сонымен қатар периодтарда элемент қосылыстарының қасиеттері және формалары да заңдылықпен өзгереді.
Үлкен периодтардың элементтері тотығу дәрежелері бойынша (Менделеевтің кезінде-валенттілік бойынша) екі қатарға бөлінген. Мысалы IV периодтағы элементтердің тотығу дәрежелері жұп) екі қатарға бөлінген. Мысалы IV периодтағы элементтердің тотығу дәрежелері жұп қатарда K-ден Mn-ке қарай +1 -ден +7-ге дейін артады, оған жалғасып сегізінші топта Fe, Co, Ni триадасы келеді, содан соң қайтадан тотығу дәрежелерінің артуы тақ қатардағы Cu-тан Br-ға дейінгі элементтерде байқаладаы. Қалған үлкен периодтарда да дәл осылай болады.
VI периодта лантаннан кейін реттік нөмерлері 58-71-ге тең 14 элементтері лантаноидтар деп атайды (лантанға ұқсастар) . Лантаноидтар кестенің төменгі жағында жеке орналастырылған, олардың жүйеде орналастыру кезектестігі ұяшықта былайша көрсетілген La-Lu. Лантаноидтардың химиялық қасиеттері өте ұқсас.
VII периодта реттік нөмерлері 90-103-ке дейін 14 элементті актоноидтар деп атайды. Оларды лантаниодтардың төменгі жағынан жеке орналастырады, ал сәйкес ұяшықта олардың жүйеде орналасу кезектестігі көрсетілген:Ac-Lr. Көптеген актонидтар радиоактивті. [6]
Топтар
Тігінен орналасқан элементтердің қатарын топтар деп атайды. Периодтық жүйеде сегіз топ бар, олардың нөмері рим сандарымен белгіленген. Топ нөмері элементтің ең жоғарғы тотығу дәрежесіне сәйкес келеді. Фтордың тотығу дәрежесі әрқашан -1-ге тең, мыс, күміс, алтынның тотығу дәрежелері +1, +2, +3-ке тең, ал VIII топ элементтерінен +8 тотығу дәрежесі тек осмий, рутений, ксенонға тән.
Әрбір топ-негізгі(A) және қосымша (Б) деп екі топшаға бөлінеді. Негізгі топшаны табиғи ұялас элементтер құрайды; оған типтік элементтер (II және III период элементтері) және химиялық қасиеттері соларға ұқсас үлкен периодтардың элементтері кіреді. Қосымша топшаны үлкен периодтың элементтері -металдар ғана құрайды.
VIII топ қалған топтардан ерекшеленеді. Инертті газдарың негізгі топшасынан басқа, онда үш қосымша топша бар: темір топшасы, кобальт топшасы, никель топшасы, оларда көлденіңінен алғанда триада деп атайды, мәселен, темір триадасы: Fe, Co, Ni.
Негізгі және қосымша топша элементтері химиялық қасиеттерімен ерекшеленеді. Мысалы, VII топтың негізгі топшасын бейметалл галогендер:F, Cl, Br, I, At, ал қосымша топшасын металдар:Mn, Tc, Re Топшалар өзара ұқсас элементтерді біріктіреды.
Бір топта орналасқан элементтер ұқсас отттекті қосылыстар түзеді. Периодтық жүйеде әрбір топтың астында элементтердің жоғарғы оксидтерінің жалпы формуласы берілген: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4 мұндағы R сол топтың элементі. Жоғарғы оксидтерінің формулалары топтың барлық элементтеріне қатысты, тек қана элемент топтың нөмеріне тең тотығу дәрежесінкөрсетпейтін кезде ғана бұл формула сәйкес келмейді.
Блоктар
Тік сызықтар кестеде периодтарды бөліп тұрады. Паули принципіне сай әрбір электрон қабығының сыйымд. 2п2, ал ондағы орбиталдар сыйымд. 2(2l+1) . Бұдан әрбір периодтың сыйымд. 2, 8, 8, 18, 32, 32 . . . Әр периодтың басы жаңа мәніне сай келетін s - элементтен басталады ( Қа-, ІҚа-топшалар), соңы р - элементтермен аяқталады (ІІҚа-VІІІa-топшалар) . Үлкен периодтарда (ІV - VІІ) олардың арасына 10 d - элементтер (Іб-VІІІб-топшалар) кіреді. Ауыспалы элементтердің соңғы электрондары ішкері жатқан п-1 қабаттың d - орбиталарын толтырады, ал сыртқы қабатында s2 электрондар сақталады. Сондықтан олар металдық қасиет көрсетеді. Лантаноидтар мен актиноидтардың соңғы электрондары ішкеріден де ішкерірек жатқан п-2 қабаттың f - орбиталарына толады. f - элементтер де түгелдей металдар. Э. п. ж-ның жоғары шегі анықталмаған. Рет нөмірі 101-ден асқан элементтердің өмірі тым қысқа. Теор. болжамдар 114, 126, 164, 184 элементтер атомдарының ядролары біршама берік болуға тиіс деп санайды. Сондықтан оларды қолдан синтездеу мүмкіндігі бар. Периодтағы элементтердің қасиеттері былайша өзгереді: әр период (І-ден басқасы) күшті сілтілік s - металмен басталады, әрі қарай металдық қасиет кеміп, амфотерлі қасиеті бар элементтер басталады, одан бейметалдарға ауысып, бейметалдық қасиет артып, олардың ең күштілері галогендерде байқалады да, инертті элементпен бітеді. Үлкен периодтарда металдық қасиет өте баяу кемиді, өйткені оларда s-тен соң d және f - металдар орналасады, тек соңында ғана бейметалл p-элементтер орналасқан. Негізгі топшалардағы элементтердің металдық қасиеті жоғарыдан төмен қарай атом радиустары ұлғайған сайын кеміп, керісінше бейметалдық қасиет артады. Қосымша топшалардағы элементтерде жоғарыдан төмен қарай металдық қасиет аз ғана артып, немесе аса көп өзгіріске ұшырамайды. Атомдардың электрондық құрылымына тәуелді периодты өзгеретін қасиеттер мен сипаттамалар көп, олардың бастылары: атом радиустары, ион радиустары, иондалу потенциялы, электрон тартқыштық, теріс электрлік, валенттілік, оптик. және магн. қасиеттері, т. б. Элементтерді жай зат ретінде қарасақ, периодты қайталанатын қасиеттердің саны артады, жай заттардың соғылғыштығы, қаттылығы, ұлғаю және сыну коэфф-тері, тығыздығы, стандартты тотығу-тотықсыздану потенциалдары, т. б. периодты өзгеретін қасиеттер элементтер қосылыстарында да кең таралған. Э. п. ж. - периодтық заңның графиктік бейнесі, олар өзара тығыз байланысты, бірін-бірі толықтыра түседі. Екеуі де хим. элементтерді материя дамуының бір сатысы деп қарап, олардың арасындағы табиғи байланысты ашады. Периодты заң химия ғылымына ғана жатпайды, ол бүкіл жаратылыстану және табиғи ғылымдардың ортақ заңы, сондықтан ғылыммен бірге дамып, оны байыта түседі. [7]
Химиялық элементтердің периодтық жүйедегі маңызы
Д. И. Менделеевтің периодтық заңы химия ғылымдарын дамуына зор ықпалын тигізді. Периодтық заң барлық элементтерді бір жүйеге келтірді. Жеке алынған бір элементтің қасиеттерін кестедегі оны қоршаған басқа элементтердің қасиеттері арқылы анықтауға мүмкіндік туды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz