Молекулалық-кинетикалық теорияның негіздері: 10-сыныпқа арналған электрондық оқулық


Молекулалық-кинетикалық теория негiздерi
Орта мектептiң 10-сыныбына арналған электрондық оқулық
§ 1. 1 Молекулалық-кинетикалық теорияның негiзгi ұғымдары
Дене құрылымының молекулалық кинетикалық теориясы деп барлық денелер жеке бейберекет қозғалыстағы бөлшектерден тұрады деген көзқарас негiзiнде макроскоптық денелердiң қасиеттерi мен жылу процестерiне түсiнiк беретiн iлiмдi айтады.
Молекулалық-кинетикалық теория (МКТ) негiзi мынадай үш қасиеттен тұрады:

Бұл тұжырымдардың ақиқаттылығы көптеген физикалық бақылаулар мен тәжiрибелер жүргiзу арқылы дәлелденген. МКТ-ның негiзгi көзқарастарына ең нақты дәлел бола алатын мысалдар:
броундық қозғалыс құбылысы (Броун) ; молекулалық диффузия құбылысы; қазiргi заманғы приборлар көмегiмен алынған жеке атомдар мен молекулалар кескiнi. 1-шi суретте вольфрам инесiнiң ұшында атомдардың орналасуы (ақ дақтар), ал 2-шi суретте кремний пластинасы бетiнiң микрофотографиясы келтiрiлген, мұндағы дөңдер - кремнийдiң жеке атомдары.
§ 1. 2 Молекуллар массасы мен өлшемi. Салыстырмалы молярлық және молекулалық масса. Авогадро саны.
Әртүрлi денелер молекуласының масса бiрлiгi ретiнде 12 С көмiртегi изотобы атомының m oc массасының 1/12 бөлiгi алынады. Ол атомдық масса бiрлiгi (а. м. б. ) деп аталады және мынаған тең:
1 а. м. б. =1, 66·10 -27 кг . (1. 1)
Заттың салыстырмалы молекулалық массасы М R деп заттың бiр молекула m 0 массасының көмiртегi атомы m oc массасының 1/12 бөлiгiне қатынасын айтады:
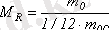 (1. 2)
(1. 2)
Зат мөлшерi деп берiлген жүйенiң бөлшектерiнiң, құрылымдық элементерiнiң, санына пропорционал ν шаманы айтады. Оны моль арқылы жазу қабылданған. Массасы 0, 012 кг 12 С көмiртегiнде қанша атом болса, сонша молекуладан (атомнан) тұратын зат мөлшерi бiр моль деп аталады. Бұл сан Авогадро тұрақтысы деп аталады және N A арқылы белгiленедi:
N A ≈ 6·10 23 моль -1 . (1. 3)
Сәйкесiнше, кез келген заттың 1 молiнде атомдар саны мен молекулалар саны бiрдей болады. Егер денедегi зат мөлшерi ν мольден тұрса, онда денедегi молекулалар N саны мынаған тең:
N = ν · N A . (1. 4)
Заттың молярлық массасы М деп бiр моль мөлшерiнде алынған зат массасын айтады. Ол бiр молекула массасының m 0 Авогадро санына N A көбейтiндiсiне тең:
М = m 0 · N A кг/моль . (1. 5)
Молярлық және молекулалық массалар арасында мынадай қарапайым байланыс бар:
М = 10 -3 ·М r кг/моль . (1. 6)
Кез келген зат мөлшерiнiң m массасы бiр молекуланың массасын денедегi молекулалар санына көбейткенге тең:
m = m 0 · N кг . (1. 7)
(1. 5) және (1. 7) формулаларын пайдаланып (1. 4) өрнегiнен мынаны алу қиын емес:
ν = m / М және N = ν·N A = N A A ·m / M . (1. 8)
Бөлшектердiң массасымен өлшемдерiн қосымша тәжiрибелiк деректердi пайдалана отырып есептеуге болады. Жеке жағдайда, молекулалардың сызықты өлшемдерiн бағалауға болады.
Молекуланың өлшемiн былайша анықтауға болады. Бiр молекуланың алатын
V
0
көлемi зат
V
көлемiнiң, ондағы молекулалар
N
санына қатынасына тең:
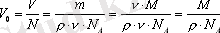 , мұнда
ρ=m/V
- заттың тығыздығы. Молекуланың формасы радиусы r шар тәрiздес болсын. Сондықтан
, мұнда
ρ=m/V
- заттың тығыздығы. Молекуланың формасы радиусы r шар тәрiздес болсын. Сондықтан
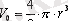 . Осыдан:
. Осыдан:
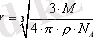 (1. 9)
(1. 9)
Мысалы, су молекуласының радиусы мына шамаға тең:
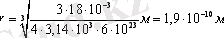 .
.
§ 1. 3 Молекулалар арасындағы өзара әсерлесу күштерi. Сұйық, газ тәрiздес және қатты денелердiң құрылымы
Молекулалар қозғалыс кезiнде бiр-бiрiмен өзара тартылыс және тебiлiс әсерiнде болады. 1. 3 суретте молекулалық өзара әсерлесу күштерiнiң таралуы молекулалар арасындығы
r
арақашықтықтан тәуелдiлiгi келтiрiлген. Тартылу және тебiлу күштерi
r
-дан тәуелдiлiгi әртүрлi, сондықтан олардың қорытқы күшi нөлден өзгеше. Белгiлi бiр
r
=
r
0
арақашықтықта тебiлу күшi арасында тепе-теңдiк орнайды. Молекулалардың диаметрiмен салыстырылатын бұл арақашықтық тепе-теңдiк жағдайына сәйкес келедi.
r
<
r
0
болғанда тебiлу күшi тартылу күшiнен басым болады. Сондықтан молекулалар бiр-бiрiне ене алмайды. Олардың арасындағы арақашықтық
r
>
r
0
өскен сайын, молекулалардың тартылуы тебiлуiн жеңе бастaйды. Олардың ыршып кетуiне жол бермейдi.
r
>>
r
0
кезiнде, молекуларалық күштердiң әсерi болмайды.

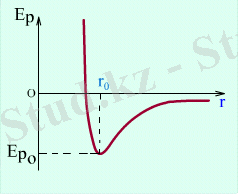
1. 4 суретте молекулалардың E p потенциалдық энергиясының r арақашықтықтан тәуелдiлiгi көрсетiлген. Орнықты тепе-теңдiк ( r=r 0 ) жағдайында өзара әсерлесетiн екi молекуладан тұратын жүйенiң потенциалдық энергиясы E p0 минимумына жетедi. E p0 шамасын потенциалдық шұңқырдың тереңдiгi деп аталады. E k -ны E p0 -мен салыстыру заттың үш агрегаттық күйлерiн ажыратуға мүмкiндiк бередi: газ, сұйық, қатты күйi. Атап айтқанда: егер E k >> E p0 , онда зат газ күйiнде, E k < E p0 кезiнде - қатты дене, ал E k ≈ E p0 - зат сұйық күйiнде болады.
§ 1. 4 Газдың молекулалық-кинетикалық теориясының негiзгi теңдеуi
Идеал газ деп молекулалардың өзара әсерлесуi ескерусiз аз шама болғанда айтады. Молекулалардың өзара әсерлесуi олардың соқтығысуы кезiнде серпiмдi ұрылуы түрiнде байқалады.
Газ молекулалары барлық уақытта ретсiз жылулық қозғалыста болады, оның мөлшерлiк сипаттамасын молекуланың сызықты жылдамдығының орташа квадраты, дәлiрек айтқанда, кинетикалық энергиясының орта мәнi бередi. Жеке молекулалардың жылдамдықтары бiр-бiрiнен өзгеше болуы мүмкiн, бiрақ бұл жылдамдықтардың модулiнiң орташа мәнi белгiлi бiршама. Жеке молекулалардың жылдамдықтарын v 1 , v 2 , v 3 , . . . , v N арқылы белгiлеймiз. Сонда, жылдамдықтардың квадратының орташа мәнi келесi формуламен анықталады:
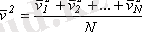 ,
,
мұнда,
N
- газдағы молекулалардың жалпы саны. Екiншi жағынан
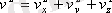 . Қозғалыстың бейберекеттiгi әсерiнен молекулалардың барлық бағыттарда орынауыстыруы тең мүмкiндiкте. Сондықтан, жылдамдықтың проекциясының квадраттарының орташа мәндерi өзара тең:
. Қозғалыстың бейберекеттiгi әсерiнен молекулалардың барлық бағыттарда орынауыстыруы тең мүмкiндiкте. Сондықтан, жылдамдықтың проекциясының квадраттарының орташа мәндерi өзара тең:
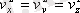 . Бұны ескере отырып, алатынымыз
. Бұны ескере отырып, алатынымыз
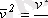 (1. 10)
(1. 10)
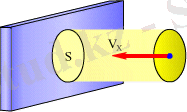
Ендi идеал газдың ыдыс қабырғасына әсер ететiн күшiн табайық. Қоршаған ортаның қандайда бiр бетке әсерiнiң физикалық сипаттамасы - күш емес қысым болып есептеледi. Қысым деп бiрлiк ауданға нормаль бойымен әсер ететiн күштi айтады. Қысым p әрпiмен белгiленiп, анықтамасы бойынша мынаған тең: p=F n /S , мұнда S - бет элементiнiң ауданы, ал F n - бет элементiне перпендикуляр әсер ететiн күш шамасы (1. 5 - сурет) .
Идеал газ жағдайында F n нормаль күштiң шамасы келесi өрнекпен анықталады:
 (1. 11)
(1. 11)
мұнда, n - газ молекуласының концентрациясы (бiрлiк көлемдегi молекулалар саны: n=N/V ), m 0 - молекула массасы.
Бұл қатынастың қорытындысы.
Газдың барлық молекулаларда
v
x
жылдамдық мәнi бiрдей бола бермейдi, олай болса қабырғаға әсер ететiн күштiң уақыт бойынша орта мәнi
v
2
x
-қа емес, жылдамдықтарының орташа квадратына пропорционал:
 . (1. 10) -шi формуланы ескере отырып, алатынымыз:
. (1. 10) -шi формуланы ескере отырып, алатынымыз:
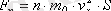 Анықтамасы бойынша
p = F
n
/S
. Бұдан шығатыны
Анықтамасы бойынша
p = F
n
/S
. Бұдан шығатыны
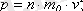 (1. 12)
(1. 12)
Егер
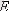 арқылы молекуланың iлгерлемелi қозғалысының орташа кинетикалық энергиясын белгiлесек:
арқылы молекуланың iлгерлемелi қозғалысының орташа кинетикалық энергиясын белгiлесек:
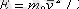 , онда (1. 12) теңдеуiн басқаша түрде жазуға болады
, онда (1. 12) теңдеуiн басқаша түрде жазуға болады
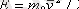 (1. 13)
(1. 13)
(1. 12) немесе (1. 13) қатынастар газдардың молекулалық-кинетикалық теориясының негiзгi теңдеулерi болып табылады. Олар, тiкелей өлшенетiн, макроскоптық шама - қысымды қозғалыстағы молекулаларды сипаттайтын микропараметрлармен байланыстырады.
§ 1. 5 Газдың макропараметрлерi. Tемпература және оны өлшеу
Дененiң молекулалық-кинетикалық құрылымы ескерiлмегенде макроскоптық дене күйiн сипаттайтын шамаларды макроскоптық параметрлер деп атайды.
Бұндай шамалар қатарына көлем V , қысым P , температура T және басқалар. Көлем мен қысым механикалық сипатталатын шамалар. Температура дененiң қызу дәрежесiн бередi, оның iшкi энергетикалық күйiн анықтайды.
Егер қандайда бiр оқшауланған жүйенi құрайтын денелер температурасы бастапқы уақытта әртүрлi болса, онда уақыттың келесi мезеттерiнде олар бiртiндеп теңесе бастайды да ақырында бiрдей болады, денелер арасында жылулық тепе-теңдiк орнайды.
Жүйенiң жылулық тепе-теңдiгi деп оның барлық макроскоптық параметрлерi қай уақытта да ұзақ өзгерiссiз қалуын айтады.
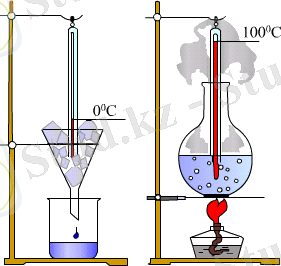
Осылайша, температура денелер жүйесiнiң жылулық тепе-теңдiк күйiн сипаттайды, атап айтқанда: өзара жылулық тепе-теңдiкте тұрған жүйенiң барлық денелерiнiң температуралары бiрдей болады . Оны өлшеу үшiн кез келген макроскоптық белгiлi шаманың температурадан тәуелдiлiгiн пайдалануға болады. Практикада дененiң жылулық кеңу қасиетi жиi қолданылады, атап айтқанда, қысым тұрақты болғанда сұйық көлемiнiң өзгеруiнiң температурадан тәуелдiлiгi. Температураны өлшейтiн прибор - термометр, осы принципте құрастырылған. Термометрдi градуирлегенде санақ басын (0 деңгейiн) мұздың еру температурасын алады. Екiншi тұрақты нүктесi (мәнi) ретiнде (100 деңгейi) қалыпты атмосфералық қысымда судың қайнау температурасы алынады (1. 6 - сурет) .

Бұл Цельсийдiң градустер шкаласы деп аталады. 0-мен 100 нүктелерiнiң аралығын градус деп аталатын теңдей 100 бөлiкке бөлiнген (1. 7 - сурет) . Сұйық бағанының бiр бөлiкке жылжуы (орынауыстыруы) температураның 1 градус Цельсийге өзгеруiне сәйкес келедi. Әртүрлi сұйықтардың қыздырылғанда кеңуi (ұлғаюы) бiрдей болмағандықтан, термометрлерде оған сәйкес градуирленген.
§ 1. 6 Температура - идеал газ молекуласының орташа кинетикалық энергиясының өлшемi
Барлық газдар жылу тепе-теңдiгi кезiнде температуралары бiрдей болады. Молекулалардың жылулық қозғалысы сөз болғандықтан, температураны молекулалық деңгейдегi физикалық шамалар арқылы жазу керек. Бұндай шама ретiнде молекуланың iлгерлемелi қозғалысының кинетикалық энергиясын алуға болады. Бұл жорамал үш ыдыспен жасалған тәжiрибеде толық дәлелденедi.
Тәжiрибе көрсеткендей, θ=pV/N қатынасы температурадан басқа ештеңеден тәуелдi емес, сондықтан оны Т температураның бiрден-бiр өлшемi ретiнде қарастыруға болады.
θ = kТ немесе pV/N = kT , (1. 14)
мұнда k - Больцман тұрақтысы деп аталатын пропорционалдық коэффициентi.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz