Этилбензолды азот және күкірт қышқылдарының қоспасымен нитрлеу: 25-30 °C шартындағы синтез және изомерлік шығымдардың талдауы


ДӘЙЕКТЕМЕ
«Этилбензолды нитрлеу процесін зерттеу» тақырыбы бойынша орындаған дипломдық жұмыста этилбензолды нитрлейтін қоспа (Азот және күкірт қышқылдары) арқылы нитрлеу зерттелген. Бұл процес 25°С - 30°С температурада жүргізілген. Процесс нәтижесінде нитроэтилбензолдың екі изомерлері түзілген: -о-нитроэтилбензол, шығымы 14, 9 г (33%) және п-нитроэтилбензол, шығымы 19, 4 г (43%) .
Бұл жұмыста нитрлеу процесінде қолданатын аспаптар схемасы және процесті жүргізу барысы келтірілген. Нитрлеу процесі арқылы алынған мәліметтері мұқиат талқыланған. Нитроэтилбензолдардың шығым мөлшерлері басқа нитрқосылыстардың әдебиеттік көрсеткіштермен салыстырып оларға теориялық деңгейде түсініктеме берілген.
АННОТАЦИЯ
Дипломная работа на тему «Исследования процесса нитрования этилбензола» посвящена изучению нитрования этилбензола нитруюшей смесью (смесь азотной и серной кислоты) при температуре 25°С - 30°С. В результате синтеза получены два изомера нитроэтилбензола: о-нитробензол, выход 14, 9 г (33%) и п-нитроэтилбензол, выход 19, 4 г (43%) .
В работе приведена схема прибора процесса, а также ход проведения нитрования. Была дана сравнительная оценка выхода нитроэтилбензолов с результатами литературных даных выхода разных нитросоединений ароматических углеводородов разной природы строения.
SUMMARY
Degree work to subjects "Studies of the process nitroreakcio etilbemzol" is dedicated to study nitroreakcio etilbenzols nitruishei by mixture (the mixture nitric and chamois of the acid) at the temperature 25° С - 30° С. As a result of syntheses are received two izomera nitroetilbenzol: о- nitroetilbenzol, output 14, 9 (33%) and п- nitroetilbenzol, output 19, 4 (43%) .
In work is brought scheme of the instrument of the process, as well as move of the undertaking nitroreakcio. Is given comparative estimation of the output nitroetilbenzols with result literary output data different nitrosoedinenie aromatic hydrocarbon to nature miscellaneous of the construction.
МАЗМҰНЫ
АННОТАЦИЯ . . . 1
МАЗМҰНЫ . . . 2
КІРІСПЕ . . . 3
І БӨЛІМ. ӘДЕБИЕТТТІК ШОЛУ
1. 1. Ароматты көмірсутектерге сипаттама
1. 2. Гетероциклды қосылыстарға жалпы сипаттама
1. 3. Нитрлеу процесіне сипаттама
1. 3. 1. Ашық тізбекті қосылыстарды нитрлеу
1. 3. 2. Ароматты қосылыстарды нирлеу механизмі
1. 3. 3. Парафин қосылыстарының нитрленуі
1. 3. 4. Гетероциклды қосылыстарды нитрлеу
ІІ БӨЛІМ. ЭКСПЕРИМЕНТТІК БӨЛІМ
2. 1. Этилбензолды нитрлеу процессі
2. 2. Нитрлеу процесіне қажетті реактивтер
2. 3. Қажетті құрал жабдықтар
2. 4. Нитрлеу процесінің барысы
ҚОРЫТЫНДЫ . . . ПАЙДАНЫЛҒАН ӘДЕБИЕТТЕР ТІЗІМІ . . .
КІРІСПЕ
ЖҰМЫСТЫҢ ЖАЛПЫ МАЗМҰНЫ
Зерттеудің өзектілігі: Органикалық нитроқосылыстар химия өнеркәсібінде кеңінен қолданылады. Олардың қатарына қопарғыш, бояғыш, инсектицид тағы да басқа заттар жатады. Мысалы, нитроэтилбензолдан анилинді, анилиннен бояғыш заттарды синтездейді, нитротолуолдан тротил қопарғыш затты синтездеп алады. Сол себептен нитроэтилбензолды синтездеп алу процесінің маңызы үлкен және тиімді.
Негізінен азоты бар органикалық қосылыстар әртүрлі дәрілік заттар алу үшін қолданылады. Ал азотты гетероциклді қосылыстардың маңызы жоғары дәрілік заттарда және ауыл шаруашылық өнімдерін бірқалыпты ұстауды және зиянкестерден қорғауды қамтамасыз етеді.
Зерттеудің мақсаты мен міндеттері: Бұл дипломдық жұмыстың негізінен мақсаты нитрлеу реакциясы арқылы этилбензолды нитрлеу қоспасымен нитрлеп, о- нитроэтилбензол мен п-нитроэтилбензолды синтездеп алу және түзілген қосылыстардың мөлшерін анықтау болып табылады және жұмыс барысында синтезделген о-нитробензолдың шығымы (33%) п-изомердің шығымынан (43%) қандай себептен кем болғанын теория жүзінде түсіндіру болды.
Түзілген қосылыстардың шығым мөлшеріне этил радикалдың әсерін түсіндіріп өту. Этил радикалы бензол ядросының орто-орнына жақын орналасқандықтан о-нитроэтилбензолдың шығым мөлшері п-нитро-этилбензолдың шығымына қарағанда кем болады. Себебі этил радикалының көлемі үлкен болғандықтан орто- орындарына нитротоптың жақын келуіне кедергі жасайды.
Зерттеу обьектісі: этилбензол, о- нитроэтилбензол, п-нитроэтилбензол.
Зерттеу пәні: Биологиялық активті органикалық заттарды синтездеу.
Зерттеудің ғылыми жаңашылдығы: Қазіргі таңда органикалық қосылыстардың нитрлеу процестері толық зерттелді десек те болады. Оған қармастан нитрлеу процесі әлі де жоғары ғылыми деңгейде зерттеліп, нәтижесінде бағалы жаңа нитроқосылыстар ситезделуде. Бұл жұмыста этилбензолды нитрлеу арқылы өндіріске қажетті нитроқосылыстарды - о-нитроэтилбензол және п-нитроэтилбензолдардың қоспасы синтезделді. Синтезделген нитроқосылыстардан ауыл шаруашылығына және денсаулық саласында кеңінен қолданылады. Және де синтезделген нитроқосылыстарды хош иісті немесе қопарғыш заттарды ситездеуге қолдануға болады.
Зерттеу кезеңдері: Қойылған мақсаттар мен міндеттерге жету үшін зерттеу әдістерінің толық кешені қолданылды.
Бірінші кезеңде зерттеу проблемасы бойынша өзекті мәселенің тұжырымдамалық және теориялық дәлелдемелері, жинақтау материалдарының мазмұны, тақырыптың мағыналылығы, зерттеудің әдістері, зерттеудің кемшіліктері, теорияның өзектілігі айқындалды.
Екінші кезеңде зерттеу проблемасы бойынша тәжірибелік-эксперименталдық жұмыстар толық қанды жүргізіліп, қорытынды жасалды.
Жұмыстың кемшілігі: Бұл жұмыста химия өндірісінде кеңінен қолданылатын нитроэтилбензолдардың орта- және пара- изомерлері синтезделген. Синтездеу процесінің кемшілігі процес бір ғана температурада жүргізіліп, нәтижесінде орта- және пара- изомерлер алынған. Мұның себебі: тәжірибе жүзінде бес түрлі температурада жүргізілген эксперименттер түпкілікті нәтиже бермеді. Бірінің құрамы өзгеріп кетсе, екінші бір сынақтың құрамы анықталмады.
Зерттеу жұмысының құрылымы мен көлемі. Дипломдық жұмыс кіріспеден, 2 тараудан, тәжірибелік-эксперименталдық жұмыстың нәтижесінен, тұжырымдама, қорытынды мен пайдаланылған әдебиеттер тізімінен тұрады.
І БӨЛІМ. ӘДЕБИЕТТЕРГЕ ШОЛУ
1. 1. Ароматты көмірсутектерге сипаттама
Химия өндірісінде нитрлеу процесі ең маңызды, ең пайдалы процестердің бірі десек те болады. Органикалық заттардың молекуласына (-NO 2 -) нитротобын енгізу процесі, нитрлеу процесі деп аталады. Нитрлеу процестері электрофильдік, нуклеофильдік немесе радикалдық механизмдер арқылы жүреді. Ароматтық көмірсутектердің молекуласына нитротопты азот қышқылы немесе азот және күкірт қышқылдарының қоспасымен әрекеттестіріп болғаннан соң ғана енгізеді. Нитрлеу процестері бойынша алынған өнімдер қопарғыш заттарды, фармацептикалық өндірісте өндірілетін дәрі-дәрмектерді өндіруге қолданылатын жартылай фабрикат ретінде кеңінен пайдаланылады. Бұл жұмыста этилбензолдың нитрлеу процесі азот пен күкірт қышқылының қоспасымен әрекеттесуі зерттелген.
Органикалық қосылыстарды нитрлеу реакциялары тек 1834 жылы Митчерлик ашқан бензолды нитрлеу реакциясынан бастап қана жүргізіле бастады [1] . Оған дейін нитрлеу реакциясы толық зерттелмеген еді.
Қазіргі уақытта органикалық қосылыстарды нитрлеу процесінің механизмдері, нитрлеуші реагенттердің табиғаты және олардың әсері толық зерттеліп анықталды десек те болады [2, 5] . Бірақ әлі де нитрлеу процесі жоғары ғылыми деңгейде зерттелуде және өндіріске, ауыл шаруашылығына қажетті бағалы жаңа нитроқосылыстар синтезделуде.
Нитроқосылыстар бұдан бұрын да үлкен сұранысқа ие болған, әсіресе, қазіргі таңда халықшаруашылығында кеңінен қолданылуда. Олардың қатарына қопарғыш, бояғыш заттар, инсектицидтер, фунгицидтер, дезинфекциалайтын, консервілейтін заттар жатады [4, 5] . Және де нитротоп (-NO 2 ) көптеген бағалы дәрі- дәрмектердің молекуласының құрамында кездеседі. Осыған орай нитроқосылыстардың арасында көптеген микробтарға қарсы және де паразиттерге қарсы дәрі- дәрмектер, аэрозольдар кездеседі, мысалы фурацилин, левомицетин, п-нитробензилпенициллин және тағы басқалар. Нитроқосылыстар дәрі- дәрмектер мен витаминдерді синтездеуге арналған аралық өнім болып табылады.
Инсектицид, фунгицид ретінде динитрофенолдар (нитрофен деп аталатын зат) қолданылады. Динитрорезорцин капсуль-детанатор зарядын дайындау үшін үлкен қолданысқа ие болып отыр. Ал, тринитротолуол, тринитроглицерин күшті қопарғыш заттар ретінде өндірісте пайдалынылады. Тринитробензол да күшті қопарғыш зат болып табылады, бірақ оны жиі қолданбайды.
Бояғыш заттарды синтездеу үшін қолданылатын келесі аралық қосылыстар: 2, 4-динитрофенол, о-нитроанилин, п- нитроанилин, м- хлоранилин, о-нитроанизолдар, п-нитроанизолдарды нитрохлорбензол қосылыстарының қатысуымен жүргізіліп синтезделеді. Бояғыш зат - анилинді синтездеп алу үшін нитробензол қолданылады, ал нитротолуол бояу өндірісіндегі негізгі аралық өнім ретінде пайдалынылады.
Үшіншілік бутил тобы бар ароматты өздеріне тән хош иістері болғандықтан оларды парфюмерияда, сонымен қатар арзан сабын өндірісінде кеңінен қолданады және бояу өндірісінде үлкен сұранысқа ие [11] .
Құрамындағы азоттың мөлшеріне қарай нитроцеллюлозаныда әр түрлі заттар ретінде қолданады. Құрамындағы азоттың мөлшері 11, 5 -12, 2 % -ға тең нитроцеллюлозаны «Коллоксилин» деп атайды. Коллоксилиннен ракеталарды ұшыруға қолданатын «Баллистит» деп аталатын отынды (оқ-дәрі - порох) дайындайды. Ал коллоксилинді динамит қопарғыш заттарын дайындауға пайдаланады [15] .
Нитроцеллюлозаның құрамындағы азоттың мөлшері коллоксилиндегіден аз болса, ол «Пироксилин» деп аталады. Мұндай қосылыстан жасанды тері алуға, целлюлоид заттарын дайындау үшін де кең дәрежеде қолданады. Нитроцеллюлозаның пироксилиніненде оқ-дәріні дайындауға қолданады. Құрамында азоттың мөлшері өте аз нитроцеллюлозаның ерітінділерінен кино-, фотопленкалар, нитролактар, нитрожелімдер жасайды.
Молекуласында бензол сақинасы бар көмірсутектерді ароматтық көмірсутектер деп атаймыз. Ароматты қосылыстардың ең қарапайым өкілінің бірі - бензол. Енді бензолдың құрылымдық формуласына келетін болсақ. Табиғатта бензолдың бірнеше құрылымдық формулалары кездеседі:
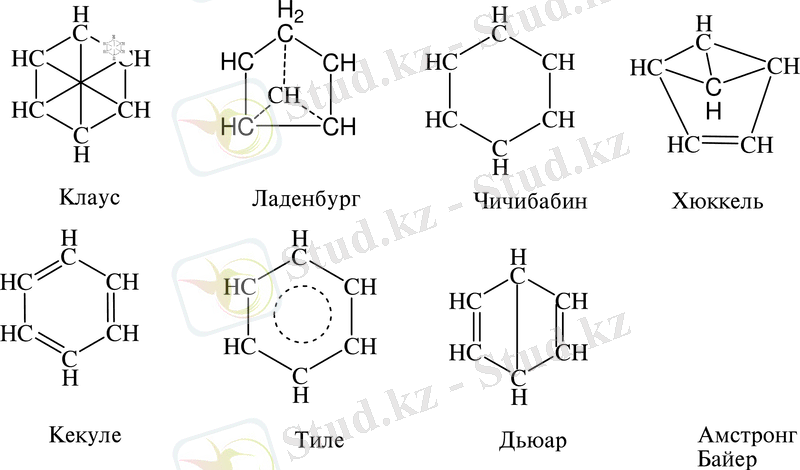
1-сурет. Бензолдың құрылымдық формулалары
Бірақ осылардың ішінде ең ыңғайлысы Кекуле ұсынған формула болып табылады. 1865 жылы Кекуле бензолдың циклды формуласын ұсынып, оны эксперимент түрінде толық қанды дәлелдеп шықты. Кекуле формуласы бензолдың элементарлық құрамына сәйкес келгенімен, оның көптеген қасиеттерін сипаттай алмады. Бұл формула тек ароматты қосылыстардың қосып алу қасиеттерін түсіндіре алды. Бірақ ароматты көмірсутектердің орын басу реакцияларға бейімділігін және олардың тотықтырғыштарға беріктілігін өкінішке орай түсіндіре алмады. Мұндай ерекшеліктер тек бензол молекуласының электрондық құрылысы арқылы түсіндіріледі.
Қазіргі кезде бензол молекуласының құрылысын графикалық түрде өрнектеудің тұрақты әрі нақты бір әдісі жоқ. Сондықтан молекуладағы электрондық тығыздықтың біркелкі болуын сипаттау үшін төмендегі формулалар қолданылады:
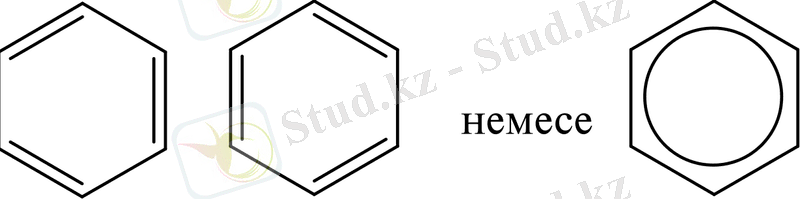
Бензолдың құрылысын анықтау үшін рефракция, рентгенограмма, электронограмма, диполь моментін анықтау т. б. әдістерді қолданылады.
Бензол молекуласындағы әрбір көміртегі атомы sp 2 - гибридтелу күйінде болады. Ол үш σ -байланысы арқылы сутегі атомымен және көршілес екі атом көміртегімен байланысып жатады. Соның нәтижесінде,
бір түзудің бойында жатқан, жазық алты бұрыш түзіледі:
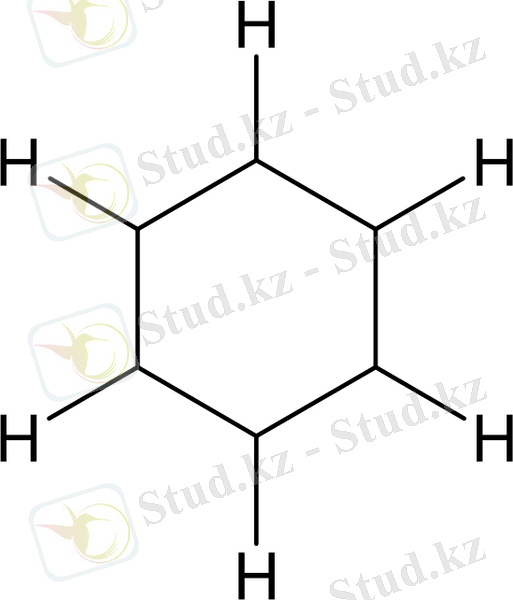
2-сурет. Бензол молекуласындағы σ - байланысының түзілуі
Гибридтелуге қатыспайтын электрондардың электрондық пішіні гантель тәрізді және бензол сақинасының жазықтығына перпендикуляр болып бағытталады. Іргелес жатқан көміртек атомдарының мұндай р -электрондық бұлттары сақина жазықтығының төменгі және жоғарғы жақтарына қаптасады. Соның нәтижесінде 6р-электрон электрондфқ бұлт құрап, барлық көміртек атомдары үшін химиялық жалпы байланыс түзеді. Электрон тығыздығының үлкен екі бөлігі σ - жазықтығының екі жағына орналасады.
Гомологтық қатар, изомерия және номенклатурасы
Ароматты көмірсутектерді рационалды номенклатура бойынша «бензол» деген атауға радикал атын қосып айтады. Ароматты көмірсутектерде екі немесе одан да көп орынбасушылар болса, олардың орналасу жағдайына қарай алуан түрлі изомерлері болады. Мысалы, екі орынбасушысы бар бензол молекуласында орынбасушылардың орналасуына қарай бірнеше түрлі изомерия түзіледі:
1) егер екі орынбасушы қасында орналасқан іргелес көміртек атомдарында орналасса, онда оны орто-изомер деп атайды;
2) егер екі орынбасушылардың арасы бір көміртек атомы арқылы бөлініп орналасса, онда оны мета-изомер деп атайды;
3) егер екі орынбасушылардың аралары екі көміртек атомдары арқылы бөлініген болса, онда ол пара-изомер болып табылады;
Молекулада үш орынбасушы болса, онда олардың да орналасу жағдайына қарай үш изомер болады:
1) егер үш орынбасушысы көршілес көміртек атомдарында болса, оны қатарлы (қ) -изомер болып табылады;
2) егер үш орынбасушының екеуі көрші көміртек атомдарында орналасып, ал үшіншісі алғашқы екеуінің біреуіне мета-жағдайда орналасса, оны ассиметриялы (ас) - изомер дейді;
3) егер үш орынбасушының үшеуі де бір-бірінен мета- жағдайда орналасса, оны симметриялы (сим ) -изомер деп атайды:
Тас көмір шайырынан алынатын кейбір көмірсутектер:
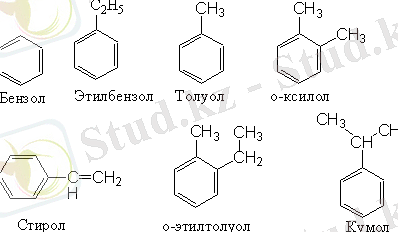
Алу әдістері:
Өндірісте : бензол және оның гомологтарын көп мөлшерде тас көмірді құрғақ айдағанда, кокс газынан, мұнайдан, тас көмір шайырынан алады.
Және де оларды алудың көптеген синтетикалық жолдары да белгілі.
1. Парафин көмірсутектерінен
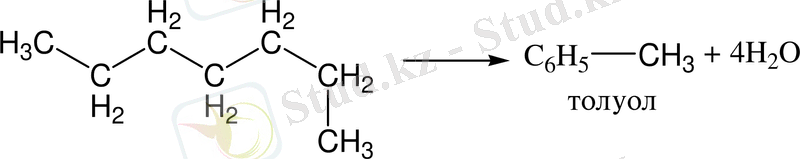
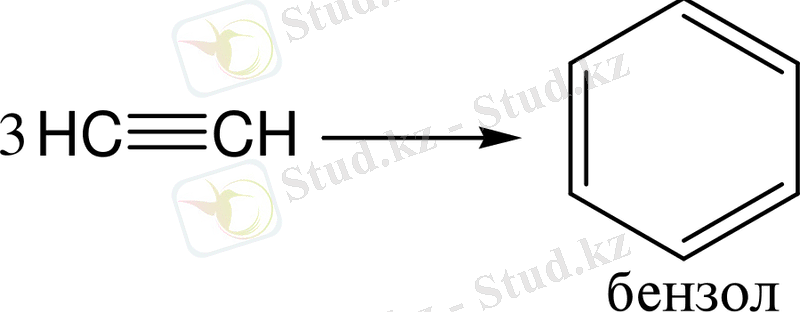
2. Ацетиленнен алу. Н. Д. Зелинский мен Б. С. Казанский тәсілі бойынша ацетиленді, өте қатты қыздырылған активтелінген көмірі бар түтік арқылы өткізіп те бензолды алуға болады:
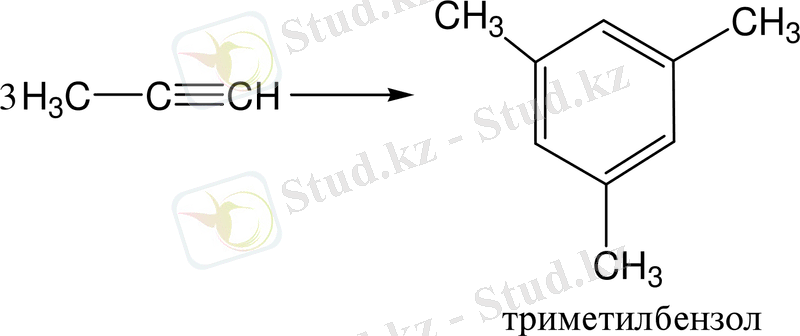
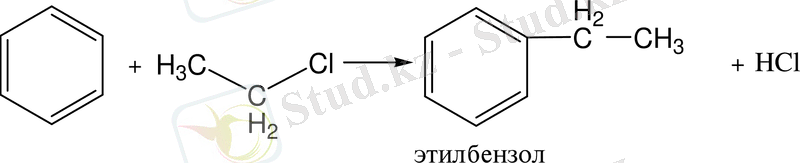
3. Фридель - Крафтс реакциясы бойынша бензол гомологтерін алу ең маңызды әрі тиімді әдістердің бірі болып табылады (1877) :
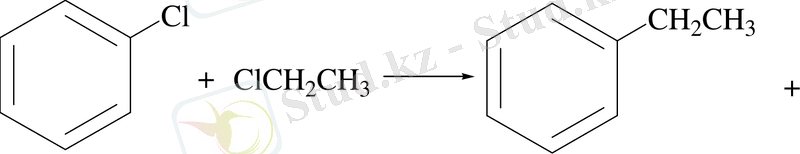
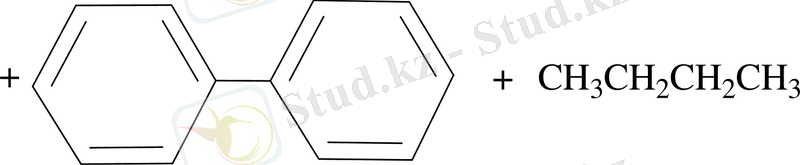
4. Вюрц-Фиттиг реакциясы бойынша. Бензол гомологтерін галоген туындылардың құрамынан осы реакция арқылы оңай әрі жеңіл алады:
5. Ароматты қышқылдың тұзынан
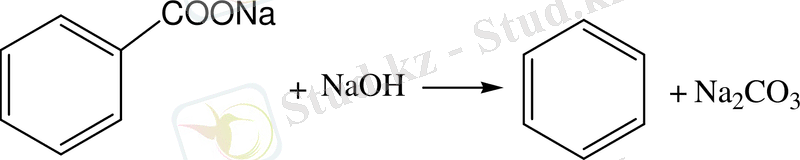
Физикалық және химиялық қасиеттері:
Ароматты көмірсутектерінің физикалық константтары
Тығыздығы,
20ºС
Бензол және оның гомологтары - түссіз сұйықтықтар болып табылды. Олардың молекулалық массасы өскен сайын қайнау температурасы да артады, орто- изомерлер, әдетте, пара- изомерлерге қарағанда жоғары температурада қайнайды. Олар суда еримейді, бірақ органикалық еріткіштерде ериді. Ал енді химиялық қасиеттеріне келетін болсақ:
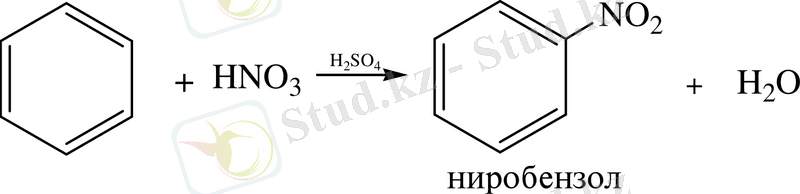
1. Нитрлеу реакциясы. Ароматты көмірсутектер азот жіне күкірт қышқылдарының қоспасымен әрекеттесіп, нитроқосылыстар береді:
2. Сульфирлеу реакциясы. Ароматы көмірсутектер концентрлі күкірт қышқылымен немесе олеуммен әрекеттесіп, ареносульфоқышқылдар түзеді:
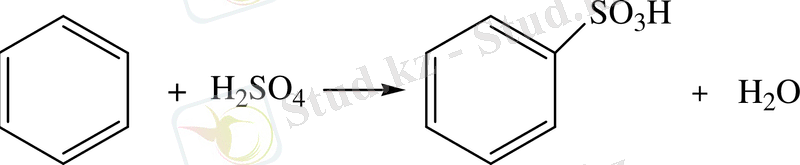
бензолсульфоқышқылы
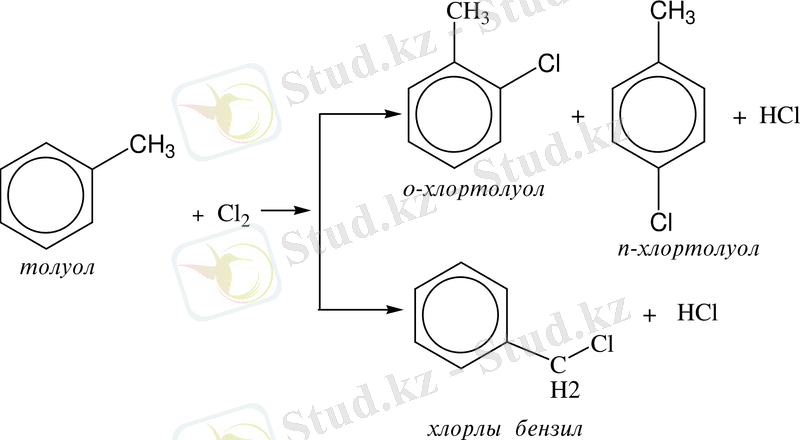
3. Хлорлау реакциясы. Ароматты көмірсутектер темір немесе алюминий галогенидтерінің қатысуында хлорлану, бромдану және иодтану реакцияларына түсіп, галогенарендер түзеді:
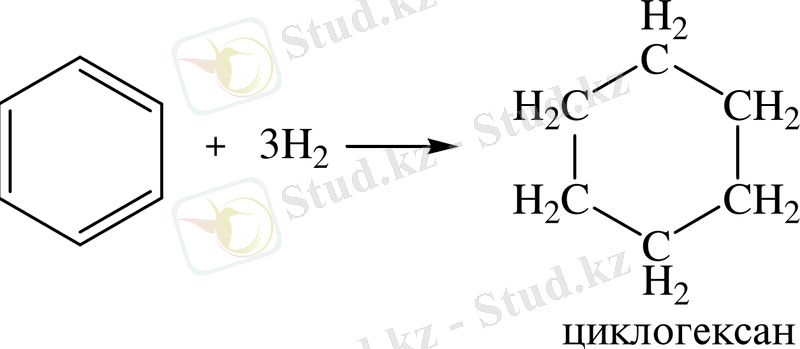
4. Гидрлеу реакциясы. Бензолға қосылу реакциясы өте қиын жүреді. Реакция жүру үшін ерекше жағдайлар туғызу керек: температура мен қысымды арттыру, катализаторларды таңдау және т. б. Мысалы, никель немесе платина катализаторлары қатысқанда бензол гидрленеді, яғни сутегіні қосып алып, циклогексан түзеді:
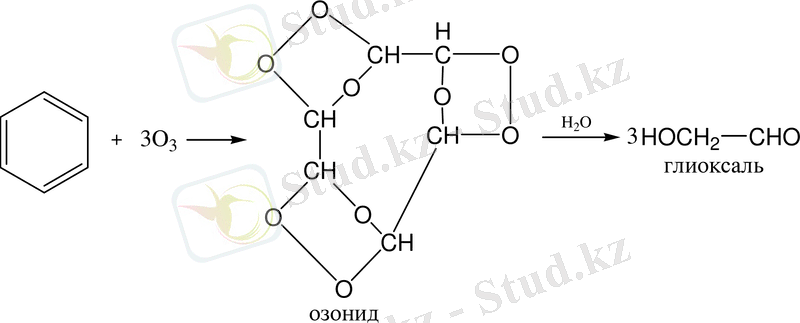
5. Озондау реакциясы. Бензол және оның гомологтері қанықпаған көмірсутектер секілді озонды қосып алып, өте қопарылғыш зат- үш озонидтер түзеді. Бұл озонидтер сумен гидролизденіп, дикарбонилді қосылыстар (глиоксаль) түзеді:
Ароматты қосылыстарды нитрлеу
Бензол ядросымен байланысқан нитротоптары бар қосылыстар ароматты
нитроқосылыстарға жатады. Ароматты қосылыстар нитротоптың санына қарай моно-, ди-, три- тағы басқа полинитроқосылыстарға жіктелінеді.
Алифатты қосылыстармен салыстырғанда ароматты қосылыстардың молекулалары π - байланыстардан құрылған тұрақты жүйе. Сол себебтен нитрлеу процесі кезінде молекула беріктігі процестің барлық сатысында сезіледі. Ароматты қосылыстар негізінен иондық механизм бойынша нитрленеді азот қышқылы немесе азот және күкірт қышқылдарының қоспасымен. Бұл қоспа «нитрлеу қоспасы» деп аталады.
Ароматты қосылыстардың нитрлеу механизмі
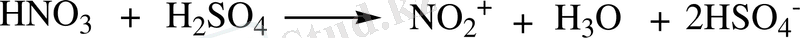
Бұл реакцияда нитрлеуші агент NO 2 + ионы болып табылады. Нитрлеу қоспасындағы (H 2 SO 4 ) күкірт қышқылының концентрациясы төмен түскен сайын нитроний ионының (NO 2 + ) концентрациясы күрт төмендейді. Соның салдарынан нитрлеу процесінің жылдамдығы төмендеп, нитрлеу процесі тоқтап қалады:
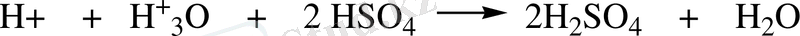
Нитрлеу процесінде түзілетін ароматты нитроқосылыстардың шығымы, изомерлерінің мөлшері, ароматты қосылыстың активтілігіне, температураға, нитрлеу реагенттің табиғатына тығыз байланысты.
Анилинді ArNH 2 күйінде нитрлегенде о- және п - нитроанилиндер, ал ArNH + 3 күйінде нитрленсе - β - изомері түзіледі.
Ароматты қосылыстардың ядросындағы орынбасарлардың көлемі үлкен боған сайын, олар о-изомерлердің түзілуіне үлкен кедергі болады және де о-орындарын дезактивтендіреді.
Нитрлеу процестің температурасы жоғарлаған сайын ядроның барлық орнының реакциялық қабілеті теңеседі. Осы кезде ароматтық нитроқосылыстарда поляризациялық және индукциялық эффекттер байқалады. Ароматтық п-нитро қосылыстарында оларды тұрақтандыратын хиногендік эффект пайда болып, хиногендік эффектің әсерінен қосылыс өте тұрақты болып келеді.
1. 2. Гетероциклды қосылыстарға жалпы сипаттама
Гетероциклды қосылыстар- сақиналы молекулалар, сақина құрамында көміртек атомнынан басқа бір немесе бірнеше гетероатомы бар органикалық қосылыстар. Қазіргі кезде периодтық жүйедегі көптеген элементтердің қатысыумен түзілетін гетероциклды қосылыстар белгілі. Олардың ішінде азот, оттегі, күкірті бар гетероциклды қосылыстар маңызды қызмет атқарады [51] .
Циклды құрайтын атомдардың санына қарай гетероциклды қосылыстар үш, төрт, бес, алты, жеті мүшелі болып бөлінеді. Олардың ішіндегі бес және алты мүшелі қосылыстары тұрақты болып келеді.
Гетероциклды қосылыстардың физикалық константтары
Бес мүшелі гетероциклды қосылыстар
Бес мүшелі гетероциклды қосылыстардың маңызды өкілдеріне тиофен
пиррол, фуран жатады:
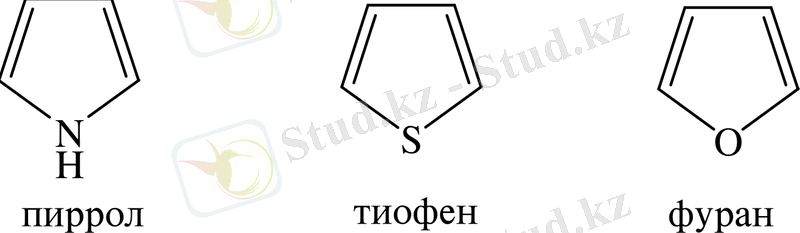
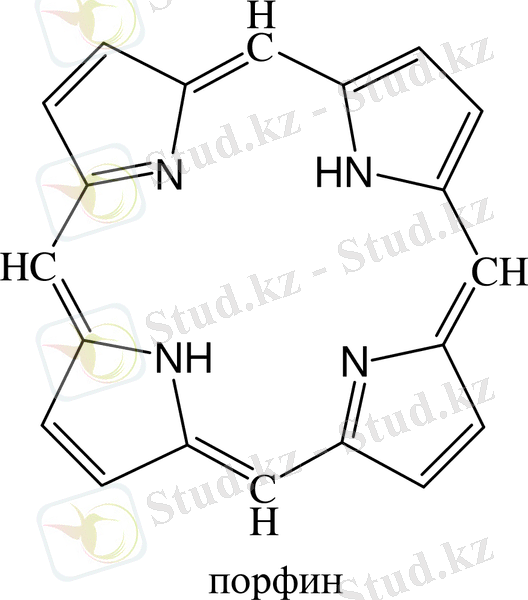
Фуран -бейтарап сипатты, ароматты қасиетке ие, қышқыл әсерінен оңай тотығатын зат. Пиррол- ароматты қасиетке ие, әлсіз негіздік қасиет танытатын гетероциклды қосылыс. Пирролдың туындылары өндірісте де, күнделікті тұрмыста да, ауыл шаруашылығында да үлкен маңызға ие заттар. Пирролдың сақинасы көптеген алколоидтардың және аминоқышқылдардың құрамында, ал алкилденген пиррол көптеген биохимиялық пигменттердің құрамында кездеседі. Мысалы, қандағы гемоглобинде, өсімдіктердегі хлорофиллінде, оттегі және В 12 - дәрумендерінің құрамында кездесетін пигмент. Сол сбепті алкилденген пиррол және пиррол ми сүйегінде кездесіп, қанның пигментін синтездеуге қатысады. Бұл пигменттердің барлығы 16- мүшелі сақина- порфин ядросынан тұратын ароматты пирролды жүйе:
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz