1-метил-3,5-дифуруфурилиден-пиперидин-4-он негізінде гидрозондар мен пиразолиндерді синтездеу және олардың құрылымы мен биологиялық белсенділігін зерттеу


ДӘЙЕКТЕМЕ
Диплом жұмысының көлемі 50 машинаға басқан кіріспеден үш бөлімнен тұрады, 87 әдебиет туындысы пайдаланылған, 9 кесте мен 4 сурет бар.
Бірінші бөлімде γ-пиперидондарының органикалық синтезі және Кляйзена-Шмидта реакциясы келтірілген, гидрозондардың құрылысы және олардың ісік ауруына қарсы активтілігі келтірілген.
Екінші бөлімде тәжірибе қорытынды талқыланып, алынған заттардың құрамы мен құрылысы, физико-химиялық және спектрлік әдістермен дәлелденген 1-метил-3, 5--4-оннің негізінде гидрозон және пиразолин қосылыстары синтезделген.
Үшінші бөлімде тәжірибе жүргізу әдісі келтірілген және пайдаланылған әдебиеттер тізімі берілген.
Қосымша материалдар ретінде синтезді жүргізу қолданылған негізгі аспаптардың үлгісі көркемделген.
АННОТАЦИЯ
Дипломная работа обьемом 50 страниц машинописного текста состоит из введения, заключения, списки использованный литературы, включающего 87 наименований, из девять таблиц и четрый рисунков.
В первой главе приведен оброз γ-пиперидона в органическом синтезе и раекции Кляйзена-Шмидта на основе пиперидона и фурфуроа, а также строение гидрозона и их противоопухолевая активность.
Во второй главе содержит обсуждение результатов собственных исследований по синтезу, химическим превращениям. Приведен синтез гидрозона и пиразолинов на основе 1-метил-3, 5--4-она и выводы.
Третья глава включает описание проведенных экспериментов, а также список использованной литературы.
В приложении приведены основные приборы, используемые при выполнении синтеза.
SUMMARY
The degree work of 50 typewritten pages consists of introduction, four chapters, conclusion, list of used literature, including 87 names, nine tables and 4 figures.
In the first chater the review about γ-piperi done in organic synthesis and reaction of Klaizen-Schmidt based on piper done and furfural as well as hydrazine structure and their antitumor activity is shown
The second chaper contains discussion of research on synthesis and chemical transformations. The synthesis of hydrazone and pyrazoline based on 1-methil-3, 5-difuryledene-piperiden-4-one is given.
The third chapter includes the description of expirements, and conclusion, and the eist of the used literature.
The basic devices in the synthesis perfor mance are listed at the end of the work.
МАЗМҰНЫ
КІРІСПЕ . . . 3
І БӨЛІМ. ӘДЕБИЕТТТІК ШОЛУ
ОРГАНИКАЛЫҚ СИНТЕЗДЕГІ ГАММА-ПИПЕРИДОНДАР
І. 1. Гамма - пиперидонді синтездеу әдістері . . . 4
І. 2. Фурфурол негізіндегі Кляйзена-Шмидт реакциясы . . . 7
1. 3. Гидрозация және гидрозондағы азот атомының
валенттік күйі . . . 12
1. 4. Молекулалық орбиталь әдісімен гидразон молекулаларының арасындағы байланыс түрлерін анықтау . . . 18
1. 5. Ісікке қарсы белсенділігі бар дәрілер . . . 21
1. 6. Өсімдіктердің өсуін реттеуші дәрілер ретінде қолданылуы . . . 26
ІІ БӨЛІМ. ЗЕРТТЕУ ӘДІСТЕРІ МЕН НӘТИЖЕЛЕРІ
ІІ. 1. Бастапқы және аралық өнімдердің синтезі . . . 29
ІІ. 2. 1-метил-3, 5-дифурфурилиден-4-онның туындыларының құрылысы мен құрамын зерттеп және синтездеу . . . 30
ІІ. 3. 1-метил-3, 5-дифурфурилиден-пиперидин-4-онның қатысында
пиразолинді, гидрозонды синтездеу . . . 36
ІІІ БӨЛІМ. ЭКСПЕРИМЕНТТІК БӨЛІМ
ІІІ. 1. 1-метил-3, 5-дифурфурилиден-пиперидин-4-нің алынуы . . . 41
ІІІ. 2. 1-метил-3, 5-дифурфурилиден-пиперидин-4-онның
туындылары . . . 43
ҚОРЫТЫНДЫ . . . 44
ПАЙДАЛАНЫЛҒАН ӘДІБИЕТТЕР ТІЗІМІ . . . 45
КІРІСПЕ
Өзектілігі: Физиологиялық белсенділігі жоғары, спектрі үлкен токсикалығы төмен, денсаулық саласында және ауыл шарушылығына қажеттілігін қанағаттандыратын, ауыл шарушылық өнімдерін қорғайтын және сапалы көп өнім алу үшін жаңа қосылыстарды синтездеу.
Негізінен азоты бар органикалық қосылыстар әртүрлі дәрілік заттарында қолданады. Ал азотты гетероциклді қосылыстардың маңызы жоғары дәрілік заттарда және ауыл шаруышылық өнімдерін бірқалыпты ұстауды қамтамасыз етеді. Мысалы, 1, 2, 5-триметил-4-фенилпиперидин-4-ол эфирі отандық өндірісте қолданады, ал жаңа түрлерін Аль-Фараби атындағы
Қазақ мемлекеттік университетінің член-корреспанденті А. Ш. Шарифкановтің бастамасымен медицинада жаңа түрлері жасауда
2, 5-диметилпиперидин - 4 -ол, азотты бензойды эфир араласқан АН РК институтында 1-н-амил - 2 -метилдекагидрохинолин-4-ол бензойда алуды; ал осы института никазан, акпинол және фосфинолды тиімді синтездеп пиперидин мен пиперидин-4-онның туындыларын алған.
Зерттеудің мақсаты мен міндеттері: Бұл жұмыстың мақсаты потенциалды биологиялық белсенді затты Кляйзен-Шмидт реакциясы бойынша фурфуролмен 4-пиперидонды конденсация негізінде азотты гетероциклді қосылыстарды синтезі болып табылады. Осы алынған жаңа қосылыстарды стереохимиялық синтезде реакциялануын қолданып ары қарай кеңейту.
α - жағдайдағы фурфурилиденді ауыстырушылар мен олардың туындыларын тұратын гамма-пиперидондының препаративті синтездеп алу әдісінде жасалынды.
Зерттеу объектісі: 1-метил-пиперидин-4-он, фурфурол .
Зерттеу пәні: Биологиялық активті заттарды органикалық заттарды синтездеу.
Жұмыстың жаңашылдығы: Пироксазалин мен гидразонды синтездеп алу арқылы ауыл шарушылығы мен денсаулық саласында әртүрлі қолданысқа ие.
Жұмыстың тәжірибелік маңыздылығы: Өсімдіктердің өсуі реттеуші дәрі ретінде және ісік ауруының алдын алуда маңызды рөл ойнайды.
І БӨЛІМ. ӘДЕБИЕТТТІК ШОЛУ
ОРГАНИКАЛЫҚ СИНТЕЗДЕГІ ГАММА-ПИПЕРИДОНДАР
І. 1. Гамма - пиперидонді синтездеу әдістері
Карбонильді қоспалардың аммиакпен конденсациясы немесе біріншілік аминдермен реакция жүргізгенде: ацетонның аммиакпен (триацетонмин алу) ; диацетонамминнің кетондармен; ацетридикарбон қышқылы эфирінің альдегидтермен, кетон немесе эфиро-кетоқышқылдар альдегидтермен немесе біріншілік аминдернің дивинилкетондар аммиакпен немесе біріншілік аминдермен; дивинилкетондар аммиакпен немесе біріншілік аминдер түзіледі [1-5] .
2-циннаоилоксираннан гамма пиперидиндерді ашу және біріншілік аминдерді алкенил-, метиламиндер алу, сонымен бірге диацетонды спирттен алынуы айтылған соңғы әдіске сәйкес келеді. Көрсетілген әдіспен бірінші гамма-пиперидон-2, 2, 6, 6-тетраметилпиперидон-4 [5-7] :
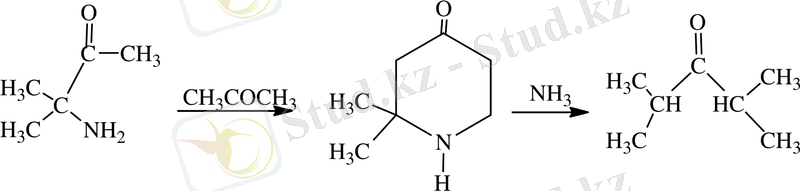
және тізбектегі әртүрлі орынбасумен көптеген гамма-пиперидондар түрінде жүргізіледі.
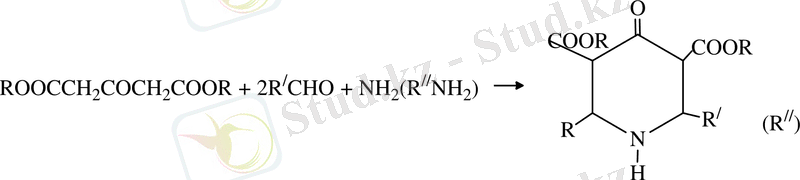
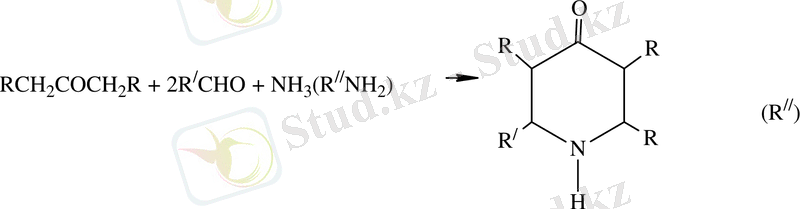
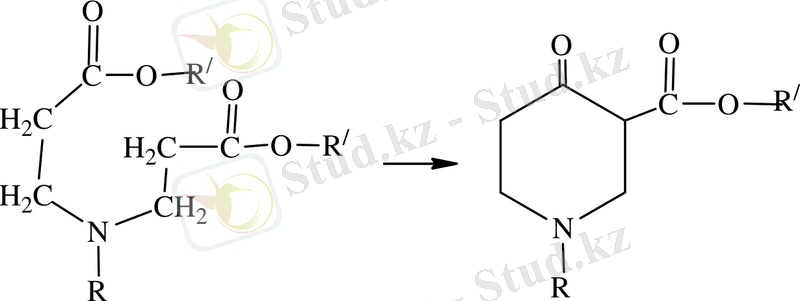
Берілген жұмыс біріншілік алифатты аминдерді акрилонитрилмен және метилакрилпен катализатор қатысында сатылап реакцияны жүргізуге болады[8, 9] . Бұл екі реакцияның өнімі β-карбометоксипропил болатын, β-карбометоксиэтил (алкил) алкагил (аминдер (ІІІ) бұлар циклдену жолымен 1-алкил-3-метил-пиперидон-4 (ІV) [10, 11] айналады, олардың негізінде жоғары белсенді аналгетиктер мен анестетиктер) айналып алынады [12, 13] .
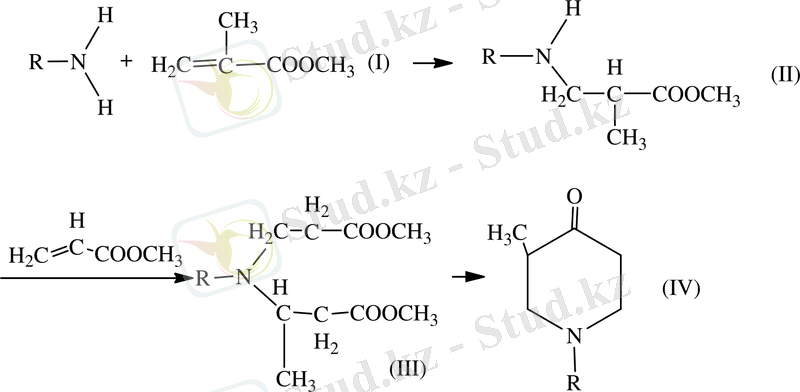
Гамма-пиперидондар химиясының дамуына үлкен еңбек сіңірген И. Н. Назаров және оның қызметкерлері еңбегі мол болған. Вининилацетиленің кетонмен конденсациясы және дегидратциялануы мұнда винилацетил спирттері дивинилацетиленнің көмірсутектеріне дейін түзіледі, одан кейінгі түзілген дивинилкетондардың гидратациясы жай және қол жетімді әдістермен синтез жолы пайдаланылған.
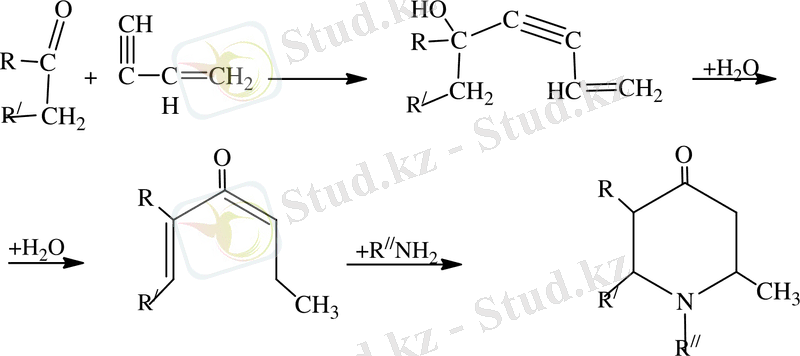
Назаровтың жұмысына дейін дивинилкетондардан тек форон және дибензальацетон гамма-пиперидондардың синтезі пайдаланылған. Назарованың әдісі арқылы гамма-пиперидон алу жолын біршама жеңілдетті. Сол себептен бұл әдісті өндіріс орындарында алады(1, 2, 5 -триметилпиперидон -4) [14] .
- Фурфурол негізіндегі Кляйзена-Шмидт реакциясы
Карбонилді топтағы альдегидтер мен кетондардың молекулалары реакцияға жоғарғы сатыда жүреді. Көміртегіге қарағанда оттектегінің электртерістілігі жоғары болғандықтан оттегі атомының электронды тығыздығы көміртегі атомына қарағанда төмен, яғни карбонилдің қос байланысы поляризацияланғанда дипол момент 2. 7- дей болады. Карбонилдегі көміртек электрофильді қасиетке ие болғандықтан ол электрофильді реагентерге әсер етеді. Карбонилді топ молекулалары электронды тығыздықтың ығысуын тудырады. Осыған байланысты карбонилдің әсері кабонил тобындағы атомдарымен еріксіз әсерлескенінен (α - жағдайды) . Көмірсутек тізбегінің бұзылуына әкеп соқтырады. Содан циклды кетонның реакцияласуын жоғарлатады. Кетондардың конденсациясында байланыстың болуы белсенді метил тобының болуы Квенагеля реакция деп атайды [15] . Бұл реакициялар белгілі Перкин реакциясының модификациясы болып табылады және де осыған ұқсас механизімдерге ие. Осыған негізделе метил тобындағы протондары үгітіледі, ал түзілген карбонион альдегидтің карбонил тобымен төмендегі схема бойынша әрекеттеседі:
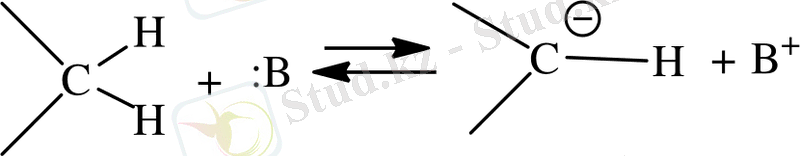
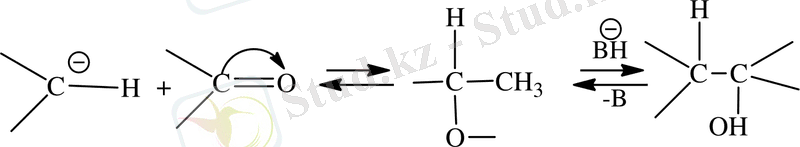
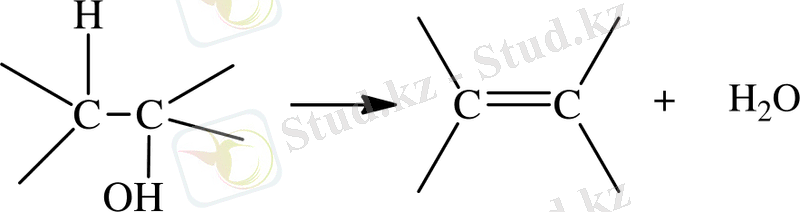
Ароматты альдегидті реакция конденсациясы көп жағдайда алифатты альдегид кетондар реакцияларына сәйкес келеді. Катализатордың негізгі өнімі қолданған жағдайда алифатты альдегидтен альдолді тип конденсация өнімін бөліп алу мүмкіншілігі бар, егерде ароматты альдегидді α, β-жағдайдағы карбонил қосылысында дегидратция жүреді. Дегидратция негізінде катализдену енолат-анион арқылы жүреді.
Альдольды конденсация соңына дейін жүріп дегидратацияға ұшырайды, бұл процесс ароматты α, β-жағдайдағы карбонилді қосылыстар синтездеуде қолданылады және Кляйзена-Шмидта реакциясы түрінде белгілі [16] .
Осыған ароматтың шеңберіндегі альдегид электронноакцепторлі топтарға оң әсерін тигізеді.
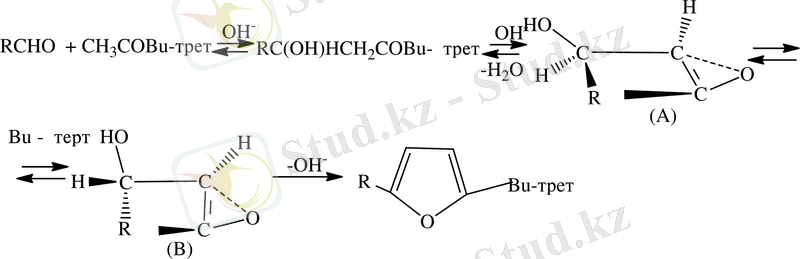
α, β - жағдайдағы альдегидтер немесе кетондар карбонилді топтарға ие β-көміртегі атомындағы орынбасуды транстық орналасуда қамтамасыз етеді. Стереоселективтілік конформациядағы (В) енолят дегидратация жағдайында анықтайды, енолят-анионы және β-орынбасуы мен шектелген жағдайда стериялық әрекеттеседі [17] . Фурфуролдың конденсациялық реакциясы әртүрлі фурилді қосылысы бар қосылыстарды синтездеуге толық мүмкіндігі арқылы болады. Фурфуролдың химиялық барлық гомологтары және ядро туындысында орналасуы фуран-3-альдегидіне байланысты.
Фурфуролдың құрылысына байланысты альдегид тобы мен фуронның ядросы химиялық қасиеттері бойынша ұқсас болады. Карбонил тобының болуы фуронның цикліне әсері зор.
Ароматты ядрода фурфурол реакциясын жүруі анық көрінеді, осы байланыс фурфурол ядросымен қос байланысқандардың оттегі атомының реакцияға түсу қабілеттілігін төмендетеді. Альдегид секілді фурфурол осы класқа сәйкес реакцияға тән қасиетке ие және бензойальдегидке және де басқа да ароматты альдегидтертердің ұқсастығы көп. Сутегі атомы жоқ α-атомды көміртегі альдегидтері тиісті спирттерге және спирттік ерітіндісі бар негіздермен және карбон қышқылымен әсерлеседі.
2R - CHO R - COO - + R - CH 2 OH
Бұл реакцияға ароматты және гетероцикл қатарындағы альдегидтер осы реакцияға түседі.
Альдегид тобы фурфурол 3-іншілік көміртек атомымен байланысты, фурфуролдың реакцияға түсу қабілеті альдегидтерге тән.
Фуронның конденсация әсерінен белсенді метил тобы бар 2, 5-диальдегидті қосылыстары жайлы Г. Ф. Терещенко, Г. Н. Колдобский, Л. И. Батилом [18] өз еңбектерінде айтқан. Альдегитер мен кетондар кротондық типте конденсация процесі жүреді, мысалы, ацетоальдегид (5) және циклогексан (6) .
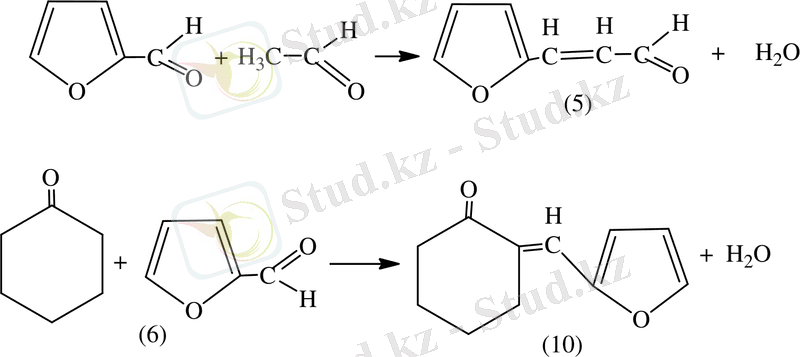
Әсерінен изомайальдегиді альдольді тығыздалған өнімдер түзеді. Мұнда конденсацияланатын сулы сілтілер мен аминдердің орыны көбірек болады. Белгілі әртүрлі синтездің әсерінде фурфурол мен кетондар кротондық конденсациялануы арқылы алады [19, 20] .
Фурфуролды кетонның артық мөлшерінің қатысында алғаш рет Костанецкий мен Подрайский алған. Дикетонды конденсация қатысында алғанда 2 молекулалы циклогександы (7) түзіледі. (8) фуролды түзіліп, содан кейін трициклді кетон түзіледі (9) [21] .
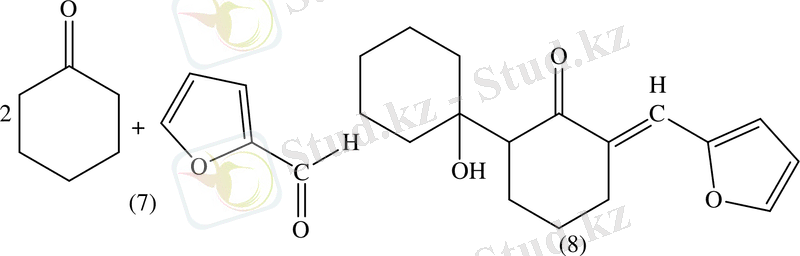
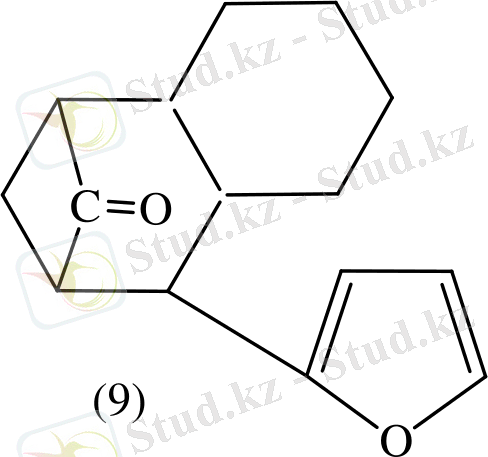
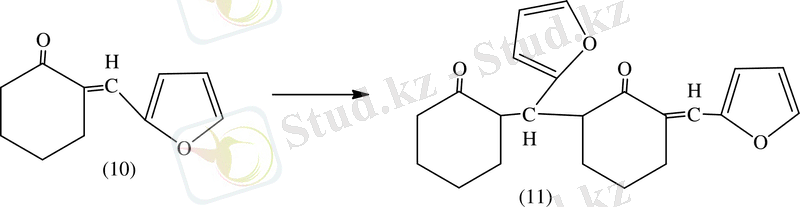
Ал екі молекуладан (10) түзеледі.
Осы тип бойынша алынады (11) .
Тәжірибеде циклогексан ароматты альдегидтермен конденсацияланғанда альдольді-кротонды тығыздалған өнім шығады. Гетероциклді қосылыстары құрамында белсенді метил топтарынан түратын оның ішінде α-пиколиметилодиді бар бұл қосылыстардан фурфуролмен конденсациялану арқылы алады.
А. А. Пономарев пен оның қызметкерлері [19, 20] көрсеткендей, фуранда конденсациялану нәтижесінде ди-, три- және поли- еноді кетондар спиртті ортаның әсерінен (10 % күйдіргіш натр) шығымсыз өнім алды.
Жұмыстардың [23] нәтижесінде фурфуролдың цилогексан мен конденсациялану арқылы алынатын өнім метилциклогександар және басқа алициклді кетондар болып саналады.
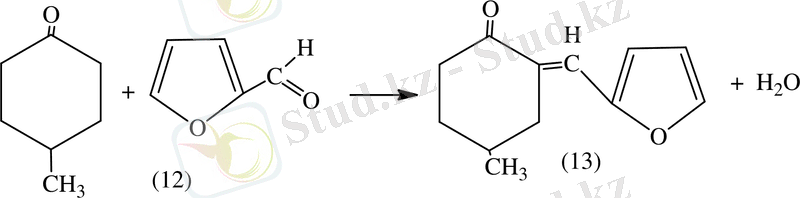
Осыдан қатысты конденсациялану қазіргі уақытта синтездеу арқылы фуранның альдегидпен кетондар қанықпаған алуға болады.
Осы конденсация әсерінен жай ғана жақсы өнім алынады.
Сондықтан конденсациялануда кең түрде қолданысқа ие зат мыналар: күйдіргіш натр, күйдіргіш калий және сол сияқтылар, көбіне полиенді альдегидтерді синтездегенде, пиперидин және алифатты аминдер [21, 22, 23]
1. 3. Гидрозация және гидрозондағы азот атомының валенттік күйі
Гидразондардың өзіне тән физикалық химиялық қасиеттерін молекуладағы 2 химиялық байланысы арқылы анықталады; бірақ қос азотта азот атомдарының әртүрлі құрылымы және 2 байланысты сутегі тән.
Қалыпты жағдайда азот атомның (1s 2 2s 2 2p 3 ) ішкі қабатында 2 электрон және сыртқы қабатында 5 электрон ба. Осы элементті 2 периодтағы элементтер сияқты 4 атом орбиталдері химиялық байланыс түзуіне, кезінде қатысады. Бірақта 3 электроны жұптаспауы себептен төртінші орбиталь 2 электроны жұптасақан спин түрінде болады. Егер сутектің 4 валентті орбитальі жұптаспаған электрон түрінде болса онда олқалыпты жағдайда 4 координациялық қосылыс түзеді. Яғни азоттың 4 координаталық қосылысы түзілуі үшін оң зарядты реагенттер әрекеттесуі керек, содан катион түзіледі [24] .
Азот атомдарын анықтау кезінде (бірнеше жолдары) анықталмаған қос электронда жұптасуға қатысып ол кулондық немесе кеңістіктікте қиындық туғызады, спектрлік арқылы жүреді іс-жүзінде практикада айтылған. Бірақта бұл қазіргі заманғы әдістер ашылған және ашылмаған заттардың есептеуге мүмкіндік бермейді.
Льюсиялық кесте де электрондық қосылулар барынша қайта көп жабу принципінде, гидрозатциялану туралы және валентті күй жағдайын түсіну, формальді суреттеуде және валентті бұрыштардың органикалық қосылыстардың тәуелділігінен гидрозондардың түзілуінен толықтай мәліметтен қарағанда теорияға жуықтайды. π-электронға қарағанда δ-оствалық молекулалары екі орталық орбиталдарды жұптасу күштерінің өсуінен тең гидридтелген орбиталь түзіледі. Осы әдістерді негізге ала отырып азот атомының валенттік күй жағдайын түсіндіріп және азоттың гидразондағы валенттік күйін ашып көрсетейік.
Бөлшектелген атомның валентті күй-жағдайдағы орында бола алмайды. Ван Флектің валенттік күйдегі атом молекуласын анықтамасымен [25, 26] валенттік күй-жағдайы молекуладағы атом бос атом негізгі күй жағдайынан стационарлық қоздырылған күй-жағдайларына қарағанда қайсысының энегриясы атомдық спектрлердің зерттеу энегиясын негізгінде айқындалады деген.
Электронды атомның құрылысы негізгінде атомдар құрылысынан айырмашылығы бар. Бірақта валентті күй жағдайы - бос атомның стационарлы күй жағдайда оның орташа күйін алып, оны молекуланың атомымен қосылысықандайқылып қосылады[25] . Валентті күй жағдайын түсіндіру үшін гидридтелген орбиталь ұғымын қолдану қолайлы[24] . Әрбір гибридтелген орбиталь сияқты валенттік күйідегі түзілген атомдық орбиальдер 2s және 2р комбинациялы түзі сызық түзеді. Sp 2 - гибридтік күй кезіндегі қиысулардан 3 эквиваленттік валентті орбиальдар (тап осы гибридтен тригональды деп атаса, орбиальді tr символымен белгіледі) және р-орбиаль гибридті емесі бар. Sp 2 - гибридтелуін түсіндіру үшін атомдық базисті қарастырамыз:
Sp 3 - гибридтік 4 валентті орбиальдері өзара 109°28 / валенттік бұрышты түзіп, атомның өзгеруінен мынадай базиске өзгереді.
NH 3 аммиак күйдегі атомның гибридтенуін қарастырып көрейік. Эксперименттік есеп бойынша НNH - тің бұрышы 106°48 / шамада және сутектің барлық атомдары эквиваленттік көрсетеді [24] . Сутегі атомдары эквиваленттік екені ортаңғы байланыстардың әрбір байланысы N-H азот гибридтік орбитасымен және сутегі атомы 1 s - орбитасымен қосылғанда керек. Үш эквивалентті орбиталь түзу үшін 106 о 48 / көрсеткен бұрыштарды өзгерту үшін мынадай атомды базиске өзгертеміз.
t 1 = 0. 474s + 0. 1816 p x - 0. 303 p z
t 2 = 0. 474s + 0. 408 p x +0. 707 p y - 0. 303 p z
t 2 = 0. 474s + 0. 408 p x +0. 707 p y - 0. 303 p z
t 4 = 0. 572s - 0. 820 p z
Эквиалентті t 1 , t 2 , t 3 валентті орбитальдары 3 сутек атомымен байланысса, ал t 4 валентті орбиалі бөлінбейтін жұп түзеді. Бөлінбейтін жұп sp 3 - гибридіне қарағанда s -ға ұқсас келеді. Валенттік бұрыштарды аралықтарындағы байланыстарды бейорганикалық гибридтертену жағдайымен түсіндіруге болады. Бірақта диогональді (sр), тригональді (sр 2 ) ; тетрагонольді (sр 3 ) гибридтену басқа гибридтік жағдайға қарағанда қолайлылығы аз.
Кесте № 1
Н, С, N атомдарының валенттік күйінің
потенциялық ионизация І m , электронға жақындық Е m , электртерістілік Х m және жұтылу энергиясы Р m
Н
С
N
s
sррр
dі dіππ
trtrtrπ
tеtеtеtе
s 2 ррр
sр 2 рр
dі 2 dіππ
dі dіπ 2 π
tr 2 trtrπ
trtrtrπ 2
tе 2 tеtеtе
S
s
р
σ
π
σ
π
σ
р
s
р
σ
π
σ
π
σ
π
σ
σ
13, 60
21, 01
11, 27
17, 42
11, 19
15, 62
11, 16
14, 61
13, 94
26, 92
14, 42
23, 91
14, 18
22, 10
14, 11
20, 60
14, 12
19, 72
18, 93
0, 75
8, 91
0, 34
3, 34
0, 10
1, 95
0, 03
1, 34
0, 84
14, 05
2, 54
7, 45
1, 66
6, 84
2, 14
5, 14
1, 78
4, 92
4, 15
2, 21
4, 84
1, 75
3, 29
1, 69
2, 75
1, 68
2, 48
2, 28
6, 70
2, 65
5, 07
2, 46
4, 67
2, 53
4, 13
2, 47
3, 94
3, 68
8, 479
7, 193
6, 764
6, 549
1, 082
14, 292
7, 687
12, 867
9, 255
12, 392
9, 920
Әдеттегі атомдық орбиталар χ m белгілейді, ал гибридттік - арқылы t μ сол уақытта атомдық негіздің өзгертуі сондай будандық болады:
Qμ m - өзгерген түрі матрицада қолданады.
Егер көміртек оқталмаған атомына арналған гибридтері әрбір күй-жағдайында теңдеу валентті күй-жағайы талапқа сай болса онда азот атомында валентті күй-жағдайлар бірнеше гибридтенуі әдеттегідей болады. Олар валенттік орбитальдары теңдеумен өзара өзгешелеу болады, тек бөлінбейтін жұп сияқты қарастырамыз. Хинза және Джаффердің жұмыстарында жүйелі есептеулердің нәтижесінде атомдардың әртүрлі валенттік күйін қарастырған [25] . Автор ионданудың потенциялуын І m , электронға ұқсастығын Е m , валенттік орбиталінің электртерістілігін Х m (әртүрлі шкалада), ең алдымен түзілу жайылу энергиясын Р m валенттік күй жағдайға сай етіп есептелген.
Ионданудың потенциялын және электронды ұқсастықтарды атомдарыдың екі бөлек энергиясы ретінде қарастырылған, мысалы, азоттың конференциясы және N + немесе N - иондарды конференциясы сияқты. Осымен ионданудың потенциялы валенттік күйдегі N(1s 2 , tr tr tr 2 π) азот орбиталі теңестіріледі.
І (σ) =Е N (1s 2 , tr tr tr 2 π) - Е N+ (1s 2 , tr tr tr 2 π)
І (σ) =Е N (1s 2 , tr tr tr 2 π) - Е N- (1s 2 , tr tr tr 2 π)
1 кестедегі І m , Е m , Х m, Р m өлшемдері Милликеннің формуласында Полинг шкаласында Н, С және N атомдары үшін есептелген:
Азот атомының валенттік күй-жағдайын қарастырғанда гидразонтық топтардың теория бойынша жоғарғы дәрежелі валенттік күйін қолданады.
Азот атомының sp 2 -гибридтік электрондық конфигурациясы N 2 (tr 2 , tr, tr π) болады . Толық емес азот атомының жұптары тригонольді орбиатльдері р-орбитальдарды дұрыс емес түрі мынадай күйді көрсетеді:
Аминді азот атомның валентті күй-жағдайы оның σ-байланысы жалпақ немесе пирамида тәрізді орналасуы туралы жорамалдап анықтауға болады. Аминнің азот атомдары атаулы сияқты sp 2 -гибридтік күйде болса, ал электрондардың конфигурациясы N 1 ( tr tr tr π 2 ) болады. Содан бөлінбейтін жұп 2р-орбиталінде орналасады және көміртек пен азоттың екі еселі байланыс түзуіне қатысады, бөлінбейтін жұптан sp 3 -гибридтік орбиталін түзеді.
sp 2 және sp 3 -гибридтердің шарасыз кездерінен басқа аминнің азот атомдары өтпелі гибридтенеді:N 2 (t; t 2 ; t 3 ; t 4 2 ), сонымен σ-байланыс t 1 , t 2 , t 3 - тері эквивалент және эквивалентті емес валенттік орбиаль көрсетуі мүмкін. Сонымен қоса бөлінбейтін жұптардың екі еселі байланысы көміртек пен азотты айыруға жұмсалған потенциялық мүмкіндіктері және осы байланыстардың жұтылу энергиясы валенттік орбитадік байнысын түзуге жұмсайды.
Кесте №2
Азот атомына әртүрлі валенттік күйіне байланыстың мінездеме
dі dіππ
tr 2 trtrπ
tе 2 tеtеtе
trtrtrπ 2
dі dі π π 2
7, 687
9, 255
9, 980
12, 392
12, 867
tе 2 tеtеtе
trtrtrπ 2
tr 2 trtrπ
dі dіπ π 2
dі 2 dі ππ
3, 68
3, 94
4, 13
4, 63
5, 05
18, 93
19, 72
20, 60
22, 10
23, 91
№1 кестені қолдана отырып азот атомының валенттік күйінің энергиясының өсуіне байланысты орналастырамыз. Кесте №2 бойынша N (tr 2 tr tr π) және N 1 (tе 2 tе tе tе) валенттік күйінің энергиясын жұтылуы өзара жақын, сонда амминдегі азот атомдары N( tr tr tr π 2 ) тригональді гибридтенуіне көп мөлшерде энергия жұмсалады. Аминнің азот атомдарының электрондық құрылысын қарастырғанда sр 3 - гибридіне қарағанда sр 2 - гибридтенуде түзілген энегрия көп мөлшерде екенін есте шығармауымыз керек. N( tr tr tr π 2 ) валенттік күйдің соңғысы энергиясының жұтылуын компенсатциялайды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz