Масса тасымалдаудың теориясы және газдардағы тасымалдау құбылыстары


Мазмұны
Кіріспеcі 3
1 Тасымалдау жайындағы жалпы түсініктер мен мағлұматтар4
1. 1 Жалпы тасымалдау құбылыстары жайында 9
1. 2 Диффузия 14
2 Массатасымалдауды зерттеу әдістері16
2. 1 Газдардағы массатасымалдау 18
2. 2 Тасымалдау коэффициенттерінің арасындағы қатынастар- 20
Кіріспе
Массатасымалдау
Массаалмасу дегеніміз ол бір немесе бірнеше фаза аймағында кері айналмайтын тасымал масса компонентінің араласуы.
Хаостық қозғалыс молекуласының (мол. диффузия), макроскопиялық қозғалыс барлық ортада жүзеге асуының нәтижесінде, ал турбуленттік бөлімінде - хаостық қозғалыс құйынды түрінде сонымен қатар әртүрлі көлемге ие. Массаалмасу, массаберу (тасымал шекарадан терең фаза аймағына дейін) және массатасымалдау (ауыстыру бір фазадан келесі фазаға фаза аймағы арқылы өту) кірістіріледі. Эквимолярлы массаалмасу айырмашылығын (мысалы ректификация) қандай да бір аймағы арқылы фазаға қарама-қарсы бағыттағы бірдей сандағы компоненттерді және эквимолярлы емес (мысалы абсорбция) . Массаалмасу негізгі әртүрлі процестер бөлімі және қалдық, бір класқа біріктірілу массаалмасу процесіне жатады. Мн. жылу алмасу: конденсация, булану, буландыру, балқу секілді құбылыстарды, сонымен қатар гидромехфиотация газдарды тазарту, араластыру - алып жүру массаалмасуға жатады.
Химиялық процесті жүргізу алдында массаауысу судағы жылдамдықты (су астында) в-в аймағының реакциясын және меншікті реакция өнімін анықтайды. Массаауысу кезінде көбіне екі немесе одан да көп фаза қатысады, қысқа концентрацияда тепе-теңдік күйден айрылады. Екі фазаның бір-біріне әсері сәйкес екінші бастаумен термодинамиканың олардың күйі өзгереді, бір қалыпты бағытқа қарап қысқа сипатталатын термодинамикалық теңелу және фазалық қысыммен, сонымен қатар химиялық потенциалдармен әрбір компонентте пайда болады. Ауысу компоненті азаю(кему) бағытында оның хим. потенциалында өтеді. Массаауысу сондай-ақ электрлік градиент потенциалы арқылы да іске асады (электровозда электрохимиялық процесте) теориялық (мысалы, термодиффузиялық бағанада изотопты болуы үшін) және т. б.
Бірақ, практикада қозғалыстағы күш - массаауысу қарапайым концентрация градиенті арқылы іске асады, не айтарлықтай жеңілдетеді, байланысты жылдамдық процесі мен технологиялық құрама бөлімі арасында. Қатарды қолдануға болады, концентрацияның қозғаушы күшін теориялық дәлелдеуге мүмкін.
Кез-келген массаауысудың анализ процесі есепке алу шарты тіршілігі берілген фаза саны және компоненттердің оларды үлестірілу заңы анықталмалы фаза ережесімен және тепе-теңдік заңымен түсіну үшін қажет. Термодинамикалық теорияда фазаның тепе-теңдігі өте жақсы жасалған, сонда да практикалық есептеуге қашанда ол мүмкін, эксперименталды мәліметті қатарда үмітпен пайдалануға болады, өткізілген түсініктеме әдебиетінде. Ұлғаю шартын массаауысу процесінде әр түрлі етіп шығару. Сонымен дистиляциядан алдын тікелей ұлғаю табылады, қаныққан бу және қайнаған сұйықтық.
Абсорбциялы процесте газды немесе сұйық қоспа бөлінеді, нәтижесінде тәуірлеу сорбциядан компоненттердің біреуінен қатты абсорбентке дейін. Қатаюды кристалдандыратын қатты фаза жолымен болу, бөліп алу үшін керекті компонентке араластыру. Мембранда процесі болуының негізгі мүмкіндігіне кейбір жіңішке ұлпаға немесе қарапайым түрге өткізу бір байланысты және басқаларын ұстап тұру болады. «Сушки» операциясы сұйықтықтың тасымалдануына, ішкі қатты денеге және будың келтіру заңына бағынады. Бұл процестің барлығы, сонымен қатар иондық алмасу, сублимация т. б біріктіріледі, жалпы кинетикалық заңдармен, массатасымалы фазааралық жылдамдықпен анықталады. Соңғысы қозғалмайтын ортадағы молекулалардың жылдамдығына, конвективті диффузия жылдамдығына - қозғалатын ортада, сонымен қатар физикалық шарттың фазалық айиағына тәуелді.
Конвективті диффузия
Тасымалдау в - а қозғаушы ортада екі әртүрлі механизмдермен қамтамасыз етілген. Өзіндік ерекшелігі, сұйықтағы концентрацияда диффузиялық молекулаларды тартады, одан басқа жиілік в - а сұйықтықтағы ерігіштік ұлғаяды, соңғысы оның қозғалысымен және онымен бірге ауысады. Екеуінің жиынтық процестерін конвективті диффузия деп аталады.
Математикалық сипаттама үшін конвективті диффузия ламинарлық бөлімде сығылмайтын сұйықтық мына түрде болады.
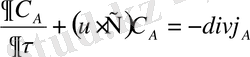 (1)
(1)
мұндағы С А - А компонентінің диффундық концентрациясы в моль/м 3
 Equation. 3 -
уақыт в, с
Equation. 3 -
уақыт в, с
 - макроскопиялық ағыстың векторлық жылдамдығы
- макроскопиялық ағыстың векторлық жылдамдығы
 - набла (Гамильтон операторы)
- набла (Гамильтон операторы)
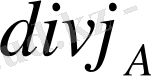 - дивергенция
- дивергенция
 - дифференциалдық ағынның векторлық тығыздығы.
- дифференциалдық ағынның векторлық тығыздығы.
 мөлшері келесі теңдеу бойынша анықталады.
мөлшері келесі теңдеу бойынша анықталады.
 =D
AB
grad C
A
, (2)
=D
AB
grad C
A
, (2)
Мұндағы D AB А компонентінің молекула диффузиялық коэффиценті. в м 2 /с
grad C A - концентрация градиенті.
Турбулентті ағын жағдайында (1) теңдеуге C
A
, және
 және
және
 көлемі уақыт бойынша орташа мәнге ауысады, ол оң жақ теңдеуін толықтырады. Дивергенция тығыздығы арқылы турбулентті ағын таралады. А компонентінің (турбулентті дифференциалды қара) . Енді турбулентті және молекулалы диффузияны тәуелсіз қабылдауға болады, онда ол
көлемі уақыт бойынша орташа мәнге ауысады, ол оң жақ теңдеуін толықтырады. Дивергенция тығыздығы арқылы турбулентті ағын таралады. А компонентінің (турбулентті дифференциалды қара) . Енді турбулентті және молекулалы диффузияны тәуелсіз қабылдауға болады, онда ол
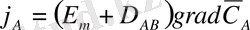 (3)
(3)
Мұндағы
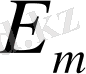 - турбулентті дифференциалды коэффиценті. В м
2
/c
- турбулентті дифференциалды коэффиценті. В м
2
/c
Теңдеудің шешімі конвективті диффузиядан басқа бастапқы және шектеулі шартта С А үшін жылдамдық ағынын білуді талап етеді. Соңғы талап шындыққа жақын, сирек орындалатын және сол үшін қиын шешімдер теңдігіне (1) тек қарапйым кезде алынады.
Химиялық реакция кезінде жүйенің оң жағындағы теңдік (1) мүшелерімен толықтырылуы қажет, шығынмен сипатталатны компонент реакцияға бірлік көлемінде бірлік уақытқа тең. Химиялық айналудың әсері және олардың байланыс процестерінен массатасымалдау гетерогетті жүйеде қаты фаза мен байланысты - макрокинетика. Массаалмасу күрделі химиялық реакциямен газ сұйықтықты жүйеде қараймыз - абсорбция.
Массаберу коэффиценті
Көп жағдайда массаберу, әсіресе турбулентті ағынды немесе одан да тез құлайтын градиентті концентрациясы орташа фаза бөлімі шекарасына жіңішке қабатпен негізделеді. Осыны ескере отырып тасымалдау процестерінің шығынын алып жүруге ыңғайлы болуы үшін, в - ва берілген фаза бойынша шекараФдан терең ағын бөліміне дейін (ядро ағынында) немесе ядро ағынынан фазааралыққа коэффицент массаберудің түрінде қатынасы диффузиялық ағынның тығыздығы сипаттамалық айырмашылығы концентрацияның.
Онда
 , (4)
, (4)
Мұндағы
 - фаза ағынының аймағында тепе-теңдік концентрациясы.
- фаза ағынының аймағында тепе-теңдік концентрациясы.
(4) ке қатысты массаберудің физикалық коэффиценті анықталады және математикалық түсіндірілуі эксперимендатьды тұрақтандырылған факт, оны кейде Щукарев заңы деп атайды.
Қозғаушы күш (4) теңдеуде массаберу әр түрлі бірлікте көрсетілген фаза құрамының сипаттамасын қолдану үшін сәйкес көлемділігімен ауысады.
Келесі теңдеу қатынасын қорытайық.
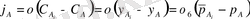 (5)
(5)
Мұндағы
 - моль/(м
2
/с) өлшемін алады.
- моль/(м
2
/с) өлшемін алады.
С
А
және С
Аі
- моль/м
3,
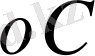 - м/с.
- м/с.
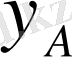 және
және
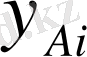 - молярлық үлесі А компонентттерінің қатынасы ядро ағынына және фаза бөлімінің шекарасына.
- молярлық үлесі А компонентттерінің қатынасы ядро ағынына және фаза бөлімінің шекарасына.
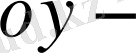 моль/(м
2
/с)
моль/(м
2
/с)
 және
және
 - парциалды қысым. А компонентінің газдың фазада ядро ағынына қатысты және фаза бөлімінің шекарасына.
- парциалды қысым. А компонентінің газдың фазада ядро ағынына қатысты және фаза бөлімінің шекарасына.
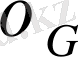 - моль/(м
2
/сПа) .
- моль/(м
2
/сПа) .
Мұны біле отырып фаза құрамының әр түрлі әдіспен түрлену арасында қатынасы, массаберудің коэффицент мағынасын қайта санап шығу қиын емес.
Кез-келген жүйеде бірлік сандар жиынтығының теориялық тәуелділігі, сондай-ақ экспериментальды, берілген фазада массаберу жылдамдығы үшін көбін жазып алады.
ГАЗДАРДАҒЫ ТАСЫМАЛДАУ ҚҮБЫЛЫСТАРЫ
Молекулалардың озара соқтыгысуларының газдарда жүретін процестердегі маңызы зор. Мысалы, газдың тепе-тең күйге ауысуы, оның молекулаларының жылдамдықтарының әртүрлі болуы осы соқтығысулардың нөтижесі. Тәжірибе-лермен дөлелденген, молекулалы-кинетикалық теорияның негізгі теңдеуінен, газ молекулаларының жылдамдыктары жоғары болатыны байкалады. Мысалы, бөлме температурасында азот молекулалары шамамен 500 м/с, ал сутек молекулалары 2000м/с жылдамдықтармен қозғалатыны анықталған. Бұл газдағы көптеген процестердің баяу жүретініне және басқа да белгілі фактілерге қайшы нәтиже.
1. Тепе-тең күйде газдың температурасы, оның өн бойында бірдей, бұл газды құрайтын бөлшектердің орташа кинетикалық энергиясы бірдей деген сөз. Егер газдың бір жағы қыздырылса, ондағы тепе-тең күй бұзылады, ал қыздыруды тоқтатса газ тепе-тең күйге қайта оралады. Бұл құбылыс, газды құрайтын молекулалардың үздіксіз жылулық қозғалысынан және олардың өзара соқтығысуларының салдарынан деп түсіндіріледі. Осыдан, тікелей араласу мен конвекциялық жылу алмасу болмаған жағдайдағы, газдың қызған бөлігінен салқын бөлігіне энергия ауысу процесі жылу өткізгіштік құ былысы деп аталады. Молекулалардың жылдамдықтарының жоғары болуына қарамастан газдарда жылу өткізгіштік құбылысы баяу жүреді.
2. Белгілі бір көлемдегі газға, температурасы сондай, бірақ концентрациясы одан бөлектеу екінші бір газ аралассын делік. Тәжірибелер, қосылған газдың барлық келемге түгел тараайтынын және біртекті қоспа түзілетінін көрсетеді. Бұл құбылыс, яғни, макроскопиялық ауысулар жоқ кездегі, газ молекулаларының біріне-бірі ену процесі, диффузия деп аталады. Диффузияда масса тасымалданады. Газ молекулаларының жылдамдығына сәйкес бұл процесте тез жүруі тиіс. Тәжірибелерден, керісінше, диффузия құбылысының да баяу жүретіні байқалады. Егер газда конвекциялық ағын болмаса, олардың атмосфералық қысымдағы араласуы бірнеше сағат немесе тәулік бойы жүреді.
3. Газ қабаттарына әртүрлі жылдамдықтар берілу арқылы, оның тепе-теңдік қалпы бұзылсын. Осы кезде, газдың жылдам қозғалатын бөліктерінен баяу қозғалатын бөліктеріне импульс тасылуы нәтижесінде, біршама уақыттан соң, оны құрайтын барлық қабаттардың жылдамдыгы теңеледі. Бұл тұтқырлық немесе ішкі үйкеліс құбылысы деп аталады. Тұтқырлық құбылы-сында, газдағы ағыс жылдамдықтарының теңелуінің негізгі себебі, оны құрайтын молекулалардың жылулық қозғалысы болып табылады.
Сонда, газ молекулаларының арасындағы ілінісу күштерінің әсерінен, оның әртүрлі жылдамдыктармен қозғалатын қабаттарының арасында пайда болатын үйкеліс күштерінің пайда болу процесі тұтқырлық деп аталады. Газ молекулаларының жылдам қозғалатынына қарамастан, бұл құбылыста баяу жүреді. Аталған қайшылықтың негізінде, молекулалардың еркін қозға-лысына кедергі жасайтын, олардың өзара соқтығысулары жатады.
Газда, молекулалардың жылдамдықтары бойынша Максвеллше таралуына әкелетін, тепе-тең күйдің орнауы массаның, энергияның және импульстің бағытталған ауысуымен қабат жүреді. Ортада жүретін бұндай процестер тасымалдау құбылыстары деп аталады. Оларға диффузия, тұтқырлық. Және жылу өткізгіштік құбылыстары жатады. Тәжірибелерден, молекулалы-кинетикалық теорияны пайдаланбай-ақ, газдардағы тасымалдау құбылыстарының заңдылықтары тағайындалған.
а) Ішкі үйкеліс немесе тұтқырлық құбылысы
Газ ағыны ХҮ жазықтығына паралель оң бағытта қозғалсын. Ламинарлық қозғалыста оның и жылдамдығы Z осі бойынша езгеріп отырады және соның себебінен, газдың көршілес қабаттарының арасында әсерлесу күштері пайда болады. Осы күштер ішкі үйкеліс күштері деп аталады және олар қабаттар жанасатын ΔS ауданға, газ ағынының жылдамдык градиентіне du/dz тура пропорционал:
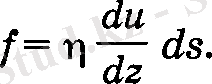 (11)
(11)
Пропорционалдық коэффициент η - ішкі щкеліс коэффициентпі деп аталады жене оның өлшем бірлігі пуазейль (Пуаз), 1Пуаз = 1Па • с. Жылдамдық градиенті, оның Z oci бойынша өзгеру тездігін сипаттайды. Аккан газ қабаттарының әртүрлі қозғалыстағы реттелген қозғалысына, оның молекулаларының бейберекет жылулық қозғалысы қосылады. Сондықтан, аққан газдың импульсі бірі бейберекет, екіншісі бағытталған қозғалыстарға сәйкес екі құраушыға бөлінеді. Егер температура тұрақты болса, молекула импульсінің бейберекет қозғалысын сипаттайтын құраушысы уақыт бойынша өзгермейді, ал оның импульсінің реттелген қозғалысына сәйкес құраушысы жөнінде бұндай қорытынды жасауға болмайды.
Жылдамдықтары әртүрлі екі газ қабатынан, X осіне параллель жене одан z қашықтықтан dS аудан бөлініп алынсын (3-сурет) . Осы аудан арқылы жылдам молекулалардың импульсі төменгі қабаттағы молекулаларға беріліп, олардың жылдамдығын арттырады. Бұл кезде жылдам молекулалар тежеледі, ал аудан арқылы тасымалданатын, импульс құраушысы молекуланың одан өтер алдындағы жылдамдығымен анықталады.
Молекуланың соңғы соқтыгысуы dS ауданынан X қашықтықта байқалатыны түсінікті. Сондықтан, төменгі қабаттағы газ ағынынан жоғарғы қабатқа отетін молекуланың координатасы z - λ , ал жоғарыдан томенгі қабатка өтетін молекуланың
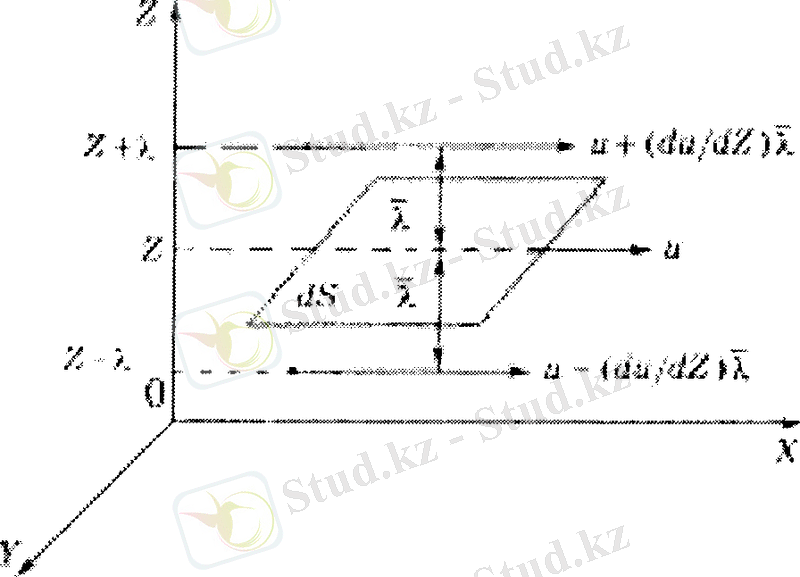
3-сурет.
координатасы z +λ. Осыдан, төменнен жоғарыға карай бір молекула
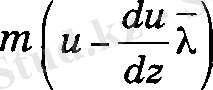
ал кері қарай ти импульс күрашыларын тасымалдайды. Осы сиякты жорарры қабаттан теменге
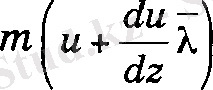
ал кері ти импульс құраушылары тасымалданады. Сонда бір қабаттан екіншісіне берілетін импульс мөлшері жоғарғы формулалардың айырымына тең, яғни,
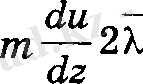
Импульстің толық өзгерісі, осы өрнекті dS ауданнан dt уақытта өткен молекулалар санына көбейткенге тең.
Бұны есептеу үшін табанының ауданы dS, биіктігі молекулалардың орта арифметикалық жылдамдығына тең параллелепипед қарастырылады. Молекулалардың барлық бағыттағы қозғалу ықтималдығының теңдігінен, Z осі бойымен олардың 1/3 белігі және оның жартысы жоғары, яғни, паралелепипедтегі барлық молекуланың 1/6 бөлігі, ал калған 1/6 бөлігі темен қозғалады. Егер барлық көлемде газдын тығыздығы тұрақты болса, оның коңцентрациясы п 0 ө згермейді. Олай болса параллелепипедтегі молекулалардың саны n Q υdS • dt ернегінен табылады, ал dS ауданнан dt уақытта өтетін молекулалар саны мына өрнек арқылы анықталады:
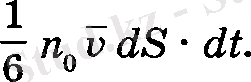
Сонда, бір қабаттан екіншісіне тасымалданатын импульстің толық өзгерісі мына формуламен анықталады:
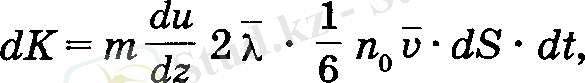
ал импульстін бір өлшем уақыттағы өзгерісі аркылы күш табылады:
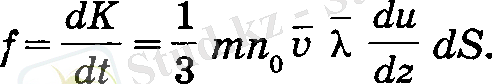
Осы формуланы, феноменологиялық түрде тағайындалған, (11) өрнекпен салыстыру ішкі үйкеліс коэффициентін береді:
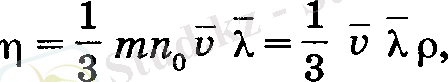 (12)
(12)
р =
mn
0
- газдың тығыздығы,
т
- бір молекуланың массасы. Есептеулерде
dS
ауданнан ететін молекулалардың тек оған нормаль бағытта қозғалғандары ескерілді. Ал егер осы ауданнан оған қиғаш бағытталған молекулаларда өтетіндігі ескерілсе, одан
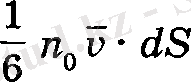 емес
емес
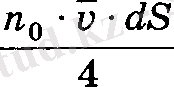 молекула ететіндігі байқалған.
молекула ететіндігі байқалған.
Олай болса тұтқырлық коэффициентінің дәлірек мәні мынаған тең:
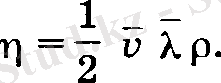 (13)
(13)
Газдың тығыздығы оның қысымына тура, ал
λ
оған кері пропорционал болғандыктан тұтқырлық коэффициента қысымға тәуелсіз. Бұл біріншіден, қысымға байланысты газ молекулаларының концентрациясынын кемуімен, екіншіден,
λ
-ның өсуіне сәйкес қарсы бағытта тасымалданатын импульс өзгерісінің артуымен түсіндіріледі. Газ тұтқырлығынын температураға тәуелділігі орта арифметикалық жылдамдыкка байланысты, яғни,
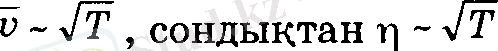 Бірак, тәжірибелер η-ның температураға байланысты бұған қарағанда тезірек есетінін көрсетті. Себебі, температура өскенде молекулалардың орта жылдамдығы гана емес, эффективті диаметрінің кемуіне сәйкес, олардың орта еркін жол ұзындығы да өседі. Сонда (13) өрнекке сәйкес, Т-ға байланысты, ішкі үйкеліс коэффициенті де тезірек артады.
Бірак, тәжірибелер η-ның температураға байланысты бұған қарағанда тезірек есетінін көрсетті. Себебі, температура өскенде молекулалардың орта жылдамдығы гана емес, эффективті диаметрінің кемуіне сәйкес, олардың орта еркін жол ұзындығы да өседі. Сонда (13) өрнекке сәйкес, Т-ға байланысты, ішкі үйкеліс коэффициенті де тезірек артады.
в) Жылу өткізгіштік құбылысы
Егер газ қабаттарының температурасы әртүрлі болса, онда температурасы жоғары қабаттан темен қабатқа жылу ауысады. Бұл процесс жылу өткізгіштік деп аталады. Газдан бөлінген көлемдегі температура Z осімен өзгереді деп саналсын (4-сурет) . Екі газ қабатын бөлетін dS ауданның үстінің температурасы жоғары, астының температурасы төмен болсын. Сонда жоғарғы қабаттан төменгісіне ауысатын жылу молшері dS ауданға, dt уақытқа жене dT/ dz - жылдамдық градиентіне тура пропорционал, яғни,
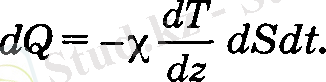 (14)
(14)
Пропорционалдык коэффициент % - жылу өткізгіштік коэффициенті деп аталады жене оның өлшем бірлігі Вт/м • К . Жылу өткізгіштік коэффициентінің сан мәні газдың тегіне жене күйіне тығгыз байланысты.
Температурасы жоғары қабаттагы молекулалардың кинетикалық энергиясы салқын қабаттыкінен кеп болғандықтан, бір қабат екіншісіне энергия беретіні түсінікті. Олай болса, осы қабаттардың арасындагы жылу мөлшерінің тасымалдануы, молекулалардың жылулық қозғалысының орташа кинетикалық энергиясының ауысуымен түсіндіріледі. Газдардың тұтқырлығын зерттеудегідей, мұнда да Δ S ауданнан z - λ қабатынан жоғары еткен молекулаларға
ал z + λ қ абатынан төмен
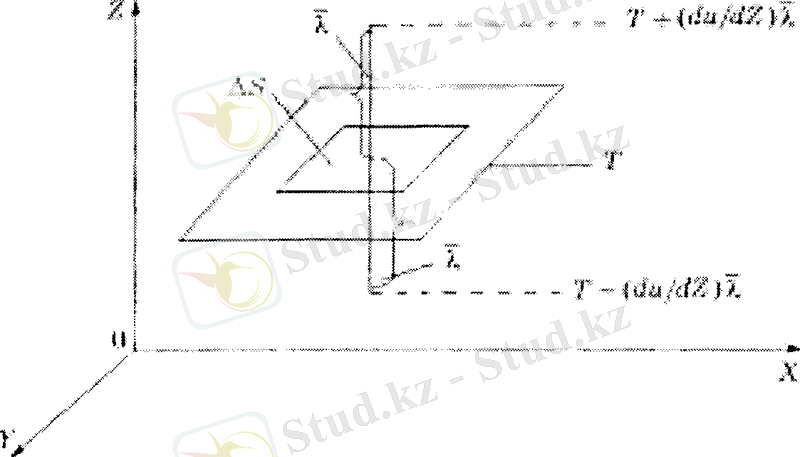
4-сурет.
қарай өтетін молекулаларга
 температуралармен анықталатын орташа кинетикалық энергиялар сәйкес келеді деп саналады. Осыдан, бір молекуланың ілгерілемелі қозғалысының орташа кинетикалық энергиясының
температуралармен анықталатын орташа кинетикалық энергиялар сәйкес келеді деп саналады. Осыдан, бір молекуланың ілгерілемелі қозғалысының орташа кинетикалық энергиясының
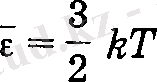
екендігін ескеріп, ΔS ауданнан бір молекуланың теменнен жоғарыға
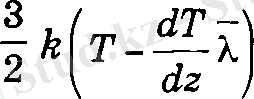
ал кері бағытта
 жылу мөлшері тасымалданатыны табылады. Осы сиякты жоғарғы қабаттан теменге
жылу мөлшері тасымалданатыны табылады. Осы сиякты жоғарғы қабаттан теменге
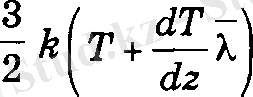
ал кері карай
 жылу мөлшері тасымалданады деп санауға болады. Бұлардың
жылу мөлшері тасымалданады деп санауға болады. Бұлардың
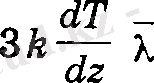
тең айырмасы қабаттан қабатка ауысатын энергия мөлшерін береді. Газ қабаттарындағы температуралар айырмашылығы онша көп болмаған жағдайда, ондағы молекулалардың концентрациясы мен жылдамдықтары шамалас, яғни,
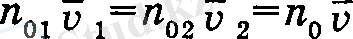
Сонда Δ S ауданнан бірлік уақытта өтетін молекулалар сан былай өрнектеледі:

Осыдан қабаттардың арасындағы тасымалданатын жылу мелшері мына формуламен анықталады:
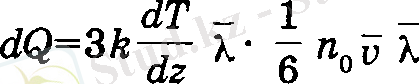 (15)
(15)
Бұл теңдеуді феноменологиялық тұрғыда алынған (14) теңдеуімен салыстырудан газдардың жылу еткізгіштік коэффициентпен анықталады:
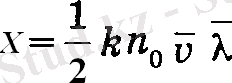 (16)
(16)
Молекулалы-кинетикалық теориядан бірлік колемдегі газ молекулаларының ілгерілмелі қозғалысының орташа кинетикалық энергиясы
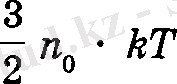 екендігі белгілі. Осыдан газды бір градусқа қыздыруға керекті жылу мелшері
екендігі белгілі. Осыдан газды бір градусқа қыздыруға керекті жылу мелшері
 Бірақ бірлік көлемдегі молекулалар саны газдың тығыздығына ρ тең, демек, газдың тұрақты көлемдегі меншікті жылу сыйымдылығы
Бірақ бірлік көлемдегі молекулалар саны газдың тығыздығына ρ тең, демек, газдың тұрақты көлемдегі меншікті жылу сыйымдылығы
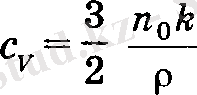
ал бұдан
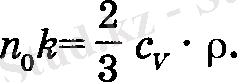
Осыны (16) қою аркылы жылу өткізгіштік коэффициента анықталады:
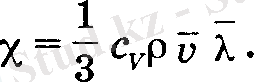 (17)
(17)
Жылу өткізгіштік коэффициента χ қысымға тәуелсіз. Себебі, v мен c v оған тәуелді емес, ал ρ қысымға тура, ал λ оған кері пропорционал. Ішкі үйкеліс құбылысына пайдаланылған тұжырымдарға сүйеніп, жылу өткізгіштік коэффициента χ квадрат түбір астындағы температураға пропорционал емес, одан біршама тезірек өсетіндігі байқалған.
с) Диффузия құбылысы
Газдар, молекулаларының жылулық қозғалысының себебінен, бір-бірімен араласа отырып, біртекті қоспа құрайды. Себебі бұл кезде әртекті газдардың концентрацияларының біркелкі еместігінен, олар бір қабаттан екіншісіне қарай ауысады. Осы, коспаны құрайтын газ молекулаларының концентрациясы жоғары қабатынан, оның концентрациясы төмен қабатына ауысу процесі диффузия құ былысы деп аталады. Диффузия бөлшектердің орын ауыстыруы нәтижесінде жүзеге асады, олай болса, мұнда масса тасымалданады.
Жүйенің күйін сипаттайтын параметрлер уақытқа байланысты үнемі өзгеріп отыратын процестер стационар емес деп аталады. Сонда, жүйені тепе-тең күйге әкелетін диффузия стационар, ал оның тепе-теңдік күйін бұзуға, газдағы концентрация айырымын ұлғайтуға бағытталған диффузия стационар емес деп аталады. Диффузия қоспалы газдарда ғана емес, егер газ-дың берілген келемдегі концентрациясы біркелкі болмаса, біртекті газдарда да жүреді. Бұнда, газ молекулалары, көлемнің концентрациясы көп бөлігінен концентрациясы аз бөлігіне ауысу арқылы, тепе-тең күйге келуге тырысады Бұл құбылыс өздік диффузия деп аталады.
Тығыздығы ρ, тек Z осі бойымен бірқалыпты өзгеретін газ бағанасын алайық (5-сурет) . Ол екі әртекті газ қабатынан құралсын және бір-бірімен dS аудан арқылы жанассын.
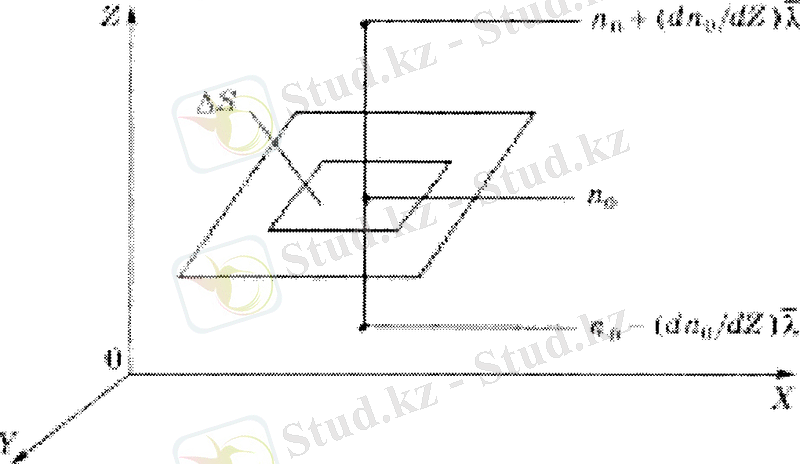
5-сурет.
Тәжірибелерден осы аудан аркылы dt уақытта ауысатын газ массасын мына формуламен анықтауға болатыны табылған (Фик заңы) :
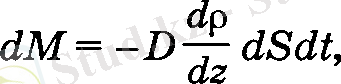 (18)
(18)
dM - Z осіне перпендикуляр dS аудан арқылы dt уақытта ауысатын газ мөлшері, ал dp/dz - тығыздық градиента.
Кез-келген бағыт бойымен алынған шаманың градиенті деп, осы шаманың сол бағытка сәйкес кеңістіктегі өзгеру жылда-дығын сипаттайтын векторды айтады. Пропорционалдык коэффициент D - диффузия коэффициенті деп аталады және ол газдың қасиеттеріне ғана емес, сонымен қатар, ортаның да күйіне, табиғатына, тығыздығына көп тәуелді. Диффузия коэффициентінің өлшем бірлігі м 2 /с.
Газдардың молекулалы-кинетикалық теориясына сүйеніп, диффузияның ең қарапайым түрін, өздік диффузия құбылысын қарастырайық және диффузия коэффициентін анықтайык. Газ ағынының z - λ , z және z + λ аймақтарындағы концентрацияла-рын п 01 , п 0 және п 02 деп белгілейік. 5-суреттен
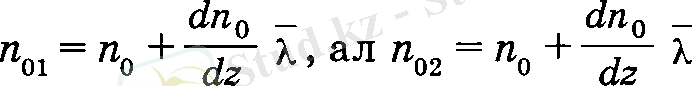
екендігі анық байқалып тұр. Сонда, жылу өткізгіштік және тұтқырлық құбылыстарындағы сияқты, диффузия әсерінен бірлік уақытта dS аудан арқылы төменнен жоғары қарай

ал кері бағытта

молекулалар отеді деп саналады. Осы шамалардың айырымы dS аудан аркылы бірлік уақытта z - λ қабаттан z+ λ қабатқа ауысатын олекулалардың санын береді:
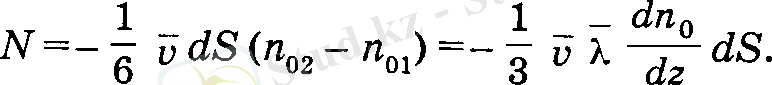
Бұл теңдеудің екі жағында молекуланың массасына т және уақытка dt көбейту арқылы dS аудан арқылы бір қабаттан екінші қабатқа ауысатын газ массасы анықталады:
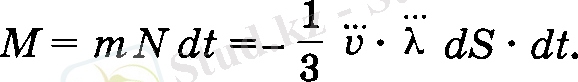
мұнда
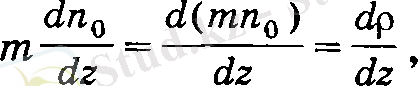
себебі mn o =p o тығыздықты береді. Осыдан, диффузия салдары-нан ауысатын газ массасы мынаған тең:
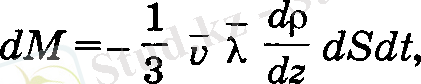 (19)
(19)
Бұл теңдеуді (2. 18) теңдеумен Салыстыру арқылы диффузия коэффициента анықталады:
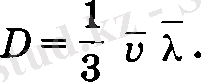 (20)
(20)
Газ молекулаларының жылулық қозғалысының орта арифметикалық жылдамдыгы квадрат түбір астындағы температураға тура пропорционал, бірақ қысымға тәуелсіз. Ал олардың орта еркін жол ұзындығы λ қысымға кері пропорционал өзгереді. Олай болса диффузия коэффициента кысымға кері пропорционал, яғни
 ал квадрат түбір астындағы температураға тура пропорционал, яғни,
ал квадрат түбір астындағы температураға тура пропорционал, яғни,

Ылғал тасымалдың потенциалы.
Капиллярлы - саңылаулы денелерде жылу тасымалдау мен зат массасының кинетикасы тасымалдың потенциалдар айырымымен анықталады. Жылу тасымал потенциал түсінігі бұрын енгізілген және термодинамикады қатаң негізделген, ылғал тасымал потенциал түсінігі жылумасса алмасудың термодинамикалық аналогия негізінде тек соңғы кезде енгізіледі.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz