Зертханалық операциялар (сүзу және газ алу) және атом-молекулалық ілім негіздері: моль, газ заңдары және эквиваленттер


1. 4 Химиялық операцияларды орындау
1. 4. 1 Сүзу
Сұйықтықты қатты күйдегі майда қосымшаларынан бөліп алу үшін сүзгіштер қолданылады. Сүзгіштен өткен сұйыкты сузінді(фильтрат) деп атайды. Зертханада жазық және бірнеше бүктелген сүзгіш қағаздар қолданылады. Төрт бұрышты сүзгіш қағаздан сүзгішті дайындау үшін қағазды төрт бүктейді де ашық жағынан қиып алып, воронкаға салады, сулайды және сүзгіштің шеті воронка шетінен 3 - 5 мм төмен болуы керек (2-сурет) .
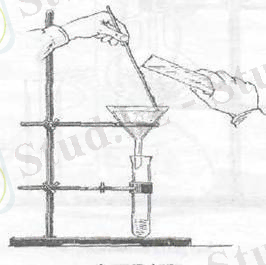
2 - сурет. Сүзу процессі.
Кейде ыстықтай сүзу колданылады. Сүзуді тездету үшін вакуумды пайдаланады. Вакуумда сүзуге арналған құрал - Бунзен колбасынан, Бюхнер воронкасынан (фарфор) және сақтық ыдыстан тұрады және оларды суағынды насосқа жалғайды. Егер тұнба ерімейтін болса, оны жуғыш аспаптың көмегімен жуып тазартады.
1. 4. 2 Газдармен жұмыс істеу
Газдарды алу. Газ тәріздес заттарды зертханада алу үшін:
а) бірнеше құрғақ заттардың қоспасын қыздырады;
ә) бір құрғақ затты жоғарға температурада қатты кыздырады;
б) құрғақ затты сұйық затпен кыздырып немесе қыздырусыз әрекеттестіреді.
Құрғақ заттарды қыздыру арқылы газ алу үшін пробирка немесе реторта қолданылады. Газдарды алуда құрғақ заттарды сұйық заттармен араластыру әдісі жиі қолданылады. Ол үшін 3 - суреттегі құралдар колданылады. Бұл пробиркаларды қолданғанда ауа жібермейтінін тексеру керек.
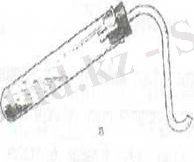
3 - сурет. Газдарды алу
Прибор саңылаусыз (герметикалық) екенін тексеру үшін газ түтікшесін суға батырып, реакция жүретін колбаны немесе пробирканы сәл қыздырады, егер пробирка саңылаусыз болса суға ауа көпіршіктері бөлінеді, қыздыруды тоқтатқанда су пробирканың ішіне кіреді.
Газды алу үшін зертханада Кипп аппараты жиі қолданылады. Бүл шыныдан жасалған және автоматты жұмыс істейтін құрал. Кипп аппараты шар тәрізді резервуарлардан тұрады (4 - сурет) . Оның төменгі резервуарында (1) қысыңқы жері бар және оған шар тәрізді воронка (2) қондырылған. Құйылған сұйықтық әдетте воронкаға сияды. Төменде тығынмен жабылған тубус бар, ол жерден пайдаланылған сұйықтық төгіледі. Ортаңғы шардың да тубусы бар, оған краны бар түтік өткізілген және тығынмен жабылады.
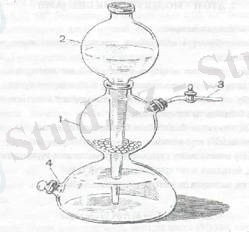
4 - сурет. Кипп аппараты.
1 - ортасы кысыңкы ыдыс; 2 - шар тәрізді воронка; 3 - газ өткізгіш түтік; 4 - тубус.
Кипп аппаратымен көміртек (IV) оксидін, сутегін, күкіртсутегін т. б. газдарды алуға болады. Кипп аппаратында көміртек (IV) оксидін алу үшін ортаңғы шарға мрамор салып, жоғарғы воронкаға тұз кышқылын құяды, кранды (3) ашқанда қышқыл жоғары көтеріліп, мрамормен әрекеттесіп газ бөліне бастайды. Кранды (3) жапқанда реакция тоқтайды.
Газдарды тазарту және сіңіру. Прибордан шыққан газ таза болу үшін оны түрлі заттардан өткізіп кептіреді және тазартады, мысалы, сутегі газының құрамында күкіртсутек болуы мүмкін, сондықтан оны тазарту үшін КМпО4 немесе К2Сг207 ерітіндісі арқылы жібереді, ал көміртек (IV) оксидін кептіру үшін оны концентрлі Н2SО4 немесе фосфор (V) оксидінің үстінен өткізеді. Газдарды кептіру үшін Тищенко сауыттарына және хлоркальцилі түтіктерге салынған қүрғақ кептіргіштердің қабаттарынан өткізеді.
2. АТОМ - МОЛЕКУЛАЛЫҚ ІЛІМ (АМІ)
АМІ-нің негізгі қағидалары:
Атомның бір түрі екіншісінен заряды, мөлшері және массасы жөнінен ажыратылады;
Атомдар топтасып молекула түзеді. Жай зат молекуласы бірдей атомдардан, ал күрделі зат молекуласы әр түрлі атомдардан тұрады. Молекулалар бір-бірінен массасы, мөлшері және атомдардың кеңістікте әр түрлі орналасуына байланысты ажыратылады;
Заттың химиялық бөлінбейтін бөлшегі атом, ол тек бір молекула кұрамынан екіншісіне өтуі мүмкін;
Атомдар молекулалық құрылысты заттардан өзге кұрылысты (атомдық, иондық, металдык және кристалдық) заттар түзеді;
Атом да, молекула да үздіксіз қозғалыста болады.
2. 1 Химияның негізгі ұғымдары
Қазіргі кезде химияда зат массасы және зат мөлшері деген үғымдар жиі пайдаланылады. Зат массасының өлшем бірліктері:грамм, килограмм, тонна. Бүлардың ішінде халықаралық өлшемдер жүйесінде (СИ) масса бірлігі ретінде килограмм қолданылады. Зат мөлшерін бөлшектер: молекула, атом, ион, электрон санымен көрсетеді. СИ жүйесіндегі зат мөлшерінің өлшем бірлігі - МОЛЬ.
Моль дегеніміз - массасы 0, 012 кг-ға тең көміртегінде (12С) қанша атом болса соншама құрылымдык бөлшектері (атом, молекула, ион, электрон және т. б. ) бар жүйедегі зат мөлшері.
Көміртектің келтірілген массасындағы атомдардың саны 6, 02 Ч10 23 моль -1 тең. Демек, 1 моль затта 6, 02Ч1023 бөлшектер саны бар деген сөз.
Бұл сан Авогадро саны немесе Авогадро тұрақтысы деп аталады және келесі түрде жазылады:
NA= 6, 02 Ч1023 моль-1 .
«Моль» ұғымы анықтамасынан кез келген құрылымдық бөлшектің саны туралы айтуға болады. Мысалы, атом күйіндегі сутектің 1 молінде 6, 02 Ч10 23 сутек атомдары; 1 моль молекулалық сутекте 6, 02Ч1023 сутек молекулалары; сутек иондарының 1 молінде 6, 02Ч1023 сутек иондары бар.
Мольмен қатар киломоль, миллимоль т. б. ұғымдарды қолданады. Киломолъде 6, 02 Ч1026 бөлшектер, ал миллимольде 6, 02Ч1020бөлшектер саны бар.
Айтылғандармен қатар өлшемі жоқ салыстырмалы атомдық масса (Ar), салыстырмалы молекулалық масса (Мr), молъдік масса М, мольдік көлем (Vm) ұғымдарын ажырата білу керек.
Заттың салыстырмалы атомдық массасы (Аr) - элементтің табиғи изотоптық құрамынан шығатын орташа атомдық массасының көміртек атомы (І2С) массасының 1/12 бөлігінің катынасына тең.
Сонымен элементтің салыстырмалы атомдық массасы берілген элемент атомының, массасы көміртек атомы массасының 1/12-нен неше есе артық екенін көрсетеді.
Заттың салыстырмалы молекулалық массасы (Мr) дегеніміз - зат молекуласы массасының көміртек атомы массасының 1/12 бөлігінің қатынасына тең.
Мольдік масса (М) дегеніміз - зат массасының зат мөлшеріне (n) катынасы:
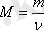
оның өлшемі г/моль немесе кг/моль, мольдік масса (М) сан жағынан салыстырмалы молекулалық массаға (Мr) тең. Мольдік массаны келесі формуламен есептеуге болады:
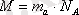
мұндағы: mа - бөлшектер массасы (г, кг), NA - Авогадро саны.
Мольдік көлем дегеніміз - газ көлемінің (V) зат мөлшеріне (n) қатынасы:
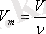
оның өлшем бірлігі л/моль немесе м3/моль.
2. 1. 1 Көміртек (IV) оксидінін салыстырмалы молекулалық масссын табу.
Жұмысқа қажетті құралдар: Кипп аппараты, Тищенко шөлмектері,
колба (250мл), өлшеуіш цилиндр, тығын,
технохимиялық таразы, гирлер жиынтығы,
алауыз қарындаш, термометр, барометр.
Реактивтер: Мрамор, НСl (r = 1, 19 г/см3), Н2SО4 (r = 1, 84 г/см3), дистильденген су.
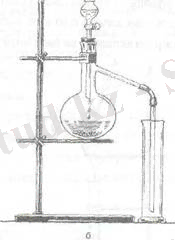
Көміртек (IV) оксидін, яғни көмір қышқыл газын алуға арналған қондырғы (6 - сурет) мрамор түйірлері салынған және тұз қышкылы құйылған Кипп аппаратынан (1), тізбектеп жалғастырылған екі Тищенко шөлмектерінен (2 - шөлмек көмір қышкыл газын хлорсутектен және әр түрлі қоспалардан тазарту үшін сумен толтырылған, ал 3 - шөлмек газды кептіру үшін күкірт қышқылымен толтырылған) және көмір қышқыл газын өлшеуге арналған сыйымдылығы 250 миллилитрлік колбадан (4) тұрады.
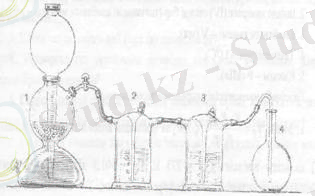
6 - сурет. Көміртек (IV) оксидін алуға арналған қондырғы: 1 - Кипп аппараты; 2, 3 -Тищенко шөлмектерІ;
4 -сыйымдылығы 250 мл тегіс түпті колба.
Тәжірибені жасау жолдары:
Сыйымдылығы 250 мл тегіс түпті колбаны жуып, кептіру қажет. Содан кейін оны тығыз жабылатын тығын жауып және тығынның колба мойнына келетін жерін белгілеу керек (ол үшін колба мойнына резеңке сақина кигізген немесе балауыз қарындашпен белгілеген жөн) . Технохимиялық таразыда 0, 01г-ға дейінгі дәлдікпен колбаны тығынымен қоса өлшейді және массасын жазып алу қажет.
Газ шығатын түтікті колбаның түбіне дейін жеткізіп, колбаны көмір қышқыл газымен толтырады (10-15 мин) . Колбаны тығындап жауып қайтадан өлшейді. Колбаның ішіндегі ауа толығымен ығыстырылып шыққанына және колба көміртек (IV) оксидімен толғанына көз жеткізу үшін колбаны өлшеп алып, тағы да бірнеше минут (5 мин) колбаға газ шығатын түтік арқылы көмір қышқыл газын жібереді.
Содан кейін колбаны қайтадан өлшеу керек. Бұл тәжірибе колбаның массасы тұрақты болғанға дейін қайталана береді. Ішінде көмір қышкыл газы бар колбаның массасын жазып алыңдар. Колбаны тығынына дейін сумен толтырып, ол судың көлемін өлшеуіш цилиндрмен өлшеп колбаның көлемін анықтайды. Нәтижесін жазып алу керек. Тәжірибе кезіндегі барометр мен термометрдің көрсеткіштерін белгілеп жазып алу қажет.
Бақылауды нәтижелерін жазу үлгілері:
Ішінде ауасы бар (тығынмен) колбаның массасы - m1 (г) ;
Ішінде көміртек (IV) оксиді бар (тығынмен) колбаның массасы - m2 (г) ;
Колбаның көлемі - V (мл) ;
Бөлме температурасы - t0( С) ;
Бөлме қысымы - Р (кПа) .
Тәжірибе нәтижесінің қорытындысын шығару:
Идеал газдың күйін сипаттайтын теңдеу бойынша колбадағы ауаның көлемін (V) қалыпты жағдайға (То = 273К, Ро = 101, 3кПа) келтір;
Қалыпты жағдайда 1л ауаның массасы - 1, 29г тең болатынын біле отырып колбадағы ауаның массасын - m3 есептеп шығар;
Қалыпты жағдайда 1л сутегінің массасы - 0, 09г тең болатынын біле отырып колбадағы сутегінің массасын - m4 есептеп шығар;
Колбадағы көміртек (IV) оксидінің массасын - m(CO2) есепте:
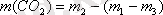
Сутегі бойынша көміртек (IV) оксидінін тығыздығын есепте:
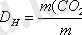
Көміртек (IV) оксидінін салыстырмалы молекулалық массасын есепте:
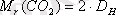
Тәжірибе кезінде кететін аздаған қатенің пайыз мөлшерін (салыстырмалы қателік) есепте:
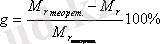
2. 2 Газ заңдары
Массасы берілген газдың күйі температурамен (t°), көлеммен (V) және кысыммен (Р) анықталады.
Егер Р = 1, 01325×105Па = 101, 325 кПа және t°С = 0°С болса, бұл жағдайды қалыпты жағдай деп атайды. Бұл жағдайдағы (қ. ж. ) көлемді (V0), ал кысымды (Р0) деп белгілейді.
Қалыпты жағдайдағы газдар күйін идеал газдар заңы анықтайды.
Авогадро заңы: бірдей жағдайда бірдей көлемде алынған газдарда
молекулалар сандары бірдей болады. Бір моль заттағы молекулалар санын Авогадро саны деп атайды. NA= 6, 02 ·1023 моль-1деп белгілейді.
Көлемдік қатынас заңы (Гей-Люссак заңы) : Реакцияласушы және реакциядан шығатын газдардың көлемдерінің қатынасы кіші бүтін сандар қатынасындай болады.
Бойль-Мариотт заңы: Тұрақты температурада газдың алынған массасының көлемі қысымға кері пропорционал болады:
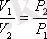 немесе
немесе
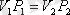
Гей-Люссак заңы: Қысым тұрақты болғанда көлем мен температура бір-біріне тура пропорционал болады:
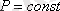 ;
;
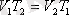
Шарль заңы: Көлем тұрақты болғанда қысым мен температура бір-біріне тура пропорционал болады:
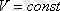 ;
;
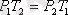
Бойль-Мариотт, Гей-Люссак және Шарль заңдарын біріктіре отырып, идеал газдың күйін сипаттайтын теңдеуді табуға болады. Оған үш шама - қысым (Р), көлем (V) және температура (Т) кіреді:
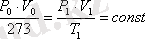
Егер
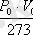 шамасы 1 кг газ үшін алынса, ол әр түрлі болады, ал егер газ 1 моль етіп алынса, ол барлық газдар үшін түрақты (себебі?) .
шамасы 1 кг газ үшін алынса, ол әр түрлі болады, ал егер газ 1 моль етіп алынса, ол барлық газдар үшін түрақты (себебі?) .
Бұл шама универсал газ тұрақтысы деп аталады да, R - деп белгіленеді. Демек, газ мөлшері 1 моль болса, онда:
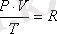 немесе
немесе
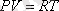
Бұл тендеу Менделеев-Клапейрон теңдеуі деп аталады. Егер 1 моль газ алынса тендеу келесі түрде жазылады:
 ;
;
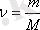 онда
онда
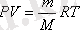
R - сандык мәні және өлшемі көлем мен қысымның өлшем бірлігіне тәуелді. Халықаралық СИ жүйесінде қысым (Па), масса (кг), зат мөлшері (моль), ал көлем (м3) алынса, онда 1 моль газ үшін R-ді есептеуге болады:
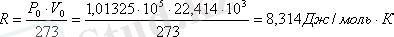
2. 3 Эквивалент заңы. Химиялық элементтердің және қосылыстардың эквиваленттік массалары
Химиялық қосылыстардың құрамына кіретін элементтер өзара белгілі және тұрақты салмақ қатынасында болады (құрам тұрақтылық заңы) . Бұл қатынастар олардың эквиваленттеріне сәйкес келеді.
Элементтің эквиваленті дегеніміз - оның 8 салмақ оттегімен немесе 1, 008 салмақ бөлік сутегімен реакция кезінде қосылыса алатын немесе косылыстарда солардың орнын баса алатын салмақ мөлшері.
Элементтің эквивалентіне сәйкес масса эквиваленттік масса деп аталады. Егер элемент сутегімен немесе оттегімен қосылыс түзетін болса, оонда оның эквиваленті қосылыс құрамынан тікелей анықталуы мүмкін (тура аныктау тәсілі) .
Егер элемент сутегін оның косылысынан ығыстырып шығаратын болса, мұндай элементтің эквивалентін бөлініп шыққан сутегінің мөлшері бойынша анықтауға болады (ығыстыру тәсілі) .
Көп жағдайларда эквивалент (сутегі немесе оттегі арқылы емес) эквиваленті белгілі басқа элементпен қосылысы бойынша анықталады (жанама анықтау тәсілі) .
Күрделі заттардың: қышқылдар, негіздер және тұздардын эквивалентін (Э) және эквиваленттік массасын (mэ) анықтауға болады.
Күрделі заттардын эквиваленті дегеніміз - екінші заттың бір эквивалентіне сай келетін мөлшері.
Қышқыл эквиваленті - 1/негізділігі, мольге тең. Қышқылдың эквиваленттік массасын табу үшін, оның мольдік массасын негізділігіне бөлеміз немесе мольдік массасьш эквивалентіне көбейтеміз:
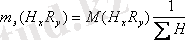
Мысалы, Н3РО4 - фосфор қышқылы үшін М (Н3РО4) = 98 г/моль. mэ = 98 г/моль Ч 1/3 моль = 32, 7 г.
Негіздің эквиваленті - 1/қышқылдылығы, мольге тең (қышқылдылығы ОН- иондарының санына тең) . Негіздің эквиваленттік массасын табу үшін негіз молінің массасын қышқылдығына (ОН- тобының санына) бөлу керек немесе мольдік массасын эквивалентіне көбейту керек
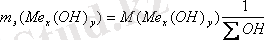
Мысалы, Ва(ОН) 2 - барий гидроксиді үшін М(Ва(ОН) 2) = 171 г/моль. mэ = 171 г/моль Ч Ә моль = 85, 5 г.
Тұздың эквивалентті - 1 мсль/металл атомдарының жалпы валенттігі. Тұздың эквиваленттік массасын табу үшін оның мольдік массасын металл атомдарының жалпы валенттігіне (демек валентгігі мен индекісінің көбейтіндісіне) бөледі немесе мольдік массасын эквивалентіне көбейтеді.
Мысалы, Fе2(SО4) 3 - темір (Ш) сульфаты үшін М (Fе2(SО4) 3 ) = 400 г/моль, Э = 1/6 моль.
mэ = 400 г/моль Ч 1/6 моль = 66, 7 г.
Элементтің эквиваленті сияқты күрделі заттың эквиваленті де, эквиваленттік массасы да ауыспалы болуы мүмкін, ол химиялық реакциялардағы өзгерістерге тәуелді болады.
Мысалдар: Н2SО4: а) Н2SО4 + NaОН = NaHSO4 + Н2O
Э(Н2SО4) = 1 моль,
mэ = 98 г/моль Ч 1 моль = 98 г.
ә) Н2SО4 + 2NaОН = Na2SO4 + 2Н2O
Э(Н2SО4) = 1/2 моль,
mэ = 98 г/моль Ч 1/2 моль = 49 г.
Си(ОН) 2: а) Сu(ОН) 2 + НСІ = Сu(ОН) СІ + Н2О
Э(Сu(ОН) 2) = 1 моль,
mэ(Си(ОН) 2) = 98 г/моль Ч 1 моль = 98 г
ә) Сu(ОН) 2 + 2НСІ = СuСІ2 + 2Н2О
Э(Сu(ОН) 2) = 1/2 моль,
mэ(Си(ОН) 2) = 98 г/моль Ч 1/2 моль = 49 г
АlСl3: АlСl3 + 2 NаОН = А1(ОН) 2С1 + 2 NaС1
Э(А1С13) = 1/2 моль,
mэ(А1С13) = 133, 5 г/моль Ч Ә моль = 66, 7 г
Есептеулер жүргізгенде эквиваленттік масса деген ұғыммен қатар эквиваленттік көлем қолданылады.
Зат эквивалентінің берілген жағдайдағы алатын көлемін эквиваленттік көлем деп атайды.
Мысалы, сутектің (қ. ж. ) эквиваленттік көлемі - 11, 2 л тең, ал оттектің (қ. ж. ) эквиваленттік көлемі - 5, 6 л.
Эквивалентті тәжірибелік жолмен анықтағанда, заттар бірімен-бірі эквиваленттеріне пропорционал мөлшерде әрекеттесетінін (эквивалент заңы) ескеру керек.
Эквивалент заңы: Заттар бір-бірімен эквиваленттеріне пропорционал масса мөлшерінде реакцияласады:
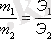
мұндағы: m1 және m2 - зат массалары;
Э1 және Э2 - заттардың эквиваленттік массалары.
2. 3. 1 Магний эквивалентінің мольдік массасын анықтау
Егер элемент сутегін оның қосылысынан ығыстыра алатын болса, мұндай элементтің эквиваленті ығыстыру тәсілімен анықталуы мүмкін.
Ығыстыру тәсілімен эквивалентті аныктауға арналған прибор штативке бекітілген сыйымдылығы 50 мл бюреткадан, резеңке түтік арқылы жалғасқан воронкадан және пробиркадан тұрады. Бюретка мен пробирка шыны түтік өткізілген тығындармен тығыз тығындалады (5-сурет) .
Тәжірибе жасау алдында прибордың ауа өткізбейтіндігін тексеру керек. Ол үшін бюреткаға су құйған кезде, су бюретканы воронкамен жалғастырып тұрған резеңке түтікшені де толтырады. Содан кейін бюретканы тығыз тығындап пробиркамен жалғастырып, бюреткадағы судың деңгейін белгілеу қажет. Штативтің сақинасын жылжыту арқылы воронканы төмен түсіру керек. Егер прибор «ұстаса» вороиканы төмендеткенде алғашында бюреткадағы судың деңгейі біраз төмендейді де содан кейін бір қалыпта өзгерместен қалады. Егер судың көлемі біртіндеп төмендей берсе, онда прибордан ауа шығып тұрғандығы. Бұл ақаулықтың себебін оқытушымен ақылдасып анықтау және түзету қажет.

5 - сурет. Заттың эквивалентін анықтауға арналған қондырғы
Тәжірибені жасау жолы:
Аналитикалық таразыда массасын 0, 01г-ға дейінгі дәлдікпен 0, 03г. магний лентасын өлшеп алу. Пробирканың тығынын ашу және воронканы жоғары төмен қозғау арқылы бюреткадағы судың деңгейін нольге дейін немесе одан кішкене ғана төменірек түсетіндей жағдайға қою керек. Содан кейін 5 мл сұйытылған күкірт қышқылын өлшеп алып, оны кішкене воронка арқылы пробиркаға құю керек (пробирканың жоғарғы қабырғасына жұғып қалмасын) . Пробирканы көлбеу ұстап магний лентасын күкірт қышкылына тимейтіндей етіп, оның құрғақ жеріне салу керек.
Магний лентасы күкірт қышкылына тимеуін қадағалай отырып, пробирканы тығынмен тығыз жабу керек. Содан кейін воронканы жоғары төмен жылжыту арқылы прибор ішіндегі қысымды атмосфералық қысыммен тең ету үшін бюретка мен воронканын ішіндегі судың деңгейін (бюретканың ноль бөлігіне жақын) бірдей биіктікке келтіру қажет. Бюреткадағы судың деңгейін белгілеу және жазып қою керек. Сұйыктың төменгі деңгейінен 0, 1 миллилитрге дейінгі дәлдікпен есептеу қажет. Күкірт қышқылына магний лентасын салып, сутегінің бөлінуін және бюреткадан судың ығысып шығуын бакылаңдар. Реакция аяқталғаннан кейін пробирканы бөлме температурасына дейін суытып, бюреткадағы судың деңгейін белгілеп және жазып алу керек. Тәжірибе кезінде бөлме термометрі мен барометрдің көрсетуін белгілеп жазып алыңдар.
Бақылау нәтижелерін жазу үлгілері:
1. Магнийдің салмағы - m, г.
2. Температура - t°;
3. Қысым - Р (мм сынап бағанасы) .
4. Реакцияға дейінгі бюреткадағы судың деңгейі - а1;
5. Реакциядан кейінгі бюреткадағы судың деңгейі - а2.
Тәжірибе нәтижесінің қорытындысын шығару
1. Бөлме температурасы (t°) мен қысымдағы (Р) магний ығыстырып
шығарған сутегінін көлемін (V, мл) табу қажет: V = а2 - а1
2. Төмендегі формула бойынша табылған сутегінің көлемін қалыпты
жағдайға келтіру:
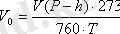
Т = t° + 273°К - абсолюттік температура;
һ - берілген температурадағы су буының қысымы (қосымшадағы 2А -кесте) .
3. Сутегінің грамм-молекуласы, қалыпты жағдайдағы 22, 4 л тең көлемалатынын біле отырып бөлініп шықкан сутегінің салмағын (g) табу.
4. Төмендегі формула бойынша магнийдің эквивалентін табу:

Мұндағы, m - алынған магнийдің салмағы, g - бөлінген сутегінің салмағы.
5. Магнийдің табылған эквивалентін теория бойынша анықталған эквивалентімен салыстыру және төменде берілген формула бойынша тәжірибе кателігінің пайызын табу:
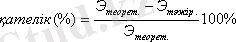
3. ХИМИЯЛЫҚ ФОРМУЛАЛАР ЖӘНЕ ТЕНДЕУЛЕР БОЙЫНША ЕСЕПТЕУЛЕР
3. 1 Заттың қарапайым формуласын есептеу
Химиялық формулалар химиялық косылыстың сапалық және сандық құрамын білдіреді. Егер химиялық формула заттың құрамына кіретін элемент атомдар сандарының қатынасын ғана көрсететін болса, оны қарапапым формула деп атайды. Ал, заттыңнақты формуласы оның құрамына кіретін атомдардың түрін және санын көрсетеді. Нақты формула затгың салыстырмалы молекулалық массасын, мольдік массасын, 1 молінің массасын табуға мүмкіндік береді.
Егер заттың салыстырмалы молекулалық массасы белгісіз болса, оның қарапайым формуласын табуға болады. Қарапайым формула мен нақты формула сәйкес келе бермейді.
Қарапайым формуланы табу үшін:
1. Қосылыстың пайыздық құрамын, яғни элементтердің массалық үлесін - w, % білу қажет;
2. Элементтердің салыстырмалы атомдық массаларын білу қажет.
Мысалы: Құрамында 43, 4% - натрий, 11, 3% - көміртегі және 45, 3% - оттегі бар. Қосылыстың қарапайым формуласын табыңыз.
Бұл қосылыс молекуласының құрамына натрийдің х - атом саны, көміртегінің у - атом саны және оттегінің z - атом саны кіреді деп есептейік. Есепті шығару үшін осы х, у, z сан мәндерін табу керек, яғни NaхСyОz формуланы анықтау кажет.
Ол үшін Аr(Na) = 23; Аr(С) = 42; Аr(О) = 16 екенін ескере отырып, бұл зат молекуласында натрий үлесіне - 23х, көміртегі үлесіне - 12у, ал оттегі үлесіне - 16z массалық бөлік келетінін табамыз. Бұл шамалардық қатынасы қосылыстағы элементтердің пайызбен көрсетілген массалык үлестерінің қатынастарына тең болады:
23х: 12у: 16z = 43, 4 : 11, 3 : 45, 3
Бұл пропорцияның біріншісін 23-ке, екіншісін 12-ге, ал үшіншісін 16-ға бөлгенде келесі қатынасты аламыз:
х : у : z = 43, 4/23 : 11, 3/12 : 45, 3/16 немесе х : у : z = 1, 9 : 0, 9 : 2, 8
... жалғасы
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz