Органикалық химия: А.М. Бутлеровтың құрылыс теориясы, молекулалық байланыстар және индуктивті-мезомерлік әсерлер


Жоспары:
- Органикалық химия пәні.
- А. М. Бутлеровтың органикалық қосылыстардың құрылысы туралы теориясы.
- Органикалық қосылыстар молекулаларындағы химиялық байланыс.
- Органикалық қосылыстар молекулаларындағы атомдардың өзара әсері. Индуктивті және мезомерлі эффектілер туралы түсінік.
Химиялық байланыс жэне молекуладағы атомдардың өзара әсері
А. М. Бутлеровтың химиялық құрылыс теориясы (1861ж. ) бойынша:
- Органикалық қосылыстар молекуласындағы атомдар бір-бірімен белгілі бір тәртіппен, валенттілігіне тәуелді орналасқан. Атомдардың белгілі бір тәртіппен орналсуының бұзылуы, жаңа затгың түзілуіне алып келеді. Мысалы, С2НбО формуласына екі эртүрлі қосылыс сәйкес келеді: диэтилэфирі(СН3-О-СН3) және этил спирті (С2Н5ОН) .
- Заттардың қасиетгері молекула құрылысына, яғни атомдардың қосылу ретіне және байланыс сипатына тэуедці.
Органикалъқ молекулалардың құрылысы - оның құрамындағы атомдардың химиялық байланыстардың көмегімен бегілі бір ретпен байланысып орналасуы. Органикалық қосылыстарға коваленттік δ - және π-байланыстар тән.
Коваленттік байланыс - электрондар жұптасуы арқылы тузілетін байланыс.
δ-Байланыс- атом орбитальдарының тура ось бойында қабысу арқылы түзілген байланыс.
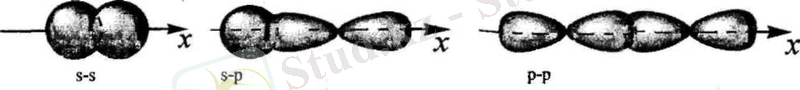
π -Байланыс- гидридтелмеген р- орбитальдардың жазықтықтың бетінде және астында бүйірлей қабысу арқылы түзілген байланыс.

Ковалентті байланысты сипаттайтын көрсеткіштер:
Байланыс энергиясы- өзара байланысқан екі атомның түзілуіне немесе үзілуіне қажет энергия. Атомдар арасында байланыс түзілгенде неғүрлым энергия көп бөлінсе, соғырлым байланыс мықты болады
Байланыс ұзьндығы - байланысқан атомдар орталықтарының арасындағы қашықтық.
Валенттік бұрышы - ортақ атомнан тұратын екі байланыстың арасындағы бұрыш. Органикалық қосылыстардагы Х-С-Ү ядро аралық байланыстардың бұрышы көміртек атомының гибридтелу түріне сәйкес, ягни sp 3 -, sp 2 - және sp-гибридтік күйге сәйкес 109, 5; 120 және 180 тең болады.
Байланыс полюстілігі - электрон тығыздығьның әркелкі таралуы.
Электртерістілік - молекуладағы атомның химиялық байланысқа қатысатын валенттік электрондарды өзіне тарту қабілеті (күші) .
Ығысудың электрондық теориясы. Бұл теорияның екі мәні электрондық әсері жайлы мазмұндалған ілімде болатын: индуктивті және мезомерлі .
Оның біріншісін - индуктивті әсер арқылы таңбалайды және ол оң (+Ј) не теріс (-Ј) таңбалы болады. Индуктивті әсер (І-әсер) - орынбасарлардың электрондық әсерінің δ-байланыс бойында таралуы. Индуктивті әсер
Кейбір элементтердің Полинг(1932) шкаласы бойынша
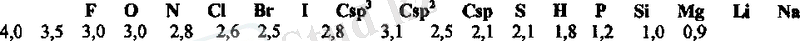
Электртерістілігі әртүрлі атомдар арасындагы пайда болған байланыс полюсті болады.
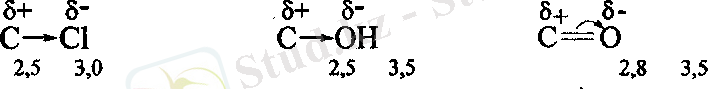
Молекулада полюсті а-байланыстың болуы, көршілес екі-үш ст-байланыстардьщ полюстігін өзгертеді де, көршілес атомдарда жартылай зарядтар (5 + , 5") пайда болады. 8 + - Электрон бүлтының жетіспеушілігін, ал 8" электрон бұлтының артқанын көрсетеді.
Индуктивті эффект (І-эффект) - орынбасарлардың электрондық әсерінің ст-байланыс бойында таралуы.
Индуктивті эффектің әсері 8-байланыс бойында біртіндеп сөнеді.
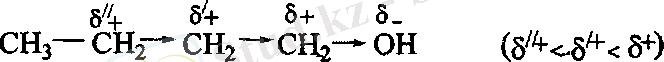
Реакция орталығының электрон бүлтын кемітетін орынбасарлар электроноакцепторлы (-1- эффект), ал реакция орталығының электрон бүлтын арттыратын орынбасарлар электронодонорлы (+1- эффект) деп аталады
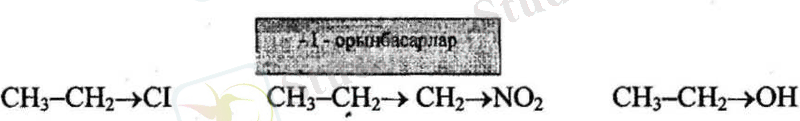


Кейбір орынбасарлардың электрондық әсері
+1
+1
-I
-I
-I
-I
-I
-M
-I
-M
-I
-M
-I
-M
-I
M
Мезомерлі эффект немесе қабысу - орынбасарлардың электрондық әсерінің л-байланыс бойында таралуы.
Қабысқан жүйе - гибридтелмеген /7-орбитальдардың қосарлануы нәтижесінде түзілген біріңғай электрон булты.
Біріңғай электрон бүлты кезектесіп орналасқан екі немесе одан да көп п байланыс (л, л- қабысу) пен көршілес атомның р-орбиталі мен я-байланыс (р, л-қабысу) арасында түзіледі.
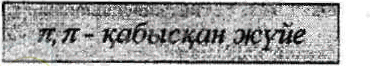

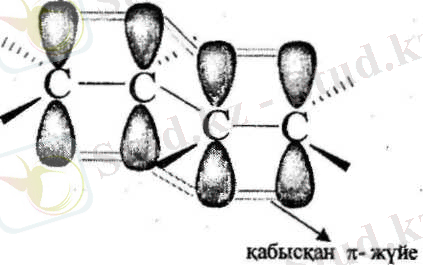
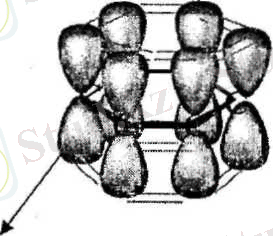
Бутадиен-1, 3 мен бензол молекуласындағы қабысқан жүйенің түзілуі
р, тс- Қабысқан жүйе р - элементтің бөлінбеген электрон жүбы мен қос немесе үш байланьістың л- электрон бұлтарьшың қабысуы нәтижесінде түзіледі.
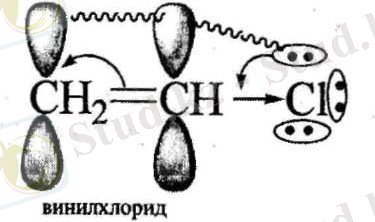
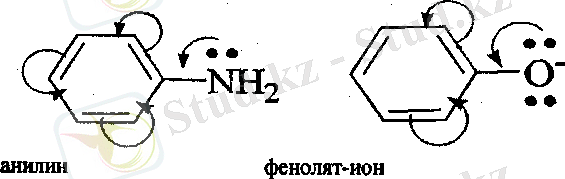
Мезомерлі эффект М әріпімен белгіленеді. Индуктивті эффект сияқгы мезомерлі эффект оң және теріс болуы мүмкін.
Қабысқан жүйенің электрон бүлтының тығыздығын кемітетін орынбасарлар -М- эффект көрсетіп, электроноакцепторлар болады, ал қабысқан жүйенің электрон бүлтының тығыздығын арттыратын орынбасарлар +М -эффект көрсетіп, электронодонорлар болады.

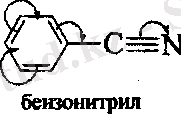
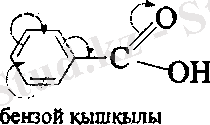
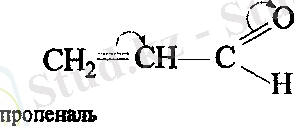

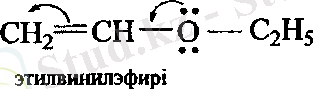

АТОМДАРДЫҢ ӨЗАРА ӘСЕРІ.
Қосылыстардың әрекеттесу қабылеттері молекуладағы электрон бұлтының бөліну сипатына байланысты болады. Электрон тығыздығының бірдей бөлінбеуі орынбасушылардың индуктивтік және мезомерлік әсерлерінің салдары болып табылады.
Орынбасушылардың электрондық әсерлерінің - байланыстардың бойымен берілуі индуктивтік әсер ( I ) деп аталады. Орынбасушылардың индуктивтік әсерінің бағыты сутегі атомының әсерімен ( I = 0 ) салыстыру арқылы анықталады.
R - CH 2 - X R - CH 2 - H R - CH 2 - У
- I I = 0 + I
Егер орынбасушы - байланыстардың электрондық тығыздығын, сутегімен салыстырғанда, өзіне қарай күштірек ығыстыратын болса, теріс индуктивтік әсер ( -I )
көрсетеді. Мұндай орынбасушыларға галогендер, ОН, СООН, СНО, т. б. жатады.
Егер орынбасушы тізбектегі электрон тығыздығын, сутегімен салыстырғанда, жоғарылататын болса, оң индуктивтік әсер ( +I ) көрсетеді. Мұндай әсерді алкилдік топтар жасайды.
Егер индуктивтік әсер электртерістілігі әртүрлі атомдары бар молекулаларда байқалатын болса, ал мезомерлік әсер үшін молекулада қабысқан бөлік болуы керек. Орынбасушылардың әсері - байланыстардың жүйесімен берілетін болғандықтан, мезомерлік әсер қабысу әсері деп те аталады. Орынбасушының өзі қабысқан жүйені түзуге қатысады. Мысалы, бензолдың туындылары.
- X
sp 2
Қабысқан жүйе дара байланыстармен бөлінген еселенген байланысты молекулаларға байланысы бар немесе р электронды жұбы бар орынбасушыларды енгізу арқылы алынады.
Н 2 С = СН - Х
sp 2
Еселенген байланыстың орбитальдары мен орынбасушының орбитальдары бүркессе, қабысу, ал р - орбитальдары бүркессе, р, - қабысу жүреді. Пайда болған ортақ электрон бұлты орынбасушының әсерінен бірдей бөлінбейді.
Орынбасушылардың электрондық әсерлерінің қабысқан жүйенің бойымен берілуі мезомерлік әсер ( M ) деп аталады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz