Ароматты қосылыстар: бензолдың құрылысы, резонанс және Хюккель ережесі


АРОМАТТЫ ҚОСЫЛЫСТАР
Органикалық қосылыстардың жіктелуін білеміз. Сол жіктелуін ықшамдап, барлық органикалық қосылыстарды екі үлкен класс қосылыстарына бөліп, өзара салыстыруға болар еді: алифатты және ароматты қосылыстар.
Алифатты қосылыстарға ашық тізбекті органикалық қосылыстар және соларға ұқсас тұйық тізбекті қосылыстар жатады. Осы уақытқа дейін өткен класс қосылыстар - алқандар, алкендер, алкадиендер және оларға ұқсас тұйық тізбекті (алициклді) қосылыстар, барлығы алифат қосылыстарының класы болып есептеледі.
Ароматты қосылыстарға бензол және химиялық қасиеті жөнінен оған өте ұқсас қосылыстар жатады. Ароматты қосылысқа жататын бензолға, алифат көмірсутектерімен салыстырғанда, ерекше қасиет тән.
Тұйық тізбекті қосылыстардың карбоциклді және гетероциклді болып жіктелетіндігі туралы білеміз. Енді сол карбоциклді қосылыстың өзі алициклді және ароматты деп жіктелетінінде білеміз. Олай болса, неге карбоциклді тұйық тізбекті екі қосылысты бөлек жіктеп, ароматты қосылыстардың өз алдына бөлек ерекше қосылыстар болып бөлінуінің себебі неде?
Жалпы формуласы С п Н 2п -ге сәйкес алициклді көмірсутектер-қаныққан тұйық тізбекті алифат көмірсутектері, мысалы циклогексан-С 6 Н, 1 2) ал аромат көмірсутегінің жай өнім бензол (С 6 Н 6 ), жалпы формуласы С П Н П . Құрамына қарап, қанықпаған қосылыс екенін көріп отырмыз.
Алифат қатарындағы қанықпаған көмірсутектерге негізінен қосылу реакциясы (мысалы алкендерге) тән, сондықтан қанықпаған құрамды бензолғада (алкендер сияқты қосылу реакциясы мүмкін деп қарауға болады) .
Мысалы алкендерге бром суымен (СС1 4 -тің) қатысуымен әрекеттесе, реакция өте тез жүріп, бром тез қосылу реакциясына түседі, оны бром суының түссізденгендігі дәлелдейді, ал бензол (құрамы С 6 Н 6 ) белгілі катализатордың қатысуысыз броммей әрекеттеспейді. Броммен белгілі жағдайда әрекеттескенде де өнім - қосылу өнімі емес, орынбасу реакциясының өнімі, яғни, бензол негізінен ионды орынбасу реакциясына түседі (алифат қатарында орынбасу реакцcясы негізінен бос радикалды механизммен жүреді) .
Сонымен, бензолдың және оның туындыларының құрамының жоғары дәрежеде қанықпаған болуына қарамастан бромға және тағы басқа электрофилдерге тұрақтылығы (қанықпаған қосылыстар алкендерге қарағанда), қосылу реакциясының орнына орынбасу реакциясына жеңілірек түсуі-аромат көмірсутектерінің ерекше қасиеттерінің бірі. Ерекше қасиет тек бензолда ғана емес, оның функционалды туындыларында да (алифат қатарындағы ұқсас функционалды туындыларымен салыстырғанда) кездеседі. Осындай ерекшеліктері аромат көмірсутектерінің бөлек класс қосылысы болып бөлінуіне себеп болған.
Ароматты деген түсінік қалай пайда болған?
Ертеректе хал-жағдайы бай тұратын адамдар денелерін майлау үшін қош иісті май, сұйықтықтарды пайдаланған. Сол қош иісті заттардың біреуі ванилин. Ванилиннің құрамында бензол сақинасы бар.
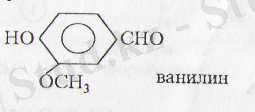
1825 ж. Майкл Фарадей қош иісті зат алған, алынған заттың құрамы-С 6 Н б . Фарадейден кейін көп ұзамай Э. Митчерлих-тс құрамы С б Н 6 -затты бензоин қышқылын ыдыратып алған, алған затты ол "бензин" деп атаған. Сол затты қазір бензол деп атаймыз. Қош иісті заттардың көпшілігінің құрамында бензол болғандықтан, бензолды және оның туындыларын аромат көмірсутектері деп атаған. Соңғы кезде құрамында бензол сақинасы бар жағымсыз иісті қосылыстарда кездеседі, бірақ ароматты қосылыстар деген ат бүгінгі күнге дейін сақталған.
Қазіргі кезде ароматты қосылыстар деп иісіне қарай бағаламайды, ароматтылық деп кейбір қанықпаған, тұйық тізбекті қосылыстардың қосылу реакциясынан гөрі орынбасу реакциясына жеңіл түсіп, тотықтырғыштарға шыдамды, тұрақты қосылыстарды атайды.
Жоғарыда көрсетілгендей, бензол 1825 ж. ашылған, элементті талдау және молекулалық салмағын анықтау оның құрамының 6 көміртек 6 сутек аталдарынан құралғандығын анықтаған, физикалық және химиялық қасиеттері терең зерттелген. Бірақ сол 6 көміртек және 6 сутек молекулада қалай байланысқандығы ұзақ уақыт белгісіз қалған. Тек 1831 жылдан бастап құрлысы туралы әртүрлі көзқарастар айтыла басталған. Сол ор түрлі көзқарастардың айтысы 30 жылдай уақытқа созылған. Құрылысын анықтаудағы ұзаққа созылған қиыншылық бензол молекуласының күрделігінде емес, сол кезге сай келген құрылыс теориясының шектелуімен байланысты. Ұзаққа созылған құрылысы туралы әртүрлі көзқарастар таласының ішіндегі осы мәселені шешудегі дұрыс көзқараспен үлкен үлес қосқан Август Кекуле (Бонн уииверситеті) .
1858 ж. А. Кекуле 6 көміртек өзара байланысын тізбек түзеді деген болжау айтты, ал 1865 ж. бензолдың құрлысын толық сипаттайды. Онда сол 6 көміртек атомы тұйықталып сақина түзеді деді және әр көміртек атомы бір сутегімен байланысады; енді көмір атомының төрт валентілігін көрсету үшін-үш қос байланыс енгізген.
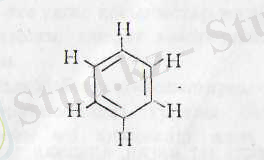
Бірақ Кекуле бензол молекуласын динамикалық түзілу деп қарады. Оған себеп болған, осы жұмысын жазып жүрген күндері бір күн ұйықтағанда көз алдына атомдар секіріп, ұзын тізбек қысқарып, топтанып, молекула айналып, бұралып тұрғандай көрінген, сол себепті-ол бензол құрлысын тепе-теңдіктегі 1, 3, 5-циклогексатриеннің екі альтериативті құрлысы деп қаранды (А, Б) .
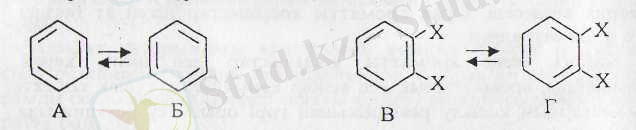
Олай болса, көрші атомдарға орналасқан екі орынбасары бар молекула бір-біріне тез өтіп тепе-теңдікте тұрған (В және Г) молекулалар, сол себепті әр қайсысының бөлек ала алмайтын, яғни екеуі изомерлі, бірақ изомерлі қосылыстар бөлек түзілмейді деп қарайды. Бұл болжауы оның қателігі еді, себебі мұндай изомерлер жұбы кездескен емес. Бұған қосымша, екі молекуланың арасындағы қасиетінің өзгертуі мүмкін емес, сондықтан тепе-теңдік бола тұрсада әр молекула 1, 3, 5-циклогексатриенге тән реакция беруі керек еді, бірақ зерттеу нәтижесінде алкендерге тән (1, 3, 5-циклогексатриен молекуласындағы қос байланыс) реакция байқалмаған, керісінше, бромға инерттілігі бензол құрамында алкенге тән қос бйланыстың жоқ екенін айқындайды. Олай болса бұл-1, 3, 5~циклогсксатриен емес.
Кекуле формуласы әрі қарай Коулеен, Ингольд, Полинг және Вейланд сияқты күшті теоритиктердің ұсыныстарымен толықтырылып, зерттелім, бензолдың циклогексатриен еместігі дәлелденген.
Кейінірек, Кекуле формуласының негізінен (егер кейбір қателіктерін ескермесек) дұрыс екендігі дәлелденген. Тәжірибе жүзінде анықталған С 6 Н 6 формулаға бес түрлі құрылыс жазуға болады:
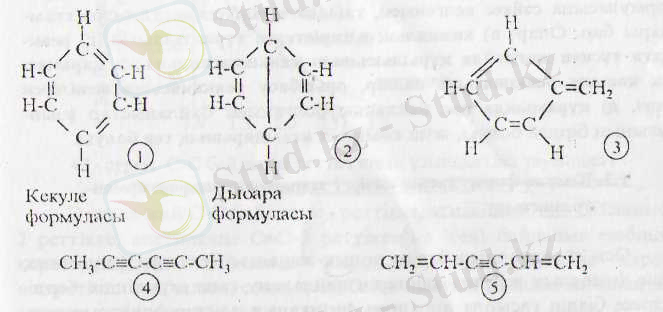
а) Тәжрибе жүзінде бензолдық монотуындысының (С 6 Н 5 Х) тек бір өнім болатындығы анықталған. Олай болса, осы бес изомердің қайсысы бензол құрлысына сай келетіндігін қарасақ, монотуындыда бір изомер алу үшін әр сутегі «өзара тең болуы керек, олай болмаса кез келген бір сутектің орынбасарға алмасуы бір изомер бермейді. Осы тұрғыдан қарағанда 5 Ші құрлыс дұрыс емес, бензол құрлысын анықтамайды, себебі сутек атомдары тең емес, екіншілік және үшіншілік сутек атомдары болғандықтан, ол қосылысты монобромдасақ екі изомерлі бром туындысын (1-бром және 2-бром туындыларын) аламыз, сол сияқты 2 және 3 құрылыстарда сәйкес келмейді, олай болса, біздің талапқа сәйкес келетін 1 және 2 құрылыстар. Енді осы екеуінің қайсысы дұрыс екендігін дәлелдеу үшін бензолдың тағы бір тәжрибе жүзінде анықталған көрсеткішін қараймыз, ол - б) бензолдың диорыналмасқан туындысына (С 6 Н 4 Х 2 ) үш номер сәйкес келеді.
Бұл тұрғыдан қарағанда үш изомерді тек 1 құрылыс береді. Міне, осылай Кекуле формуласының дұрыстығы дәлелденген.
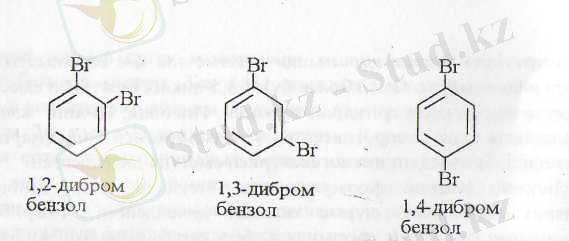
Сонымен, жоғарыда көрсетілген екі сипаттамасы (а, б) Кекуле формуласына сәйкес келгенмен, тағыда түсініксіз қалған сипаттамалары бар. Олар: в) химиялық өзгерістерге тұрақтылығы, г) реакцияға түскен жағдайда құрылысының қанықпағандығына қарамастан қосылу реакциясына нашар, орынбасу реакциясына жеңілірек түсуі, д) құрамында қос байланыс болғанмен байланыстар ұзындығының бірдей болуы, яғни көміртек атомдарының тең болуы.
Осы сұрақтардың бәріне толық жауапты бензолға физикалық және химиялық зерттеу әдістерін пайдалану ғана мүмкіндік берді. Әсіресе біздің ғасырда ашылған физикалық әдістер-фрактометрия, диполь моменттерін анықтау, магниттік қасиеттерді, ультракүлгін және инфрақызыл спектрлерін, құрастырмалы бытырау спектрін, рентгенограммалар мен электронограммаларды, термодинамикалық қасиеттерді зерттеу пайдаланылды. Енді әр сипаттамасын бөлек қарайық.
1. Ерекше маңызды деректер бензол мен оның туындыларының рентгено- және электронограммаларын зерттеу арқылы алынды. Бензол молекуласы бүтіндей жазықтық күйінде екені анықталды. Сондықтан, бензол сақинасы мен оның жазықтық конфигурациясы толық симметриялы деген қортындыға әкеледі. Олай болса молекуладағы барлық көміртек атомдарының ара қашықтығы бірдей. Байланыс ұзындығы жөнінен алқандағы жай немесс алкендегі қос байланыстарға ұқсамайды. Рентген-структуралық талдаудың көрсетуі бойынша С-С байланыстар өзара тең және 0, 140 нм-ге тең.
2. Бензолды қосарланған жүйелерге тән молекулалық рефракцияның экзальтациясы байқалмайды.
3. Бензол молекуласы полюсті емес және магниттік тұрғыдан толық симметриялы. Ол тәжрибе жүзінде дәлелденген.
Бензолдың алтыншы реттік симметриялық өсі бар. Сондықтан ондағы ядролар мен электрондар симметриялы орналасады.
Ароматты қосылыстардағы жеке байланыстарды сипаттау үшін "байланыс реттігі" немесе "байланыс еселігі" деген ұғымды жиі қолданады. Байланыс реттігі бір мен үштің арасында өзгере алады.
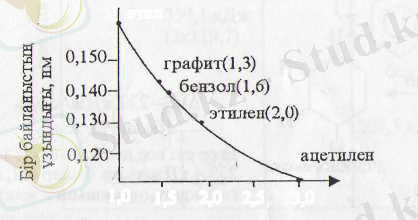
С-С байланыс реттігі оның ұзындығына тәуелділігі
Этанда жай С-С байланыс - реттікке, этиленде С=С- байланыс-2 реттікке, ацетиленде С=С-3 реттікке ие (тең) байланыс есебінде қарастырылады. Байланыс ұзындығы оның реттігіне қарай өзгеретіндігі табылды, сондықтан байланыстың ұзындығын анықтау арқылы оның реттігін өлшеуге болады.
4. Бензол үшін термодинамикалық деректердің де үлкен маңызы бар. Бензолдың термодинамикалық тұрақтылығы, оның формуласына сай болжау тұрақтылығынан гөрі жоғарырақ. Мұны қалай түсінуге болады және қалай анықтаған?
Кекуле ұсынған формула бойынша бензолды циклогексатриен деп қарауға болады. Олай болса, алкендерге тән қосылу реакциясы жүреді деп қарауға болады. Шынында алкендерге тән жеңіл жүретін реакция бензолға жүрмейді, ал жүрсе өте баяу, қатаң жағдайда жүреді. Бұл бензолдың тұрақтылығын, оның ішінде кинетикалық тұрақтылығын көрсетеді. Оның басқа, оның термодинамикалық тұрақтылығын көрсетуге болады. Термодинамикалық тұрақтылығын анықтау үшін бензолды гидрлеу және жану жылулығын анықтаған.
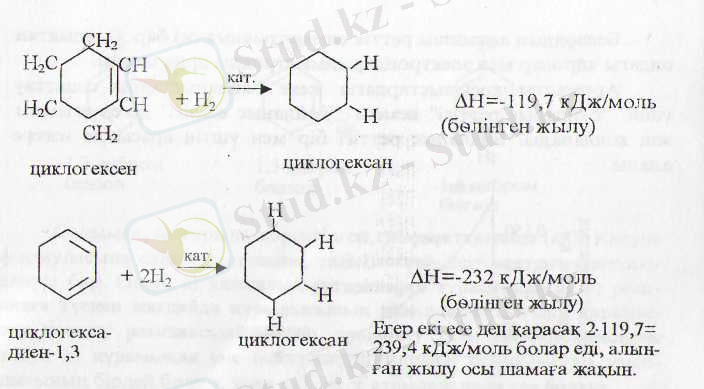
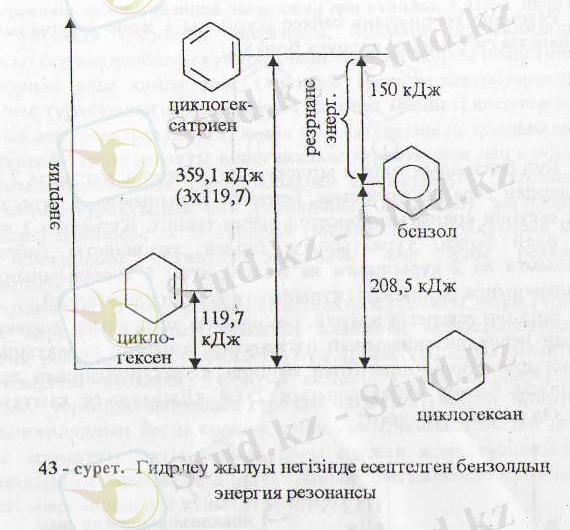
Гидрлеу жылуы деп 1 моль қанықпаған қосылысты гидрлегенде бөлінген жылуды айтады. Бұл жылу 117-125 к/Дж/моль (әр қос байланысқа) болады. Осы тұрғыдан қарап, циклогексенді гидрлегенде 119, 7 кДж/моль, циклогексадиенді гидрлегенде 232 кДж/моль жылу бөлінген:
Ал бензолды циклогексатриен деп қарасақ бастапқы 119, 7 кДж/моль жылу үш есслену керек, ал тәжрибе жүзінде 208, 5 кДж/ моль жылу бөлінген:
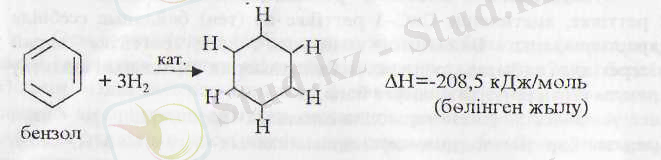
Егер циклогексатриен десек, онда бөлінетін жылу 3-119, 7=-359, 1 кДж/моль бөлу керек еді.
Сонымен, бензолды циклогексатриен деп қарасақ, оның үш қос байланысын толық гидрлегенде 359, 1 кДж/моль жылу бөлу керек еді, ал бөлінген жылу (тәжрибе жүзінде) барлығы 208, 5 кДж/моль. Сонда екеуінің айырмашылығы 150 кДж/моль, бұл сан бензолдың осындай энергияға тұрақтырақ (циклогексатриенмен салыстырғанда) екенін айқындайды. Осы энергияны резонанс энергиясы деп атайды. Бензолдың жану жылуының энергиясы да осы шама.
Неге резонанс энергиясы деп аталады? Оны түсіну үшін резонанс теориясын қарайық.
Кекуле ұсынған формула өзінің кейбір кемеліне жетпегендігіне қарамастан 1945 ж. дейін қолданылған. Ол формуланың орнына ұсынылған құрылым (структура) бензол құрлысына жаңалық енгізілгендіктен емес, а кейбір құрылым теориясына тұр өзгерістер енгізуінің салдары еді.
Резонанс теориясы тұрғысынан бензол құрылымын қарасақ:
а) Екі немесе онан көп құрылымдардың (структуралар) атом ядроларының орналасуы бірдей, ал айырмашылығы тек электрон бұлтының әртүрлі бөлінуіне байланысты болған жағдайда олар резонансты болуы мүмкін. Ондай жағдайда молекула осы құрылымдардың гибриді болады және ешқайсысы толық молекуланы сипаттай алмайды, тек әр қайсысы сол гибридке өз үлесін қосады.
б) Егер резонансқа қатысқан құрылымдар тұрақтылығы жөнінен жақын болса (яғни энергия саны шамамен бірдей болса), ондай жағдайда сезілетіндей резонанс болады. Әр құрылымның гибридке қосатын үлесі сол құрылымның салыстырмалы тұрақтылығына тәуелді: неғұрлым құрылым тұрақты болса, сол ғұрлым оның үлесі көп.
в) Резонансқа қатысатын құрылымдардың қай-қайсысымен де салыстырғанда резонансты гибрид тұрақтырақ. Осылай тұрақтылықтың өсуін резоиансты эиергня деп атайды. Резонансқа қатысатын құрылымдардың тұрақтылығы неғұрлым бір-бірімен жақын болса, солғұрлым резонансты энергиясы көп.
Резонанс теориясына сәйкес бензолды 1 және 2 құрылымның резонансты гибриді деп қарауға болады:
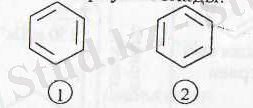
Бұл бензолдың жарты молекуласы 1, екінші жартысы 2 құры-лымдардан тұрады деген емес, бензол 1 құрылымда, 2 құрылымда емес, екеуінің аралығын көрсетеді деген түсінік. Құрылым I және 2 тең, олай болса, тұрақтылығы бірдей, резонансты гибрид 1 құрылымға да 2 құрылымға да жақын, яғни 1 құрылымныңда, 2-құрылымныңда резонансты құрылымға қосқан үлесі бірдей.
Енді бір ескеретін жағдай, резонансты энергиямен я-электрон-дардың делокализациясының нәтижесінде алынған тұрақтылықпен шатыстыруға болмайды. Шын мәнінде,
 -электрондардың делокализациясы бензол тұрақтылығын 251, 4 кДж/моль-ге қамтамасыз етеді. Ол қайдан құралған?
-электрондардың делокализациясы бензол тұрақтылығын 251, 4 кДж/моль-ге қамтамасыз етеді. Ол қайдан құралған?
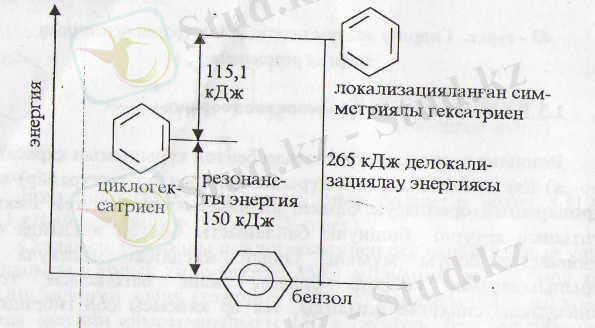
1, 3, 5-циклогексатриенді
 -электрондары делокализацияланбаған қосылыстарға айналдыру үшін де энергия қажет, ол энергия -резонанс энергиясы+1, 3, 5 - циклогексатриеннің байланыстары өзгеріп (деформация-ланып) симметриялы молекулаға өтуге қажет энергия. Есептеп табылған бұл энергияның шамасы 115, 1 кДж/моль. Олай болса, олардың қосындысы 115, 1 +150=265, 1 кДж/моль, яғни электрондары делокализация-ланған түрдегі қосылыстардан, электрондары делокализацйяланған түрге өткенде босағаны энергия 265, 1 кДж/моль.
-электрондары делокализацияланбаған қосылыстарға айналдыру үшін де энергия қажет, ол энергия -резонанс энергиясы+1, 3, 5 - циклогексатриеннің байланыстары өзгеріп (деформация-ланып) симметриялы молекулаға өтуге қажет энергия. Есептеп табылған бұл энергияның шамасы 115, 1 кДж/моль. Олай болса, олардың қосындысы 115, 1 +150=265, 1 кДж/моль, яғни электрондары делокализация-ланған түрдегі қосылыстардан, электрондары делокализацйяланған түрге өткенде босағаны энергия 265, 1 кДж/моль.
Осы энергияны делокализация энергиясы деп атайды. Қайсы энергия туралы айтсақта (резонанс энергиясы, болмаса делокализация энергиясы) бензол қозбаған күйінде оның энергия запасы өзіне тиісті энергиясынан әлде қайда кем. Осындай тұрақтылықты-термодинамикалық тұрақтылығы дейді. Тұрақты деген түсінікті қосылыстың химиялық өзгеріске (реакцияға) жеңіл түсу қабілетіне де қолданады.
Мұндай тұрақтылықты кинетикалық тұрақтылық деп атайды. Оны термодинамикалық тұрақтылықпен шатыстыруға болмайды. Кинетикалық тұрақтылық сол реакцияның активтелу мөлшеріне (дәрежесіне) байланысты. Неғұрлым кинетикалық тұрақтылық көп болса, солғұрлым активтеу энергиясы көп және реакция жылдамдығы аз.
"Ароматты" деген түсінікті кинетикалық тұрақты деген тұрғыдан да қарауға болады. Мысалы, алкенмен салыстырғандағы химиялық реакцияа түсу қабілеті. Бұл ароматтылықты анықтаудағы ескірген көзқарас. Соңғы кездегі қанағаттандырарлық анықтама - термодмиамикалық тұрақтылыққа негізделген. Жоғары да айтылғандардың бәрін қорыта келіп тұжырымдаса былай деуге болады: ароматтылықты аңықтаудағы ең жай және түсініктісі-
 -электрондардың делокализациялануының нәтижесінде қозбаған күйіндегі энергияның өте күшті төмендеуі.
-электрондардың делокализациялануының нәтижесінде қозбаған күйіндегі энергияның өте күшті төмендеуі.
Бензол құрылысындағы және қасисттеріндегі барлық ерекшеліктерін бензол молекуласындағы көміртек атомын электрондық және квант-химия теориясы тұрғысынан қарау арқылы былай түсіндіруге болады:
Бензол құрамындағы әр көміртек атомы басқа үш атоммен а-байланыс түзу үшіп sр 2 -гибридтелген орбиталды пайдаланған (этилен көмірсутегіндегі сияқты) . Бұл орбиталдар бір жазықтықта орналасқан, яғни көміртек ядросының жазықтығында және тең бүйірлі ұшбұрыштың бұрыштарына бағытталған, бағыталған бұрышы-120 0 .
Сонымен бензол құрылысы барлық көміртек жене сутек атто-мдары бір жазықтықта орналасқан жазық молекула. Олай болса, көміртек атомдары дұрыс алты бұрыштың төбесін орналасқан, әр бұрыш 120°-қа тең, бұл молекуланың симметриялығын көрсетеді. Бірақ осымен бензол молекуласын сипаттау аяқталмайды. Гибридизациядан тыс қалған әр көміртек атомының р-төртінші электроны-алты р-орбиталь бар. Олар қалай орналасқан. Олар молекула жазықтығына перпендикуляр орналасқан. Сонда гантель тәрізді р-орбитальдің бір бөлігі молекула жазықтығының үстіне, бір-бөлігі астына орналасқан. Этилен молекуласының құрылысынан белгілі жағдай, бір көміртек атомының р-электроны көрші көміртек атом-ының р-электронымен жұптасуының нәтижесінде р-орбиталдары бүркесіп, қосымша
 -байланысын түзетін. Ал бензол молекуласында әр көміртек атомының р-орбиталі екі жағындағы) көрші көміртек атомдарының р-орбитальдарымен бүркесіп, молекула жазықтығының үстінде және астында тұтас электрон бүлтын түзеді:
-байланысын түзетін. Ал бензол молекуласында әр көміртек атомының р-орбиталі екі жағындағы) көрші көміртек атомдарының р-орбитальдарымен бүркесіп, молекула жазықтығының үстінде және астында тұтас электрон бүлтын түзеді:
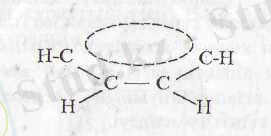
Мұның себебі: р-электрон бір көміртек атомымен байланысқан емес, алты р-орбиталь өзара параллель орналасқандықтан, олар бір-біріне өтіп жылжып отырады, яғни делокализацияланады. Делокализациялану бірінші немесе екінші бағытта электрон бұлтының ығысып жылжуы арқылы екіден көп ядроны (бірнеше ядроны) байланыстырды.
 - электрон бұлтының делокализациялануы бензол молекуласына көп ерекшеліктер енгізеді: 1)
- электрон бұлтының делокализациялануы бензол молекуласына көп ерекшеліктер енгізеді: 1)
 -қосарлану эффектісіне әкеледі, 2) мықтырақ байланыс түзеді жане молекуланың тұрақтылығын өсіреді. Молекуланың тұрақтылығының өсуі делоклизациялану нәтижесімен түсіндірілетін термодинамикалық энергия (бұл туралы толық мәлімдеме жоғарыда берілді) .
-қосарлану эффектісіне әкеледі, 2) мықтырақ байланыс түзеді жане молекуланың тұрақтылығын өсіреді. Молекуланың тұрақтылығының өсуі делоклизациялану нәтижесімен түсіндірілетін термодинамикалық энергия (бұл туралы толық мәлімдеме жоғарыда берілді) .
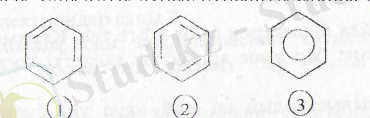
Кекуле ұсынған формула 1 және 2 құрылымның рсзонансгы гибриді екеиін жоғарыда қарағанбыз, бұл туралы резонанс энергия-сын түсіндіргендс де қарағанбыз. Ал бензолды бейнелеуде еің ыңғайлысы, оны алты дүрыс бұрышты сақина деи қараймыз 3.
Құрылым 3-тегі түзу сызық көміртек атомдарын баиланыстырып тұрған
 -байланыс. Ал бұл 3 құрылым 2 және 3 құрылымдардың
-байланыс. Ал бұл 3 құрылым 2 және 3 құрылымдардың
резонансты гибриді болып келеді, сондықтан сақина ішіндегі дөңгелек делокализацияланған 6 электронның бұлтын көрсетеді. Әрі қарай Кекуле формуласын (1 және 2) немесе 3 формуланы да қолданамыз.
Ароматты қосылыстардың өз алдына жеке ерекше қосылыстар болып бөлінуінің себебі олардың ерекше құрылысына сәйкес ерекше қасиеттерімен түсіндірілетіні туралы айтқанбыз. Осы ерекше қасиеттерін ароматты қасиет деп атаған.
Ароматты қосылыстардың ең жәй өкілі бензол. Бензолдың ерекше құрылысы оған ерекше қасиет береді: сақинадағы делокализацияланған р-орбиталдар молекулаға тұрақтылық беруінің нәтижесінде, бензол қосылу реакциясынан гөрі (молекула құрамының қанықпағандығына қарамастан) орынбасу реакциясына бейімділігі туралы айттық. Осыған байланысты, қосылыс ароматтық қасиет қөрсету үшін молекула құрамында міндетті түрде бензол сақинасы болу керек пе, жоқ па? деген сұрақ туады. Осы сұраққа жауап беру үшін 1931 ж. оқымысты Эрих Хюккель (теориялық физика ин-ституты, Штуттгарт), квант-механикалық теория негізінде есептеу нәтижесінде мынадай қорытындыға келеді: Кез-келген қанықпаған тұйық тізбекті қосылыс ароматтық қасиет көрсете алады, егер мынадай шартқа сәйкес келсе:
1 . Қанықпаған тұйық тізбекті қосылыс.
2 Тұйық тізбекті құрайтын көміртек атомдары sр 2 -гибридтік күйде және тұйық тізбекті қосылыс-жазық құрылысты.
З. Молекула құрамындағы
 -электрондар саны-4n+2. "n"-кез-келген бүтін сан-0, 1, 2, 3 т. т.
-электрондар саны-4n+2. "n"-кез-келген бүтін сан-0, 1, 2, 3 т. т.
Егер n =0 болса,
 =4-0+2=2 болады, n =1, онда
=4-0+2=2 болады, n =1, онда
 -саны-6, ал n =2 болса
-саны-6, ал n =2 болса
 -электрондар саны-10 т. т.
-электрондар саны-10 т. т.
 -электрондардың, 4 n +2 бойынша анықталған саның Хюккель саны деп аталған, олар-2, 6, 10, 14 т. т. .
-электрондардың, 4 n +2 бойынша анықталған саның Хюккель саны деп аталған, олар-2, 6, 10, 14 т. т. .
Хюккель ережесінің дұрыстығын дәлелдейтін мысалдар қарайық.
1. n =0 болған жағдайда
 -электрон саны =2-ге тең. Құрамында барлығы 2я-электроны ғана бар және ароматты қасиетті қосылыс бар ма екен сұрақ туады.
-электрон саны =2-ге тең. Құрамында барлығы 2я-электроны ғана бар және ароматты қасиетті қосылыс бар ма екен сұрақ туады.
Тұйық тізбекті қосылыстардың ең жай өкілі үш бұрышты қосылыс-циклопропан. Бірақ Хюккель ережесіне сай-тұйық тізбекті қосылыс қанықпаған болу керек, олай болса, циклопропенді алайық.
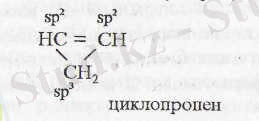
Циклопропен молекуласы Хюккель ережссінің үш шартының екеуіне сәйкес келеді: 1) тұйық тізбек, қанықпаған, 2)
 -электрондар саны екі, бірақ, құрылысы жазық болғанмен, тұйық тізбек құрып отырған үш көміртек атомының біреуі sр
3
-күйде, яғни осы жері Хюккель ережесіне сәйкес келмейді. Сол себепті бұл қосылыста ароматтық қасиет жоқ.
-электрондар саны екі, бірақ, құрылысы жазық болғанмен, тұйық тізбек құрып отырған үш көміртек атомының біреуі sр
3
-күйде, яғни осы жері Хюккель ережесіне сәйкес келмейді. Сол себепті бұл қосылыста ароматтық қасиет жоқ.
Егер осы молекуланың sр 3 -гибридтік күйдегі көміртек атомын sр 2 -гибридтік күйге айналдырсақ, екі ион және бос радикал түзілер еді:.
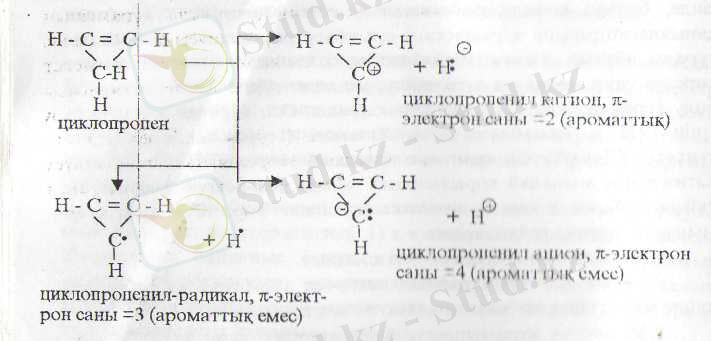
Түзілген екі ионы және бір бос радикалдың біреуі циклопропенил катион, Хюккель ережесінің үш талабына сәйкес келеді:
1. Молекула тұйық тізбекті, қанықпаған,
2. Молекула жазық құрлысты, үш көміртек атомы да sр 2 -гибридтік күйде.
3.
 -электрондар саны 2.
-электрондар саны 2.
Құрамында осы циклопропенил катион бар органикалық қосылыстың ароматтық қасиеті бар екенін тәжрибе жүзінде дәлелдеген.
Д. Н. Курсанов пен М. Е. Вольпин синтездеген дифенилцикло-пропенон циклопропенил системасының туындысы болып табылады:
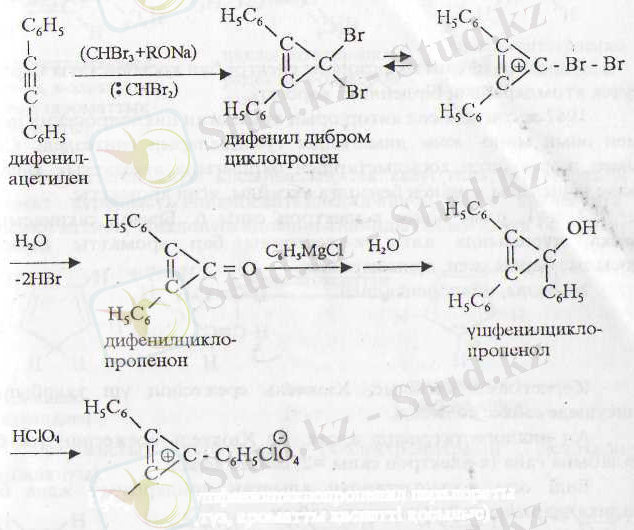
Көрсетілген циклопропенил ионының туындысы (перхлорат тұзы) -сақтағанда тұрақты. Оның құрылымын рентгенқұрылымдық талдау арқылы молекула құрамындағы үш С-С-байланыс ұзындығының бірдей екендігі анықталған, яғни тұйық тізбектегі
 -электрондар күшті көрсетеді:
-электрондар күшті көрсетеді:
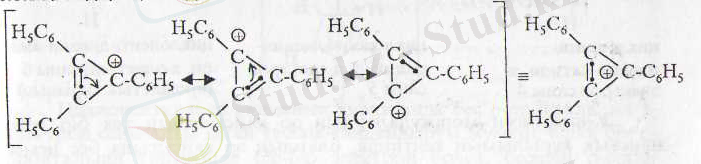
Резонанстың құрылысы
1957 ж. үшфенилпропенилдің борфториді мына схемамен синт-езделген (Бреслоу) :
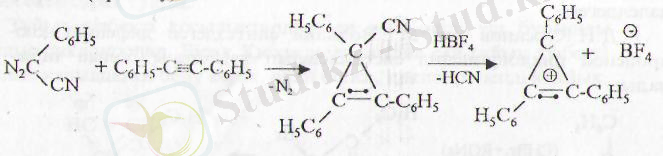
Ядролық магниттік резонанс спектрі бұл қосылыстағы барлық сутек атомдарының бірдейлігін көрсетті.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz