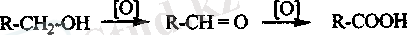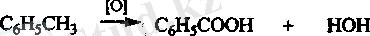Карбон қышқылдары мен олардың туындылары: құрылымы, номенклатурасы және химиялық қасиеттері


Тақырыбы: Карбон қышқылдары және олардың туындылары.
Мақсаты: карбоксил тобының құрылымына негізделе отырып, карбон қышқылдардың реакциялық қабілеттілігін қалыптастыру. Жіктелі, номенклатурасы сол сияқты химиялық қасиеттері жөнінде негізгі ұғымды қалыптастыру.
- Дәріс жоспары:
- Жіктелуі. Номенклатурасы.
- Карбоксил тобының құрылымы, р, π - қабысу.
- Химиялық қасиеттері. Қышқылдық қасиеттері.
- Этерификация реакциясы, оның механизмі. Қышқылдық катализ.
- Декарбоксилдену реакциясы және тотықсыздануы.
- Карбон қышқылдардың функционалдық туындылары: галогенангидридтер, күрделі эфирлер, амидтер, нитрилдер. Алыну әдістері.
- Дикарбон қышқылдары. Қышқылдылығы.
- Ароматты монокарбон қышқылдары және олардың туындылары.
∙ Дәріс тезисі :
КАРБОНҚЫШҚЫЛДАРЫ ЖӘНЕ
ОЛАРДЫҢ ТУЫНДЫЛАРЫ
Құрамында бір немесе бірнеше карбоксил тобы (-СООН) бар органикалық қосылыстарды карбон қышқылдары деп атайды.
Құрамындағы карбоксил тобының санына байланысты карбон қышқылдарын монокарбон, дикарбон және поликарбон қышқылдары болып бөлінеді. Көмірсутек радикалының табиғатына байланысты алифатты, алициклді, ароматты және гетероциклді болып бөлінеді.
Жүйелік номенклатура бойынша карбон қышқылдарының негізгі көмірсутек тізбегі атына қышқыл деген сөзді жалғау арқылы аталады. Карбон қышқылдары үшін тарихи және жүйелік номенклатуралар қатар қолданылады.
Физикалық қасиеттері. Құрамында 1 және 9 көміртегі бар монокарбон қышқьшдары түссіз сұйық затгар. Барлық ароматгы, жоғары алифатты жэне дикарбон қышқылдарының көпшіліктері қатты заттар. Құмырсқа, сірке жэне пропион қышқылдарының күйдіргіш қасиеттері бар, суда жақсы араласады.
Карбон қышқыддарының қайнау температурасы спирттер мен альдегидтерге қарағанда жогары. Қайнау температурасының жоғары болу себебі, карбон қышқылдары сутектік байланысы арқылы ассоциат түзеді.
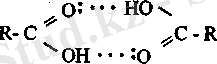
Алыну жолдары.
Органикалық қосылыстарды тотықтыру. Біріншілік спирттвр мен альдегидтер карбон қышқылдарына дейін тотығады (14, 15 тарау) .
Кетондар сутектің асқын тотығымен тотыққанда, оңай гидролизденіп карбон қышқылын түзетін, эфирге айналады.
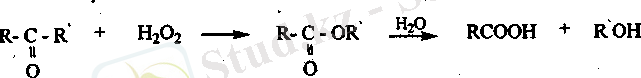
Карбон қышқылдарының функционалдық туындыларының
гидролизі. Сілтілік жэне қьшщыл ортада карбон қьшіқыльшың туындылары гиролизденіп карбон қышқылдарын түзеді.
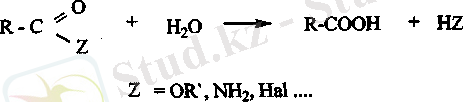
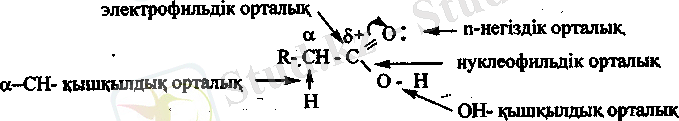
Химиялық қасиеттері. Құрамында полярлы карбоксил тобы болуына қарай карбон қышқылдарының молекуласында бірнеше белсенді реакциялық орталықтар бар.
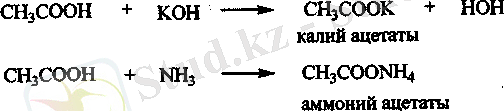
Тр түзуі. Спиттер мен фенолдарға қарағанда карбон қышқылдарының қышқылдық қасиеті жоғары. Негіздермен әрекетгескенде карбон қышқылдары тұз түзеді.
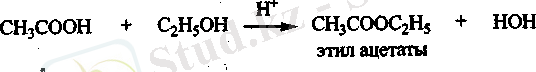
Этерификация реакциясы. Спирттермен карбон қышқылдары
қышқылдық ортада нуклеофильдік қасиет көрсетіп, күрделі эфир түзеді.
Галогендену реакциялары. Карбон қышқылдарына фосфор
галогенидтерімен әсер еткенде галогенангидридтер түзіледі.
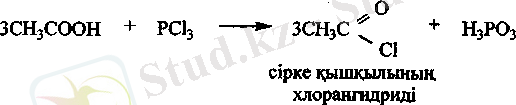
Карбон қышқылдарының радикалдарындағы сутек атомдары реакцияға түсу қабілеті жағынан негізінен алкавдардағы сутек атомдары сияқты қасиет көрсетеді, тек а-көміртегіндегі сутек хлормен, броммен әрекеттескенде орын басу реакциясына қатысады.

Карбон қышқылдарының сусыз тры мен галоген ангидридтерін қосып қыздырғанда қышқылдардыц ангидридтері түзіледі.
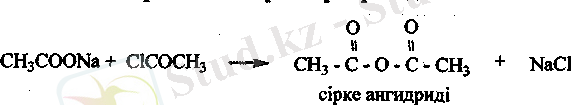
Сілтілік металл тұздарының пиролизі. Карбон қышқылдарының сілтілік металмен түзілген түдцарын сілтілік ортада балқытқанда, декарбоксилдену реакциясы жүріп, метан түзіледі.
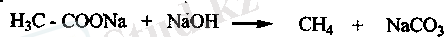
Тотығу реакциялары. Бір негізді карбон қышқылдары тотықпайды, тек құмырсқа қышқылы (С0 2 жэне Н 2 0 дейін) мен а-көміртегі бар үшіншілік көміртекті карбон қышқылы ғана тотығады.

Қант диабетшен ауыратын науқастар организмінде май қышқылы оттегімен Р-оксимай қышқылына дейін тотығып кетеді.
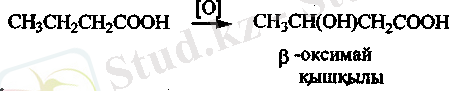
0-оксимай қышқылы әрі қарай тотығу барысында ацетосірке қышқылына айналады.
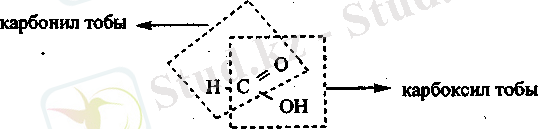
Қріырсқа қышқылы - жагымсыз дәмі бар, өткір иісті, түссіз сұйықтық. Қүмырсқа қышқылыньщ басқа карбон қышқылдарына қарағанда өзгеше ерекшелігі бар. Қүрылымдық формуласында екі функционалдық топ бар, яғни құмырсқа қышқылына альдегидтердің де, карбон қышқылдарының да қасиеттері тән.
Сірке қышқылы - СН 3 СООН өткір иісті, теріге тисе күйдіретін, түссіз сұйықтық. 16, 6 °С да қата бастайды, сол себептен «мүдцы» сірке қышқылы деп атайды. Сірке қышқылы табиғатта кең таралған, бос күйінде адам организмінде (зәрде, теріде) кездсетін қосылыс. Сірке қышқылының түзы ацетаттар деп аталады. Сірке қышқылын маринад жасауға, көкөнестер мен саңырауқүлақ консервілеуге, дәрі-дэрмек жасауға, т. б. қолданылады.
16. 2. Карбон қышқылдарының функционалдық туындылары
Карбон қышқылдарының күрделі эфирлері. Күрделі эфирлерді карбон қышқылдары мен спирттерді қышқылдық ортада әрекетгестіру арқылы синтездейді.
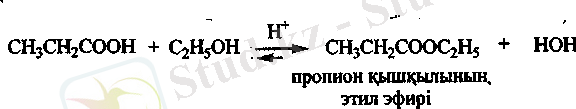
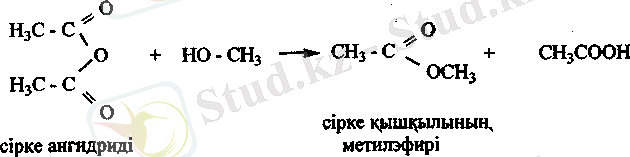
Спиртгер ангидридтерменде оңай эрекеттесіп күрделі эфир түзеді.
Карбон қышқылдарыныц галогенангидридтері. Карбон қышқылдары фосфор галогенидтерімен немесе хлорлы тионилмен эрекеттескенде галогенангидридтер түзеді.

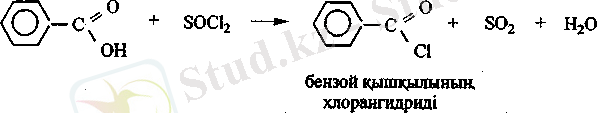
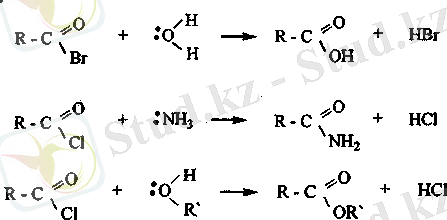
C-Hal байланысының күшті полюсті болуына байланысты галогенангидридтер нуклеофилді реагентгермен әрекеттеседі.
Карбон қышқылдарының ангидридтері. Карбон қышқылдарының галогенангидридтері мен трдарының әрекеттесу нэтижесінде ангидридтер түзіледі.
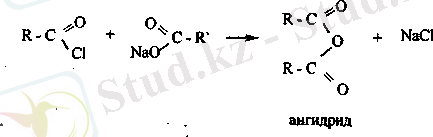
С-0 байланысы да күшті полюсті болуына байланысты ангидридтерде нуклеофилді реагенттермен белсенді әрекеттеседі.
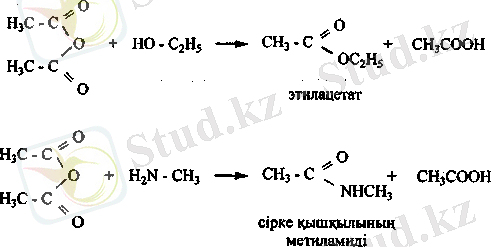
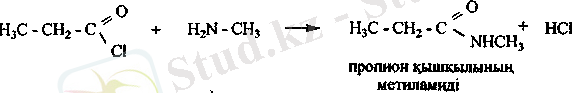
Карбон қышқылдарының амидтері. Аммиакқа немесе ациламиндерге карбон қышқылдарының эфирлері мен хлорангидридтері әрекеттескенде амидтер түзіледі.
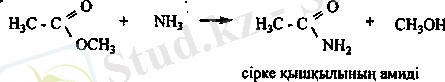
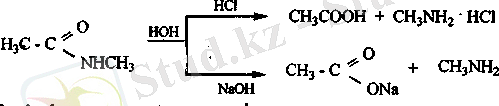
Қышқыл және сілтілік ортада судың эсерінен амидтер гидролизге ұшырайды.
Амидтердің ішінде адам организмінде маңызды орын алатыны -мочевина. Мочевина - көмір қышқылының диамиді. Организмдегі азотты қосылыстар метаболизмінің соңғы өнімі. Зәрмен тэулігіне 25-30 грамм мочевина бөлінеді. Карбон қышқылдарының құрамында мочевинаның қалдығы бар туындыларына уреидтер жатады. Циклді уреидтер - барбитураттар дэрілік препараттар ретінде кеңінен таралған.
Нитрилдер. Синил қышқылының трдарын алкилгалогенидтермен нитрилдер түзіледі.

Нитрилдердің маңызды реакцияларының бірі -гидролизденуі. Гидролиз реакциясы нәтижесінде карбон қышқылдары түзіледі.
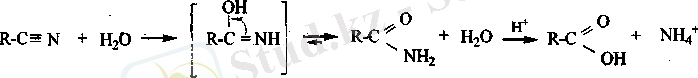
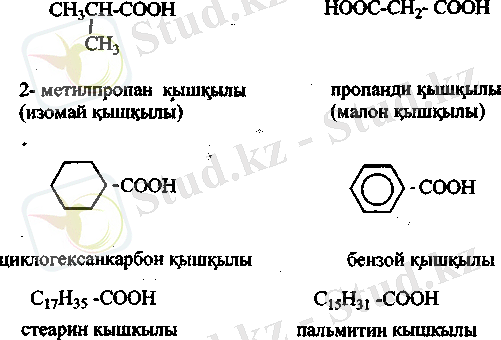
Дикарбон қышқылдары. Қаныққан екі негізді карбон қышқылдарының жалпы формуласы С п Н2 П (СООН) 2.
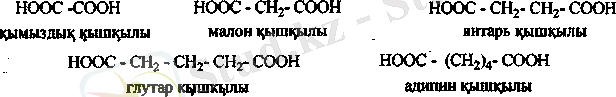
Қымыздық және малон қышқылдарын қыздырғанда СОг оңай бөлінеді.
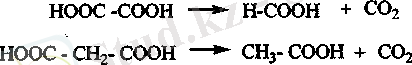
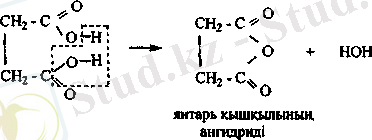
Құрамында төрт немесе бес көміртегі бар дикарбон қышқылдарын қыздарғавда су бөлініп, ішкі цикдці ангидридтер түзіледі.
Ароматты қышқылдар. Бензой қышқылын С 6 Н 5 СООН - ароматты көмірсутектердің бүйір тізбегін тотықгыру арқылы алады. Мысалы толуолдан:
Бензой қышқылы карбон қышқылдары тэріздес негіздермен әрекеттесіп, тұз тұзеді.

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz