Тұз қышқылы тұздары мен хлордың оттекті қосылыстары: құрылымы, қасиеттері және өндіру әдістері


ТҰЗ ҚЫШҚЫЛЫНЫҢ ТҰЗДАРЫ
Тұз қышқылының тұздарын хлоридтер деп атайды. Олардың көбісі суда жақсы ериді. Ерімейтіндер: AgCl, CuCl, AuCl, TIC1, РЬС1 2 .
Фторидтер тәрізді хлоридтердің де табиғаты топтар және периодтар бойынша алғанда белгілі бір заңдылықпен өзгереді. Мысалы, III периодтың элементтері түзетін хлоридтерді алайық:
NaCl MgCl 2 АІСІз SiCl 4 PCI5 (SCU)
Т балқу 800 714 193 - 70 159 (бірден булану)
табиғаты негіздік амфотерлі қышқылдық
Бұл қатардағы хлоридтердің химиялық байланысы алғашқыда иондық болса, соңында коваленттікке айналады. Ионды хлоридтердің бастылары сілтілік, сілтілік-жер (Li мен Be басқасы) металдары жәуе лантаноидтердің көбісі түзетін тұздар - қатты кристалдар, өзіндік жоғары балқу температуралары бар. Қовалентті хлоридтерді бейметалдар береді, олар газдар, сұйықтықтар не оңай балқитын қатты заттар.
Бұларды табиғи тұздар және жасанды тұздар деп екі топқа бөлуге де болады.
Табиғи тұздардың бастылары - ac тұзы (галит) NaCl, сильвин KC1, магний хлориді MgCb, сильвинит NaCl-KСl және карналит KCl-MgCl 2 *6H 2 O сияқты қос тұздар және т. б. Бұл табиғи тұздар жаратылыста үш түрде: суларда (бұлақ өзен, кел, теңіз т. б. ) еріген күйде, ащы (тұзды) көлдерде шөгінді әрі сөлінде еріген күйде және жер қабатында қазба қатты түз түрінде кездеседі. Бұлардың ішінде ең көбі, әрі көп қолданылатыны ас тұзы.
Өте ерте заманда жер шары түзіле бастаған кезде, оны қоршаған заттар элемент күйінде - газ не бу түрінде ғана болған. Біртінден соның бәрі суи келе, газ күйіндегі хлор мен натрийдің буы қосылысып натрий хлориді түзілімі, одан сутек пен оттек қосылысып су түзілген. Ол су жердің бетіне келіп ондағы ойпаттарды толтырған, сөйтіп алғашқы мұхит пайда болады. Атмосферадағы және жер бетіндегі суға ерімтал заттар мұхит суына жиылады, сөйтіп ас тұзы ол магма қатып тау түзілгенде, тау денесінде болды, бірақ жылдар бойы жауған жаңбыр мен қар суы оны да ерітіп, бұлақ, өзен суы арқылы мұхитқа жимады. Тұңғыш мұхит ас тұзының алғаш қоры еді, біздің заманымыздағы жер бетінде, жер қабатында, жер қыртысында кездесетін еріген, шөккен не тас болып қатқан ас тұзы осыдан тараған.
Қазіргі кездің теңіз, мұхит суларында орта есеппен 3%-ке жуық еріген ас тұзы бар. Ол қатты түрде болса 20 миллион куб-километр көлем алар еді; мұның өте көп екендігін байқау үшін ол тұзды жердің құрғақ бетіне (149 миллион км 2 ) жайған болсақ қалыңдығы 100 м артық қабат болар еді. Еріген тұз бұлақтардың өзен, көлдің суында болады. Кейбір ащы көлдердегі тұз мөлшері 26% дейін барады, міне, осы көлдер суалғанда тұз түбіне шөгеді. Бізде ондай ірі келдер Эльтон, Басқұншақ, Жақсы қылыш (Арал теңізінің маңы), Тобылжан, Каряков (Павлодар облысы), Орқаш (Қостанай облысы) . Осылармен қатар ас тұзы жер қабатында қатты тұз түрінде кездеседі, мұны қатты тұздар қатарына қосады. Мұндай орында Артемьевск (Донбасс), Елек (Орынбор түбі), Солотвино (Закарпатьеде), Шөладыр (Алматы маңы) және Кавказ, Сібір т. б. жерлерде бар. Қазба тұздар ерте уақытта болған теніздердің, үлкен ащы көлдердің суалғаннан кейінгі қалдығы.
Алу жолдары - теңіз суындағы тұзды алудың әзірге арзан жолы табылған жоқ. Көлдердегі шөгінді тұз тұз комбайыны не тұз сорғыш (солесос) деген машина (ІІІ - сурет) жәрдемімен алынады. 1-болаттан жасалған айналмалы ұсатқыш, 2-пневматикалық труба, 3-ұсатылған тұзды сөлімен араластырып сорып ілгері айдайтын насос, 4-құбыр, 5-тұз жинайтын резервуар, 6-элеватор - шығырдағы сияқты айналып тұратын, бірақ асты тесік бақырлар; резервуардағы тұзды күреп алып бара жатқан жолында, шашырап тұрған су бақырдағы тұзды жуып тесігінен ағып өтеді; бақырдағы тұзды элеватор тура темір жол вагонына тиейді.
Бір комбайн 7 мың кісінің жұмысын істейді.
Жер қойнындағы қатты тұзды шахта жасап өндіреді (112-сурет) .
Ac тұзының адамның тіршілігіне, шаруасына керектігі сондай, орта есеппен, бүкіл жер жүзінде, әрбір адамға жылына 8 кг ас тұзы ұсталады екен.
Тұз қышқылының табиғи тұздарының ішінде, тағы бір өте маңыздысы калий хлориді - K. C1, оны сильвиннен не сильвиниттен, не карналиттен алады. Калий хлориді көп мөлшерде ауыл шаруашылығында тыңайтқыш ретінде қолданылады.
Тұз қышқылының кейбір тұздары жаратылыста жоқ бірақ шаруашылық салаларында өте қажет болғандықтан қолдан жасалады; ол үшін хлорды металменен тікелей қосады, немесе NaCl-дан алмасу реакциясы арқылы алады.
Кальций хлориді СаСЬ-бНгО, тоңазытқыш қоспалар жасау үшін, сусыз кальций хлориді СаСb лабораториялар жұмысында эфйрді, басқа оргаиикалық заттарды құрғату үшін қолданады. Сынап дихлориді NgCb не алмас өте күшті у. Ағаш заттарын, анатомиялық препараттарды консервілеуге, сынаптың басқа қосылыстарын жасау үшін және медицинада дезинфекциялаушы дәрі ретінде қолданады.
Қүміс хлориді AgCl, фотография қағазын және пластинкаларын жасау үшін жұмсалады. Магний хлориді MgCl 2 -6H 2 O мұның минерал түрін бишофит деп атайды. Оны карналиттен де алуға болады. Осы соңғы кезде бұл тұз еріген түрде, өте көп мөлшерде Жалаулы, Теке, Қызылқақ көлдерінде (Арқада) табылып отыр. Жақында өндірісі ұйымдастырылмақ.
ХЛОРДЫҢ ОТТЕКТІ ҚОСЫЛЫСТАРЫ
Хлор оттекпен тікелей қосылыспайды, хлордың толып жатқан оттекті қосылыстары жанама жолдармен алынған. Бұл қосылыстарды тұрақты берік қосылуы деп есептеуге болмайды, ішіндегі тұрақтырағы оттекті қышқылдардың тұздары, тұрақсызырағы оксидтері. 45-кестеде хлордың оксидтері, оттекті қышқылдары және олардың тұздары келтірілді.
45 - кесте
Валенттік
(тотығу дәреж. )
HC1O
хлорлылау
CHlO 2
хлорлы
НСІОз
хлорлау
HClO 4
хлор
Оксидтері. Дихлор оксиді Сl 2 О (хлорлылау ангидрид) алу үшін хлорды құрғақ сынап оксиді арқылы өткізеді:
2HgO + 2Cl 2 = HgCl 2 + Cl 2 O.
Қошқыл сары түсті, қолайсыз иісті газ, тыныс жолдарын ауыр жарақаттайды. Оңай сұйылады. Эндотермиялық қосылыс, қопарылыс беріп айырылуы оңай (қыздырса, жанғыш заттармен жанасса, суық күйде бір ыдыстан екінші ыдысқа құйғанда да) :
2С1
2
О = 2С1
2
+ О
2
 Н° = 150
кДж/моль
Н° = 150
кДж/моль
Сумен оңай реакцияласатын ангидрид:
Cl 2 O+H 2 O = 2НСlO
Cl 2 O молекуласы сызық бойымен тіркескен:
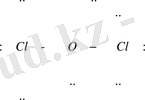
Хлор диоксиді СІО 2 - алу жолы:
2КС1Оз + Н
2
С
2
О4 = К
2
СО
3
+
 СО
2
+ Н
2
О+
СО
2
+ Н
2
О+
 2СlO
2
2СlO
2
реакцияны 60° температурада өткізеді. СІО 2 жасыл - сары түсті, +10° сұйылатын газ, СО 2 ажыратып алу үшін осы қасиетін пайдаланады. Эндотермиялық тұрақсыз, қопарылғыш қосылыс. Суда жақсы ериді, бірақ нашар реакцпяласады, ал сілтілермен жақсы реакцияласады:
2C1O 2 + 2KOH = KC1O 3 + KC1O 2 +H 2 O
Бұл реакцияда хлорлау және хлорлы қышқылдардың тұздары түзілгеніне карағанда СІО 2 екі кышкылдың аралас ангидриді болуы керек.
Хлор диоксиді ыдырауға бейімдіктен бос Сl 2 мен О 2 түзіп, күшті тотықтырғыш қасиет көрсетеді. Мәселен,
15С1O 2 +17Р = 5РСІз + ЗР 4 О 10
PbO + 2ClO 2 + 2NaOH=PbO 2 + 2NaClO 2 l+H 2 O
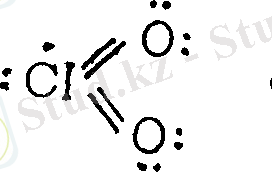
CIO 2 молекуласында электрон
саны тақ, әрі ол
парамагнитті, пішіні үш бұрышты молекула, О-С1-О байла-ныстарының арасындағы, хлор түбіндегі бұрыш 118°. Дихлоргексаоксидін С1 2 О 2 алу жолы:
6СІО 2 + 2Оз = ЗСl 2 О 2
бұл қошқыл-қызыл түсті сұйықтық органикалық заттармен қопарылыс береді. Сумен реакцияласып екі қышқыл түзеді:
С1 2 О 2 + Н 2 О-НС1Оз + НС1О 4
демек, бұл да екі қышқылдың аралас ангидриді. Хлор ангидридін СІ 2 О 7 алу жолы:
2НС1О 4 + Р2О 5 = 2НРО 3 + СІ 2 О 7
түссіз сұйықтық, органикалық заттармен қопарылыс бермейді, сумен реакцияласады:
Сl 2 О 7 + Н 2 О = 2НС1О 4
Қышқылдары және тұздары. Хлорлылау қышқыл Н-0-С1. Хлордың сумен реакцияласуы нәтижесінде түзіледі:
С1 2 + Н 2 О = НСІО + НСІ
онымен қатар түзілетін тұз қышқылын реакциядан бөліп алу үшін HgO араластырады, сонда:
2Cl 2 + 2HgO + H 2 O==2HCIO + Hg 2 OCl 2
қалыпты температурада тек ерітінді түрінде ғана болады, төмен температурада кристаллогидрат НС1О-2Н 2 О түзеді.
Хлорлылау қышқыл тұрақсыз, еріген күйінде де қосарлана үш реакция бойынша айырылып жатады, бұл реакцияларды мына теңдіктермен көрсетуге болады:
1. НСlO = НС1 + О
2. 2НСlO = С1 2 О + Н 2 О
3. ЗНСlO = 2НСІ + НС1Оз
Шығатын заттардың кажеттігіне қарай бұл үшеуінің ішінен керекті реакцияны тездетіп, қалғандарын баяулатудың тәсілдері бар, Хлорлылау қышқыл өте күшті тотықтырғыш (1реакция), хлор суының тотықтырғыштығы да осыдан.
Егер хлорды суға емес, сілті ерітіндісіне (суықта) жіберсе, мысалы:
2КОН + СІ2 = КС1 + КС1О + Н 2 О
калий гипохлориті түзіледі. Гипохлориттер де өте жақсы тотықтырғыш, оны боялған заттарды, қағазды ағартқыш ретінде қолданады; гипохлориттің тотықтырғыш болуынын, себебі ауадағы көмір қышқыл газдың әрекетінен ерітіндісінде хлорлылау қышқыл түзіледі:
KC1O + CO 2 + H 2 O = KHCO 3 + HC1O
Сілтілердің арзаны кальций гидроксидімен Са(ОН) 2 хлор реакцияласқанда хлор әгі түзіледі; оның түзілу реакциясын тура дәл болмағанымен де мына теңдікпен көрсетуге болады:
Сl
2
+ Са (ОН)
2
= Са
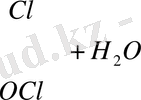
Демек, хлор әгі тұз қышқылының және хлорлылау қышқылдың аралас тұзы. Хлор әгі ақ түсті, ащы иісті ұнтақ, күшті тотықтырғыш қасиеті бар зат.
Хлор әгі ауамен жанасқанда ондағы СО 2 мен реакцияласады:
СаОСІ 2 + СО 2 = СаСО 3 + СІ 2
2СаОС1 2 + СО 2 = СаСО 3 + СаС1 2 + С1 2 О
Бұл екі реакция қабат жүреді, бірақ екінші реакция басымырақ. Бу қатысқанда:
2СаОСІ 2 -СО 2 + Н 2 О = СаСОз + СаСІ 2 + 2НС1О
Бұл реакциялардың қайсысынан болса да бөлініп шығатын хлордың оттекті қосылыстары күшті тотықтырғыштар.
Хлор әгінің сапасы «актив хлордың» проценттік мөлшерімен анықталады («актив хлор» дейтініміз әктің хлор эквивалентіне шағылған тотықтырғыштық қабілеті) . Сатудағы стандартты хлор әгінде 35% актив хлор болуы керек.
Хлорды сұйық түрде өндіре бастағаннан бері хлор әгінің мәні аздап кемігенімен, әлде де көп жерлерде қолданады - целлюлоза және қағаз ағарту, хлороформ, хлорпикрин синтездеу; ацетилен, керосин тазалау; дезинфекция, дегазация, арам шөппен күресу т. б.
Хлорлы қышқыл Н-О-С1 = О, СІО 2 гидролизінде түзіледі: 2C1O 2 + H 2 O = HC1O 2 + HC1O 3
Оның тұздары хлориттер де солай:
2С1О 2 + 2КОН = КСlO 2 +КСlOз + Н 2 О
Хлорлы қышқылды жекелеп алудың да жолы бар:
2СlO 2 + ВаO2 = Ва(С1O 2 ) 2 + O 2 Ba(CIO 2 ) 2 + H 2 SO 4 = BaSO4+2HClO 2
Хлорлы қышқыл тұрақсыз қышқыл, іс жүзінде еш жерде қолданбайды. Тұздары қопарылғыш.
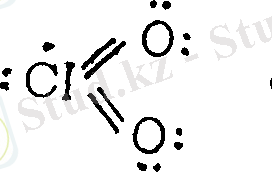
Хлорлау қышқыл Н - О -Хлорлылау қышқылы
қылдың айырылуынан түзіледі:
ЗНС1О = НС1Оз + 2НС1,
бірақ оны тұзынан алады:
Ba(CIO 3 ) 2 + H 2 SO 4 = 2HClO 3 + BaSO 4
Хлорлау қышқыл суда еріген күйде ғана болады, ерітіндісі түссіз, 50%-дейін ғана концентрлеуге болады; өте күшті бір негізді қышқыл, тотықтырғыш.
Тұздары хлораттар түссіз, қыздырғанда оттек бөліп шығаратын қопарылғыш, әрі улы заттар ішіндегі маңыздысы калий хлораты - КСІОз (Бертолле тұзы) .
Күйдіргіш калидің ыстық ерітіндісіне хлор жіберсе, онда болатын реакциялардың ақтығы былай жазылады:
ЗСІ 2 + 6К0Н = КС1Оз + 5КС1+ЗН 2 0
енді осы ерітіндіні салқындатса, КС1О 3 суық суда нашар еритіндіктен, тұнбаға түседі.
Бертолле тұзы өте маңызды тұз болғандықтан, айтылып өткен лабораторияда алу әдісінен басқа, техникада алудың екі әдісін келтіреміз:
1. Химиялық әдіс .
6Са(ОН) 2 + 6Сl 2 = ЗСа(СlO) 2 + ЗСаСІ 2 + 6Н 2 О
ЗСа(С1О) 2 = Са(СlОз) 2 + 2СаС1 2 .
6Са(ОН) 2 + 6С1 2 = Са(С1Оз) 2 + 5СаСl 2 + 6Н 2 О
Са(СlOз) 2 + 2КС1=2КСlOз+СаСl 2 .
ерітіндіні салқындатып, КСІОз сүзіп алады.
2. Электрохимиялық әдіс . Калий хлоридінің 25% ерітіндісін диафрагмасыз (Х-тарау, §3) электролиздейді, алдымен ерітіндіде мынадай реакция болады:
С1 2 +2КОН=КС1+КС1О+Н 2 О, одан кейін анодта C1O' ионының тотығу процесі болады:
6С1О' + ЗН
2
О + 6е
 2СlО'з + 6Н
2СlО'з + 6Н
 Equation. 3 . +4СІ' + 3О
Equation. 3 . +4СІ' + 3О
Бертолле тұзы жанғыш (күкірт, көмір, фосфор) заттармен өте қопарылғыш қоспа беретіндіктен оны артиллерияда залал (от бергіш) жасау үшін және пиротехникада қолданады; шырпы өндірісінде жұмсалады, шырпының басындағы қоспаның . 50% осы бертолле тұзы. Бертолле тұзы қыздырғанда 356° балкып, 400° маңында катализатор (МnО 2 т. б. ) қатынасында айырыла бастайды:
2КСlO
3
-2КС1 + 3О
2
 Н°= - 109
кДж/моль
Н°= - 109
кДж/моль
катализаторсыз қыздырса, өте қопарылғыш зат КСІО4 түзіп айырылады:
4КС1Оз = 3КСlO
4
+ КС1
 Н°= -148, 5
кДж/моль
Н°= -148, 5
кДж/моль
Хлор қышқылы H - U -
 = O
= O
Бұл қышқылды алу үшін калий перхлоратын концентрлі күкірт қышкылымен әрекеттейді
KC1O 4 + H 2 SO 4 KHSO 4 + HC1O 4
НСІО 4 түссіз ашық тұрса түтіндене бастайтын сұйықтық, қат. t= - 112°. Хлор қышқылы таза күйінде өте тұрақсыз, өзінен-өзі қопарылуы мүмкін; судағы ерітіндісі қопарылмайды, тотықтырғыштығы хлордың басқа қышқылдарынан нашарлау; қышқылдың қасиеті - барлық белгілі қышқылдардың күштісі.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz