Электродтық потенциалдар, гальваникалық элементтер және электролиз: негізгі қағидалар мен заңдар


Электр тоғын химиялық реакциялардан алу. Метал - ерітінді шекарасынадағы тепе - теңдік. Электродтық потенциал. Сутектік электрод. Стандартты сутекті электрод. Стандартты потенциалдар қатары. Гальваникалвқ элементтер. Металдардың электро - химиялық кернеу қатары. Стандартты ТТ - потенциалдары. Олардың ТТР жүруін болжаудағы, және тотықтырғыш пен активтігін салыстырудағы маңызы. Қышқыл, негіз, тұздардың судағы ерітінділердің электролизі. Фарадей заңдары.
. . . Жоғарыдағы көрсетілген ЭБ және ИЭБ - тәсілдерімен ТТР теңестіріп, М. В. Ломоносовтың зат масасының сақталу заңының негізінде коэффициенттерін қойып, теңдеулерін теңестірдік.
Сұрақтар тууы мүмкін: Бұл реакциялар қай бағытта жүреді? Тотықтырғыш пен анықтау үшін арнайы тәжірибе (эксперимент) қою керек пе? Немесе, басқадай түсініктер ме бар ма? Иә, бар. Жауапты беру үшін адамзат баласы, қиын да, ұзақ та жол жүрді . . .
Бұл сұрақтарға, тек қана 200 - жыл өткен соң: Гальвани мен Вольтаның (итальян ғалымдары), гальваникалық элементтер, ЭҚК пайда болу себептері ашылған соң ғана мүмкін болды.
- Егер кез келген металл пластинкасын стакандағы суға салса, онда полярлы су молекуласының (диполь) әсерінен, біраз металл
ериді, металл беті оң зарядталады, ал катиондар Zn металл ішінде қалып, теріс зарядталады. Суға өткен катиондар, металл пластинкасының жанына орналасып екі электр қабатын құрады. Ал бұл, металл - ерітінді шекарасында, потенциал секірісін туғызады.
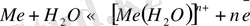 ; Сонымен, катиондар ертінді көлеміне еркін жүзіп жүре алмайды. Сол себепті, металл - ерітінді шекарасында қос электр қабаты пайда болады, ал ол жацпақ конденсаторға ұқсас. Металдың теріс зарядтарын - қос электр қабаты бейтараптайды. (компенсация) .
; Сонымен, катиондар ертінді көлеміне еркін жүзіп жүре алмайды. Сол себепті, металл - ерітінді шекарасында қос электр қабаты пайда болады, ал ол жацпақ конденсаторға ұқсас. Металдың теріс зарядтарын - қос электр қабаты бейтараптайды. (компенсация) .
Конденсатордың заряды тығыз бөлігінде - заряд сызықша өзгерсе, ал диффузиялық бөлігінде - парабола тәрізді өзгереді. Потенциал секірімі - металл бетінен (электродтан) 10 -4 см. Қашықтықта жүреді. Осы потенциал айырымы (секіру) - металдың электродтық потенциалы деп аталады.
- Егер металл суға емес, концетрациясы төмен өзінің (ZnSO4) ерітіндісіне батырылса, онда қос қабаттың түзілуі судікіндей болады.
- Егер ZnSO4концентрациясы үлкен болса, онда катиондар металл бетінде бөлінеді де оң зарядталады (Zn2+), SOаниондары оған тартылып қос электр қабатты қабаты түзеді.
- Егер Cu пластинкасын CuSO4ерітіндісіне салсақ, онда да жоғарыдағы тәрізді - қабаты түзіледі.
- Егер инертті электродтарды (Pt, көміртек, шыны көміртек) пайдалансақ, (электрод иондары ерітіндіде жоқ), онда да қос электр қабаты түзіледі. Мысалы, Pt + HCl + Hнәтижесінде HPt - да адсорбцияланып төмендегідей тепе - теңдік орнайды; H
Pt мен ерітіндінің арасында потенциал секірісі пайда болып, қос электр қабаты түзілуі. Pt, т. б. инертті электродтық ролі - электрон беріп, қосып алу.
Электродтық потенциалдың абсолюттік мәнін - тәжірибе арқылы табу мүмкін емес, сондықтан оны стандартты сутекті электродпен салыстырып анықтайды, оның потенциалы нольге тең деп алынады.
Стандартты сутекті электрод дегеніміз - 1н H
2
SO
4
ерітіндісін түсірілген Pt - пластинкасы, ол 101, 3 кПа қысымда, Т=298К температурада газ H
 жуылады.
жуылады.
Концентрациясы 1моль/литр (немесе активтігі) металл тұзының ерітіндісі мен метал шекарасында пайда болатын және сутек электродымен салыстырып өлшенетін - электродтық потенциалды - сол металдың стандарттық электр потенциалы деп атайды.
Стандартты электродтық потенциалдың өсуі бойынша металдарды қатарға орналастырсақ, металдардың электро - химиялық кернеу қатарын - алуға болады (таблица) .
Бұл қатар, металл мен олардың иондардың ТТ - қасиеттерін, тек қана судағы ерітінділерінде сипаттайды. Электродтық потенциалдарды гальваникалық элементтердің көмегімен анықтаймыз.
Гальваникалық элементтердің жұмысына негізделген - ТТР бағыты - ЭҚК оң мәні жағына ығысады.
Мысалы: Концентрациялары
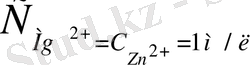 ерітінділеріне түсірілген Mg және Zn құралған гальваникалық элементтердің электродтарында төменгі процестер жүреді:
ерітінділеріне түсірілген Mg және Zn құралған гальваникалық элементтердің электродтарында төменгі процестер жүреді:
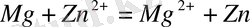 ;
;
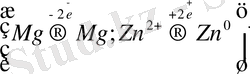 ;
;
ЭҚК
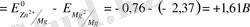 ;
;
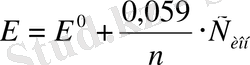 Электродтық потенциал: металл табиғатына, концентрацияға, температураға байланысты болады. Егер
Электродтық потенциал: металл табиғатына, концентрацияға, температураға байланысты болады. Егер
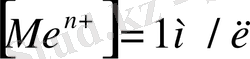 болса,
болса,
 Теңдеудің физикалық мәні - электродтың басты (негізгі) сипаттамасы.
Теңдеудің физикалық мәні - электродтың басты (негізгі) сипаттамасы.
Осы жерде сутектік электродтың құрылысын көрсетіп, оны электродтық потенциалды өлшеуге қолданып, тізбекке қосу (схема) .
Электродтық потенциалды өлшеу негізінде, кейбір металдардың, сутектік электродтан оң зарядталатын көреміз, оларды асыл металдар деп атайды, олардың катиондары ерітіндіге өтпейді (ерімейді) .
ТТР жүру бағытын осылай түсіндіреді (мысалы: өзінен кейін тұрған металдан жасалған электрод, бұрын тұрғанға қарағанда тотықсыздандырғыш болады) . Сутекке дейінгі тұрған металдар (теріс стандартты электродты потенциал) HNO 3 , HCl, H 2 SO 4 , тіпті CH 3 COOH әрекеттеседі.
Ал олар сумен әрекеттесе ме, себебі судың құрамында да сутек бар ғой? Неліктен 1н H
2
SO
4
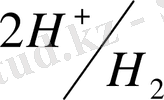 системасының электродтық потенциалы нолге тең, ал басқа иондардан тазартылған судікі - 0, 41B.
системасының электродтық потенциалы нолге тең, ал басқа иондардан тазартылған судікі - 0, 41B.
Шешімі: а) Нернст формуласы бойынша
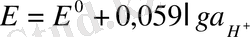 ал
ал
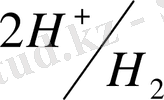 системасының электродтық потенциалы сутек ионының активтігіне байланысты,
системасының электродтық потенциалы сутек ионының активтігіне байланысты,
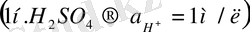 , сондықтан
, сондықтан
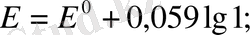
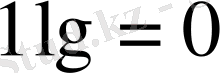 ; сондықтан
; сондықтан

б) . Тазартылған суда
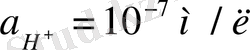 , сондықтан,
, сондықтан,
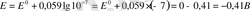 ;
;
Осы себепке байланысты сутек солға қарай ығысып, активтік қатарында Zn пен Fe алдына шығады, бірақ әлі де сілтілік, сілтілік - жер металдарынан кейін орналасады, сондықтан олар сумен әрекеттесіп, H
 бөлінеді.
бөлінеді.
Ескерту: Осы мәселені металл катиондарын электролизге түсіргендегі до Al 3+ . . . после . . . заңдылықпен салыстыру керек.
Жоғарыда біз, электрод деп, өзінің ертіндіде иондары бар, кез - келген металды атадық. (соған түсірілген) . Оларды
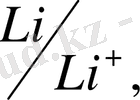
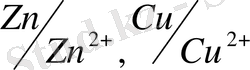 - жаздық. Алымында - ттотықсыздандырғыш, бөлімінде - тотыққан формасы. Шын мәнінде - бұлар ТТ - жұптар. Сондықтан, өлшенген потенциалдар кестесіне тотықтырғыш, тотықсыздандырғыш енгізіп, ең соңғы графадағы (жолдағы) электродтық потенциал деген жерге стандартты ТТ - потенциалы деп жазамыз. (өз ерітіндісіне түсірілген металл демей, ТТ - потенциалы дейміз) .
- жаздық. Алымында - ттотықсыздандырғыш, бөлімінде - тотыққан формасы. Шын мәнінде - бұлар ТТ - жұптар. Сондықтан, өлшенген потенциалдар кестесіне тотықтырғыш, тотықсыздандырғыш енгізіп, ең соңғы графадағы (жолдағы) электродтық потенциал деген жерге стандартты ТТ - потенциалы деп жазамыз. (өз ерітіндісіне түсірілген металл демей, ТТ - потенциалы дейміз) .
Сол себепті де металдардың тотыққан, тотықсызданған формаларында бос элементпен, иондар ғана емес сонымен қатар
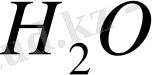 және оның иондары да болады.
және оның иондары да болады.
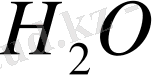 - тек орта ғана емес, ол - жүріп жатқан ТТР - ң ең белсенді қатысушысы болып табылады. ТТР - потенциалдарын Нернст теңдеуімен анықтайды:
- тек орта ғана емес, ол - жүріп жатқан ТТР - ң ең белсенді қатысушысы болып табылады. ТТР - потенциалдарын Нернст теңдеуімен анықтайды:
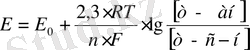
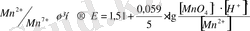 ;
;
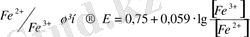
Енді, химиялық ТТР энергиясын пайдаланып электр энергиясын қалай алуға болады?
Табиғатта энергия өмір сүріп келген, әлі де бар сондықтан оны алмайды, оны бір күйден екінші бір күйге айналдырады (немесе бір түрден екінші бүр түрге) . (мысалы: ТЭЦ, ДЭС, ГЭС т. б КПД = 35-40%) .
Атақты итальян ғалымдары Даниэль, Гальвани, Вольта ғаламат жаңалық ашып, қолымызға гальваникалық элементті берді және ЭҚК - ң пайда болу механизмін ашты. (Плакаттарды көрсету) .
Барлығы түсінікті, бірақ электролитік көпір (мост) не үшін керек деген сұрақ туады?
Гальваникалық элемнттің жұмысының нәтижесінде, электрондар бір электродтан екіншісіне ауысып, ерітіндідегі электробейтараптықты бұзды. (ZnSO
4
құйылған стаканда Zn
2+
көбейіп, ал CuSO
4
құйған стаканда
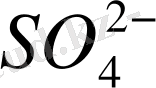 - анионы көбейген) .
- анионы көбейген) .
Сондықтан, осы пайда болған потенциал айырымын жоғалту керек, оны
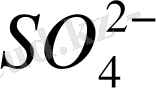 аниондары электролиттік көпір (мост) арқылы мыс (Cu) электродынан, мырыш (Zn) электродына қарай ағып жояды. Осының нәтижесінде екі тасқын пайда болады:
аниондары электролиттік көпір (мост) арқылы мыс (Cu) электродынан, мырыш (Zn) электродына қарай ағып жояды. Осының нәтижесінде екі тасқын пайда болады:
а) Сыртқы тізбек арқылы ағылған электрон; б) Көпір (мост) арқылы қарсы аққан
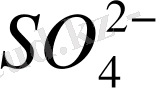 иондары. Мұны біз электр тоғы дейміз. Электрондар пайдалы жұмыс жасау үшін, оларды сыртқы тізбекпен қозғалтып, жүргізу керек.
иондары. Мұны біз электр тоғы дейміз. Электрондар пайдалы жұмыс жасау үшін, оларды сыртқы тізбекпен қозғалтып, жүргізу керек.
Электролиз ТТ - процесі.
Электролиздің негізі. Тұрақты электр тоғының әсерінен жүретін ТТП - ді электролиз деп атайды. Электролиз кезінде, электр энергиясы химиялық энергияға айналады. Электр тоғының тотықтырғыш - тотықсыздандырғыш әсері химиялық реактивтердікінен әлдеқайда күштірек. Мысалы, химиялық кез - келген тотықтырғыш фторид ионнан (F - ) оның электронын тартып ала алмайды. Сондытан да минералды табиғатта NaF, CaF 2 көп тараса да, бос күйінде F 2 алынбаған.
Балқымаларын электролизге түсіреміз.
К А
NaF
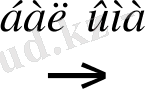 Equation. 3 Na
+
+F
-
Equation. 3 Na
+
+F
-
Na
+
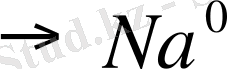 Equation. 3 2F
Equation. 3 2F
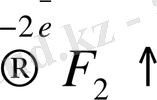 Equation. 3
Equation. 3
Электролиз 1. электролит табиғатына
2. электрод табиғатына (ерігіш, ерімейтін)
3. электролиз жағдайына (условия)
 .
.
Электролизді Никельсон, Карлейль қарастырған ал оны фундаментальды (түпкіше) зерттеген Майкл, Фарадей болған. Электролиз кезіндегі сандық өзгерістер Фарадей заңдарымен реттеледі.
Фарадей заңы (Электролиз заңдары) 1834 жыл.
1. Заң.
Электролиз кезінде электродта бөлінетін зат массасы (m), электр мөлшеріне тура пропорционал болады m=Kq; q=
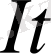 m=KIt
m=KIt
2. Заң.
Электрод арқылы өтетін электр заряды, эквивалентті мөлшерде зат бөледі.
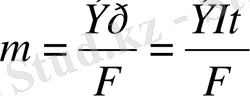 немесе
немесе
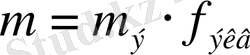 ;
;
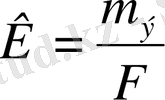
Электролиз кезінде электродтан 1F электр тоғы бөлінетін зат массасын электрохимиялық эквивалент (
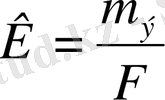 ) деп атайды. Ал m
э
- эквиваленттік масса
) деп атайды. Ал m
э
- эквиваленттік масса
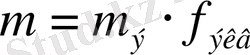 сондықтан
сондықтан
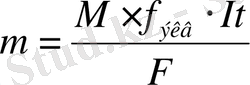
Мысалы, 1F = 96500Кл→1эквивалент зат бөледі.
(
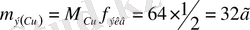 ) және
) және
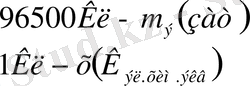
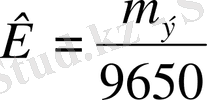 ;
;
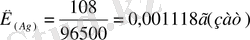 немесе
немесе
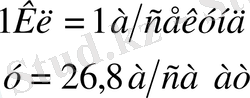
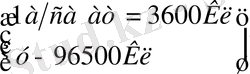
немесе
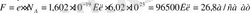
Физикалық мағынасы. Электролиз кезінд, кез-келген заттың 1моль эквивалентін бөлу үшін, электролит арқылы 96500Кл(26а/сағат) электр тоғын өткізу керек. Бұл санды F=96500Кл Фарадей тұрақтысы дейді. (немесе электролиттен 1моль эквивалент зат бөліп алу үшін, күші I=1A электр тоғын 26, 8сағат бойы жіберу керек. )
Көп жағдайда, алынған өнім (продукт) теориялық есептеуден аз болады, сондықтан қосымша реакцияларға жұмсалған электр энергияны ескеру үшін тоқ бойынша шығым деген үғым енгізіледі.
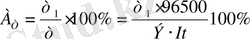 немесе
немесе
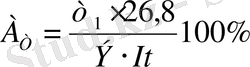
Электролизден шығатын қорытынды теориялық материалдар.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz