R-Me-Bi-O (R - сирек-жер элементтері, Me = Ca, Sr) жүйесіндегі жаңа висмутиттерді синтездеу және олардың рентгенографиялық, термохимиялық және термодинамикалық қасиеттерін зерттеу


КІРІСПЕ
Біздің өміріміздегі бейорганикалық химияның алатын орны ерекше. Қазіргі заманғы бейорганикалық химияның дамуы жаңа заттарды синтездеп, олардың физика - химиялық қасиеттерін қарастыруға байланысты [1] . Соңғы кездегі электронды техниканың қарқынды өрлеуіне қарамастан, шешімін таппаған сұрақтар жеткілікті. Бұлардың қатарына висмутиттерде жатады.
Электронды техниканың дамуы және олардың халық шаруашылығының әртүрлі салаларына көптеп ене бастауы келешекте бағалы, қызықты материалдарды синтездеуді кезекті басты мәселе етіп қояды.
Мұндай материалдар қатарына пьезо-, пиро-, сегнетоэлектрлік, жартылай өткізгіштік қасиеттер көрсететін бейорганикалық заттар жатады. Сондықтан осындай қасиеттерге ие болатын, бұрыннан белгісіз, әлі толық зерттелмеген жаңа қосылыстарды синтездеп алу белгілі бір ғылыми, тәжірибелік қызығушылықтар туғызады және осы саладағы зерттеулер үшін өзекті мәселе болып табылады.
Жаңа көпэлементті оксидті катализаторлар мен электронды техника материалдарын іздестіру - ферромагнетиктер, антиферромагнетиктер, жоғары температуралы жоғарыөткізгіштер, пиро- және сегнетоэлектриктер - құрамында ауыспалы тотығу дәрежесін көрсететін висмуты бар каркасты және екіөлшемді қабатты оксидтердің кристаллохимиясы соңғы жылдары белсенді зерттелуде.
Басты қызығушылықты висмут - оттегі, металл - оттегі, халькогенді, галогендерді кезектестіру жолымен тұрғызылған қосылыстар тобы туғызады. Мұндай қосылыстардың кристалл құрылыстарында симметрия орталығының болмауы - оларда бағалы электрофизикалық қасиеттердің пайда болуы үшін басты жағдай болып табылады.
Химиялық термодинамиканың заңдарынсыз бағытталған синтез технологиясының іргелі сұрақтары шешілмейтіндігі белгілі. Висмут қосылыстары халық шаруашылығында кеңінен қолданылады, ал термохимиялық тұрғыдан толық зерттелмеген.
Висмут тотығының қатты фазада сілтілік - жер және мыс оксидімен әрекеттесуі арқылы алынған күрделі оттекті қосылыстары аса жоғары өткізгіштік қасиеттер көрсетеді. Осыған байланысты висмутиттердің синтездеу жағдайын, олардың рентгендік құрылымын анықтау, термодинамикалық және физикалық қасиеттерін зерттеу - ғылыми өзекті мәселе болып табылады.
Жұмыстың мақсаты. Жоғарыда айтылған мәселелерге байланысты жұмыстың мақсаты R-Me-Bі-O (мұндағы R - сирек-жер элементтері, ал Ме- кальций және стронций) жүйесінде пайда болатын, бұрын зерттелмеген қосылыстарды синтездеу және олардың рентгенографиялық, термохимиялық, термодинамикалық көрсеткіштерін және кейбір физикалық қасиеттерін зерттеу.
1. 1 Кальций, стронций және висмут оксидтерінің құрылыстары химиялық және физикалық қасиеттері
Кристалдық құрылыс тұрғысынан қарастырған кезде металл оксидтерін төрт негізгі типке бөлеміз: молекулярлы, тізбекті, қабатты және қаңқалы құрылыс. Оксидтердің құрылысының әртүрлі болуы, берілген оксидті құрап тұрған металдың периодтық жүйедегі орнына байланысты. Координациялық саны жоғары (6 немесе 8) көптеген металл оксидтері иондық құрылыс түрінде болады [2] .
Координациялық саны 6-ға тең болатын металл атомдарының иондық радиустары, О 2- ионының иондық радиусынан кіші болады. Жәй және күрделі оксидтердің құрамындағы оттегі иондары тығыз немесе 6іp-6іpінe жақын, ал мөлшері жағынан кіші металл атомдарының иондары октаэдрлік қуыстарда орналасады [3] .
Көптеген ауыспалы металдардың оксидтері стехиометриялық ауытқуларға ие болады, осының салдарынан олар жартылай өткізгіштер болып табылады. Бірқатар ауыспалы металдар оксидтері соңғы жылдары қарқынды зерттеліп жүрген кызықты магниттік және электрохимиялық қасиеттер көрсетеді [4] .
Висмут (ІІІ) оксиді жүйесін зерттеудің алғашқы стадияларында күрделі емес кристалдық фазалар ғана алынатындығы айтылғанымен, көптеген фактілер бертін келе жоққа шығарылды. Мысалы, Glemsler О. басшылығымен висмут монооксидін натрий висмутиді Na 3 Bі суспензиясы арқылы ауаны өткізу жолымен алуға болатындығы [5] айтылғанымен, бірнеше жылдан кейін Завьялова А. А. бастаған зерттеушілердің жұмыстарында [6] мұндай қосылыстың түзілмейтіндігі делелденді. BіO оксидін 450-500 0 С-да ауада металл висмуттың пленкасын тотықтыру арқылы алуға болатындығы жайында ақпараттар бар [6, 7] . Авторлар электронографиялық зерттеулердің көмегімен оның құрылысының сфалерит құрылысының туындысы екендігін анықтады, элементар ұяшық параметрлері: а=3, 88 нм жене с=9, 71·10 -1 нм. Зерттеудің екіфазалы үлгіде белгісіз төменсимметриялы фазаның қатысында жүргізілгендігін ескере отырып, висмут монооксидін алуға болатындығы толық дәлелденді деп айтуға болмайды. [8] әдебиет авторларымен перовскитке ұқсас құрылысты тотықтардың химиясы тереңірек қарастырылған.
Ві 2 0 4 және Bі 2 O 5 құрамды оксидтер [7] жұмыста сода немесе өткіp натр қайнаған ертіндісінде висмуттың біржарым оксиді суспензиясын хлормен тотықтыру арқылы синтезделіп алынған. Біpaқ рентгенографиялық зерттеулердің жоқтығы авторлардың фазалық құрамдары жөніндегі қорытындыларын жоққа шығарады.
Қалыпты жағдайда висмут оксиді сары түсті ұнтақ зат, меншікті салмағы -8 , 76 г/см 3 , балқу температурасы 820 0 С, ал қайнау температурасы 1890 0 С [9] . Висмут оксидін висмутты күйдіру арқылы немесе висмут нитраты ертіндісін және висмут карбонатын қыздыру арқылы алуға болады [10] . Балқыған Bі 2 O 3 әртүрлі оксидтермен және металдармен әрекеттеседі, ал жоғары температурада металға дейін тотықсызданады. Қышқылдарда висмут тұздарын түзіп ериді, сұйылтылған cілті ерітіндісінде тәжірибе жүзінде ерімейді [9] .
СаО оксиді - ақ түсті ұнтақ, тығыздығы 3, 16 г/см 3 . Ол 2580 0 С температурада балқиды, ал 2850 0 С температурада қайнайды. Сумен, метил спиримен, глицеринмен әрекеттеседі [11] .
SrO oкcиді - ақ түсті аморфты ұнтақ зат, тығыздығы 3, 93 г/см 3 немесе түссіз, кубтық, кристалл тығыздығы 4, 7 г/см 3 . Балқу температурасы 2430 0 С. SrO өте гигроскопты, сондықтан оны жабық ампулаларда сақтау керек. Суда, ацетонда және метил, этил спирттерінде epиді. Стронций оксиді люминесценсиялық қасиет көрсетеді. Катод сәулесінің әсерінен көкшіл түске фосфорисцирленеді [12] . SrO оксиді суда ерігенде жылуды жұтады, сұйылтылған қышқылдарда (НСІ, HNO 3 ) ериді, 180-300 0 С-да аммоний хлоридімен әрекеттеседі, ал 700 0 С-да калий цианидімен әрекеттеседі [13] .
Жоғарыда келтірілген оксидтердің құрылыстарынан екі валентті металл оксидтері біp құрылысқа кристалданатындықтан, бірдей зарядты катиондардың біp-біpімен орындарын ауыстыруға болатындығын көруге болады.
1. 2 Сирек-жер элементтері (ІІІ) оксидтерінің қасиеттері
Сирек-жер элементтері оксидтері Ln 2 Oз химиялық активті қосылыстар қатарына жатады. Олар сумен әрекеттеседі, ауадағы су буы мен көмір қышқылын сіңіріп, гидроксидтер мен карбонаттарға айналады. Қиын еритін Ln(ОН) з гидроксиді күшті негіз болып табылады және амфотерлік қасиет көрсетпейді. Гидроксидтерінің негіздік қасиеті лантаноидтардың реттік нөміpі артқан сайын кемиді. СЖЭ оксидтерінің суды cіңірyі салыстырмалы дымкылдық пен температура өскен сайын артады. СЖЭ оксидтері түстеріне қарай сипатталады. La, Gd, Lu - түccіз, ал аралық СЖЭ оксидтері - әртүрлі түске боялған [14] .
СЖЭ оксидтері құрамында 20% Nі мен Сг бар құймалардың ыстыққа төзімділігін жақсартады. Dy 2 O 3 , Eu 2 O 3 , Sm 2 O 3 оксидтері нейтрондарды жоғары дәрежеде жұту қасиеттеріне байланысты реакторлардың стержендеріне келтірулер жасау үшін қоспа ретінде (5-10%) қолданылады [15] . Жоғары кысымда Ln 2 Оз оксидтерін таза сирек-жер металдармен тотықсыздандыру арқылы LaO, CeO, PrO, NdO, SmO және YbO моноксидтерін алады.
Лантан, церий, празеодим және неодим монооксидтері металдық қасиет көрсетеді. Монооксидтер жоғары температурада вакуумде Ln және Ln 2 Оз диспропорцияланады, ауада Ln 2 Оз-ке дейін тотығады. Сирек-жер металл оксидтерінің қышқылда epігіштігі балқу температураларына тәуелді.
La-нан Lu-ғa қарай қышкылда еру жылдамдықтары кемиді. Көптеген басқа элемент оксидтері мен сирек-жер элементтерінің қосарланған оксидтері синтезделіп, жақсы зерттелген. Сирек-жер элементтері оксидтері кальций, стронций, барий оксидтері мен LnМеО 2 құрамды қосылыс түзеді.
Сирек-жер элементтері оксидтері шыны өнеркәсібінде өте кең қолданылады. Олар оптикалық, химиялық тұрақты, люминисцентті, жартылай өткізгіштік қасиеттеріне байланысты шыны өнеркәсібінде өте нәтижелі қолданыс табуда [16] .
1. 3 Висмутиттердің құрылысы, химиялық және физикалық қасиеттері
Cілтілік-жep және сирек-жер элементтері оксидтері висмуттың үш валентті оксидімен жоғары температурада әрекеттесіп, күрделі висмутиттер түзеді. Оның жалпы формуласы RМeBіO 4 .
Үшкомпонентті қосылыстардан тұратын висмутиттер осы күнге дейін толығымен зерттелмеген.
Көптеген висмутиттер ферромагниттік, электрлік, диэлектрлік қасиеттерге ие болады және радиоэлектроникада, есептеуіш техникаларда, приборларда қолданылады. Олардың қасиеттері құрылысымен және құрамымен сипатталады [17, 18] .
Висмут оксидінің ауыспалы (Сr 2 О 3 , Мn 2 О 3 , Со 3 О 4 ) металдар оксидтерімен қатты күйдегі реакциялары қарастырылған [19] . Бұл жұмыстағы әртүрлі физика-химиялық әдістермен, атап айтқанда, рентгенофазалық, термиялық және микроскопиялық, пар брикеттерді жанастыра кыздыру, электр кедергілерінің температураға тәуелділігін өлшеу, химиялық анализ үшін электрондық спектроскопия әдістері арқылы Bі 2 O 3 оксидінің ауыспалы (Сr 2 О 3 , Мn 2 О 3 , Со 3 О 4 ) металдар оксидтерімен әрекеттесуінің макромеханизмі және кинетикасы зерттелген. РФА нетижелері Cr 2 O 3 -Bі 2 O 3 жүйесінде 900 0 С-ге дейініг 3:1, 16:1, 39:1 қатынастар үшін тетрагональді Bі 16 CrО 27 мен реакцияға түспеген бастапқы Bі және Сr оксидтері қалдықтарынан тұратын қосылыс түзілетінін көрсетті. Co пен Мn жағдайында силленит құрылысына ұқсас MnBі 2 O 20 , Co 2 Bі 24 O 39 -типті фазалары түзіледі.
ІІ. ТӘЖІРИБЕЛІК БӨЛІМ
2. 1. Қатты фазалы синтез әдістемесі
LnCaBіO 4 қосылысының синтезі стихиометриялық мөлшерде Bі 2 O 3 , СаСО 3 , SrСО 3 және Ln 2 O 3 өлшенген үлгілерді қатты фазалы реакциялар жолымен күйдіру арқылы жүргізілді. Қоспалар араластырылып және ұнтақталып алуынды тигелінде термиялық 800 0 С 8 сағатта күйдірілді.
СаО - R 2 O 3 - Bi 2 O 3 және SrO - R 2 O 3 - Bi 2 O 3 жүйесінде түзілетін қосылыстарды синтездеу үшін қатты фазалар синтезі әдісі қолданылды.
Мақсатты үшкомпонентті висмутиттерге ұқсас перовскит құрылысты Ln 2 FeMoO 7 (мұндағы, Ln - Yb, Dy, Ho) қосылыстары қатты фазалар синтезімен алынып, олардың кристалдық құрылыстары анықталған.
Қатты фазалар синтезі силлит пешінде жүзеге асты. Заттарды күйдіру үш сатыда жүрді.
Синтез шарттарын анықтау мақсатында бастапқы компоненттерге термиялық анализ жүргізілді.
«Паулик-Паулик-Эрдей» жүйесінде термиялық анализ Q-1000 дериватографында жүргізілді. Қыздыру 5 0 С/мин. Жылдамдығы 2, 5 мм/мин. Эталондық үлгі ретінде күйдірілген алюминий (ІІІ) оксиді алынды.
Бастапқы заттардың дериватограммаларына сүйенетін болсақ, Bi 2 O 3 дериватограммасында 2 эндотермиялық эффект байқалады: 1-шісі 720 0 С-да - бұл кезде α→δ полиморфты ауысу жүреді. Ал 2-ші эндоэффект 825 0 С-да - висмут (ІІІ) оксиді балқиды.
ДТА нәтижелері бойынша сілтілік-жер элементтері (Са және Sr) карбонаттарында 1 эндоэффект бар. Ол ТГ нәтижелері бойынша жоғарыдағы тұздардың ыдырауына сәйкес келеді.
СаСО 3 = СаО + СО 2 ↑
SrСО 3 = SrО + СО 2 ↑
Ыдырау температурасы анықтамалардағы келтілулермен (920 0 С) үйлеседі.
СЖЭ оксидтері 1000 0 С-ға дейін өзгеріссіз қалады, мұның өзі лантаноидтар оксидтерінде полиморфтық фазалар өзгерістердің жоқтығын байқатады.
Бастапқы заттар ретінде R 2 O 3 «химиялық таза», МеСО 3 (Ме-Са, Sr) «таза» және Bi 2 O 3 «химиялық таза» маркалы оксидтер алынды.
Синтез барысында жүретін реакцияның жалпы үлгісі:
R 2 O 3 + 2 МеСО 3 + Bi 2 O 3 = 2 RМeBіO 4 + 2СО 2 ↑
Стихиометриялық есептелінген үлгілерді ең жоғарғы дәлдікпен (0, 0001г. дейінгі) аналитикалық тарзыда өлшеп, араластырып, ұнтақтап, алунд тигеліне салдық.
Бірінші сатыда үлгілер 650 0 С температурада 10 сағат, екінші сатыда 800 0 С температурада 48 сағат муфель пешінде атмосфералық ортада ұсталынды. Үшінші сатыда температураны 12 сағат 1000 0 С-да ұстадық. Үлгілерді пештің ішінде суыттық. Суыған үлгілерді алып, мұқият үгітіп, физика-химиялық анализдер жүргіздік.
Синтездеу жағдайы Тамман шарты бойынша, реагенттердің балқу, температурасына жеткізбей, фазалар бірдей күйде болатын жағдайда өткізілді. Күйдірілген үлгілер пештің суу режимінде сұйытылды.
2. 2. Висмутиттерді рентгенографиялық зерттеу әдістемесі
Синтезделген үш жүйелі қоспалар үлгілерін фазалы-құрамдық зерттеудің негізгі әдістерінің біpі - рентгенофазалық анализ.
Үлгілерге рентгенофазалық анализ СиК а сәулесімен түсірілді. Жазықтықтар арақашықтығы Вульф-Брэгг теңдеуі бойынша есептелінді:
n
\[\operatorname{\mathcal{A}}\]=2dsіn\[\theta\qquad\]мұндағы:
\[\mathcal{A}\]- СиК а сәулесінің толқын ұзындығы 1, 5418Å ;n-сыну көрсеткіші;
\[\theta\]-рентген сәулелерінің түсу және шағылу бұрыштары;d-жазықтықтар арақашықтығы
Сызықтардың қарқындылығы, ықтималдық сызығы бойынша ең биік шыңды сызықпен 100 баллдық шкала бойынша есептелінді. Есептеулер компьютерде арнайы бағдарламаны қолдану арқылы жүзеге асырылды.
Рентгенограмманы түcіpy кезінде ішкі стандарт ретінде натрий хлориді қолданылды. Ол дифракциялық бұрышты 0, 05 (43) -ке дейінгі дәлдікпен өлшеуді қамтамасыз етеді.
Қатты фазалар синтезімен алынған күрделі висмутиттер жүйесінің құрамын, сингония типін және элементар ұяшық параметрлерін анықтау мақсатында синтезделініп алынған висмутиттерге ДРОН-2 құрылғысында рентгенографиялық зерттеулер жүргізілді.
2. 3. Пикнометрлік тығыздықты өлшеудің әдістемесі
Рентігендік зерттеулердің нәтижелерін нақтылау үшін, пикнометрлік және рентгендік тығыздықтардың мәндерін анықтауға 1мл көлемді пикнометр және аналитикалық таразы пайдаланылды (0, 0001 г дәлдікпен) .
Әдістің жүру барысы:
•бос пикнометр өлшенді (М о ) ;
•пикнометр дистилденген сумен өлшенді (M 1 ) ;
•пикнометрлік сұйықпен (толуолмен) өлшенді (М 2 ) ;
•пикнометр зерттелетін затпен өлшенді (М 3 ) ;
•зерттелетін заттың үстіне пикнометрлік сұйықтық құйылып өлшенді (М 4 ) .
Содан кейін заттың тығыздығы мына формуламен анықталды:
ρ= М 3 - М 0 .
М 1 - М 2 - М 4 - М 3
ρ 1 ρ 2
мұндағы: ρ 1 - 20 0 С температурадағы судың тығыздығы (0, 9983г/см 3 )
ρ 2 - пикнометрлік сұйықтың тығыздығы.
Пикнометрлік сұйыктың тығыздығы келесі формуламен анықталады:
ρ = М 2 - М 0 · ρ 1
М 1 - М 0
Рентгендік тығыздықты дайын формула бойынша алынған
рентгенографиялық мәліметтерді қолданып есептедік:
Р рент = 1, 66 ∙ М r · Z
V тор
мұндағы: Z-формуладағы бірлік саны
V тор -элементар ұяшықтың көлемі
М r -қосылыстың молекулярлы салмағы.
2. 4. Висмутиттердің топологтық құрылысын анализдеу
Атомдардың әр жұбының атомаралық ара қашықтықтары 0, 05-0, 1 Ǻ дәлдікте сақталатынын күрделі висмутиттердің құрылысын анализдеу барысында байкадық және оның нақты құрылысқа әcepі өте аз. Бұл белгі синтезделген және болжап отырған кристалдардың құрылымында ортақ заңдылықтың бар екендігін білдіреді. Осыны негіздей отырып, жаңа химиялық қосылыстардың кристаллохимиялық құрылыстарын болжауымызға болады.
2. 5. Висмутиттердің жылу сыйымдылықтарын калориметриялық әдіспен анықтау
Температураға тәуелді қатты заттардың жылу сыйымдылықтарының өзгерісін және катиондар алмасқан кезде энергияның өзгерісін бақылау үшін қатты денелердің термодинамикалық қасиеттеріне калориметриялық өлшеу әдістері қолданылды [20] .
Бірқатар конструкциялық, магниттік және сегнетоэлектрлік материалдар арнайы термиялық өңдеу тәртібінің әсерінен термодинамикалық тұрақсыз күйде болады. Әртүрлі қолдану жағдайларында бұл материалдардың бастапқы қасиеттері мен өлшемдері өзгереді. Бұл процестер, заттың термодинамикалық тұрақты күйге көшуі үшін, белгілі 6іp жағдайда түзілген құрылысқа ұмтылуынан туады. Ол процесс калориметриялық өлшеу әдістері арқылы тіркеледі [21] .
CaO-R 2 O 3 -Bі 2 O 3 және SrO-R 2 O 3 -Bі 2 O 3 жүйесінде түзілген қосылыстардың (барлығы 22) жылу сыйымдылықтарын анықтау жұмысы қатты және ұнтақ заттардың температураға тәуелді салыстырмалы жылу сыйымдылықтарын зерттеуге арналған ИТ-С-400 сериялы калориметрінде 298, 15-673К температура аралықтарында жүргізілді. Температураны өлшеу аралығы 25 0 С-дан 400 0 С-ға дейін. Жылу сыйымдылығының өлшеу процесі барлық температура интервалдарында 2, 5 сағат жүреді. Аспаптың қателік шегі 10%-дан аспайды [22] .
Тәжірибені жүргізер алдында кептірілген алюминий (ІІІ) оксиді арқылы калориметрге дәлдеу жасалды. А1 2 О 3 қосылысының калориметрде анықталған қалыпты жағдайдағы жылу сыйымдылығы (79, 0 Дж/(моль-К) анықтамалық деректермен жақсы үйлеседі (76, 0 Дж/(моль-К) . Жылу өлшеуіштің жылуды өткізуін (К т ) тәжірибелік анықтадық:
К т = С (сал. зат (мыс) .
\[\overline{{T}}\](сал. зат) -\[\overline{{T}}\]0 Т
мұндағы:
С (сал зат(мыс) ) - салыстырмалы заттың толық жылу сыйымдылығы,
(Дж/К-кг) ;
\[\overline{{T}}\](сал. зат. ) жылу өткізгіштегі салыстырмалы заттың тәжірибе кезіндегікешігу уақытының орташа мәні, (с) ;
\[\overline{{T}}\]Т 0 -жылу өткізгіштігі бос ампуламен тәжірибе кезіндегі кешігу уакытының орташа мәні, (с) .Салыстырмалы заттың С (сал. зат) толық жылу сыйымдылығы келесі формуламен есептеледі:
С (сал. зат) = С мыс · m С
мұндағы:
С мыс - мыстың анықтамадағы салыстырмалы жылу сыйымдылығының
мәні, (Дж/К- кг) ;
m с -салыстырмалы мыс затының массасы, (кг) .
Зерттеліп отырған заттың жылу сыйымдылығы мына формуламен
есептеледі:
С (сал) =К (
\[\overline{{T}}\]т -\[\overline{{T}}\]т 0 ) / m 0мұндағы:
С( сал . ) - заттың меншікті жылу сыйымдылығы, (Дж/К-г) ;
К т - жылу өлшеуіштің жылу өткізгіштігі;
m о -зерттелетін заттың массасы, (г) ;
\[\overline{{T}}\]т -жылу өлшеуіштегі зерттелетінзатпен тәжірибе кезіндегі температураның кешігу уакыты, (с) ;
\[\overline{{T}}\]т - жылу өткізгіштегі бос ампуламен тәжірибетемператураның кешігy уакыты, (с) .
Жылу сыйымдылықтың мольдік мәні (С м ) келесі формуламен есептеледі:
С M = C cал ∙ М
мұндағы: М- заттың молярлы массасы, (г/моль) .
Әpбіp температуралық аралықта бес тәжірибе жүргізілді, алынған нәтижелер ортақтастырылып, математикалық статистика әдісімен өңделді.
Әpбіp температурадағы салыстырмалы жылу сыйымдылығының ортақтастырылған мәндері үшін орташа квадраттың ауытқулары (δ) есептелінді:
n
\[\otimes\]= √ Σ _ (С 1 - С орт ) 2 _n-1 n - 1
мұндағы:
n-тәжірибе саны;
С 1 -салыстырмалы жылу сыйымдылығының өлшенген мәндерінің
орташа мәні, (Дж/моль-К) ; .
С орт . - салыстырмалы жылу сыйымдылығының өлшенген мәндерінің
орташа мәні, (Дж/моль-К) .
Содан кейін, мольдік жылу сыйымдылығының ортақтастырылған мәндерінің кездейсоқ ауытқулары есептелінеді:
∆ 0 = δ ∙ t р ·100
С орт
мұндағы:
t P - Стьюдент коэффициенті (n=5; табиг. =0, 95; tp=2, 57) .
Жүйелік ауытқушылық келесі формуламен есептелінеді:
∆ = С орт - С 0 . 100
С 0
мұндағы:
\[\Lambda_{\bf d}\]с -жүйелік ауытқушылық, %;С о - сыйымдылығы аныкталған температура кезіндегі салыстырмалы заттың жылу сыйымдылығының мәні, (Дж/(г-К) .
Жіберілетін ауытқушылық шегі келесі формуламен аныкталады:
∆ = ∆ с ± ∆ 0
Біздің жағдайымызда жүйелі ауытқушылық (
Берілген мәліметтерді ыңғайлы қабылдау үшін орташа квадратты ауытқу (
\[\bigotimes\]) (Дж/(г-К) түрінде, ал кездейсоқ ауытқушылық (\[\Lambda_{\bf B}\]о ) (Дж/(моль-К) түрінде көрсетілді.Зерттелетін заттардың жылу сыйымдылықтарының температураға тәуелді теңдеулеріндегі қателіктерін анықтағанда қарастырылып отырған барлық температура интервалдарында орташа кездейсоқ қателіктері қолданылған. Зерттелетін заттардың стандартты энтропиясының қателіктері, солардың құрамына кіретін, ион инкременттерінің қателіктерінен анықталады.
Жылу сыйымдылығының тәжірибелік мәндері арқылы 298, 15-673К аралығындағы температураға тәуелді полином теңдеуін қорытып шығарып, оның көмегімен кез-келген температурадағы жылу сыйымдылығының есептелген мәндерін табуға болады.
III. НӘТИЖЕЛЕРДІ ТАЛҚЫЛАУ
3. 1. Висмутиттердің кристаллохимиялық құрылысының нәтижесі.
Синтезделген фазалар ұнтақтарының рентгенограммалары көлемі центрленген кубты торда индицирленді, осы типтес кристалдық торда кристалданатынын Миллер индекстерінің квадраттарының қосындысының (h 2 +k 2 +l 2 ) жұп нәтижелі сандары дәлелдейді [24] .
Рентгенограммаларды индицирлеу нәтижелерінің дұрыстығын жазықтықаралық ара қашықтықтың квадратының кepі шамасының эксперименталды және теориялық мәндерінің сәйкестігі дәлелдейді [25] .
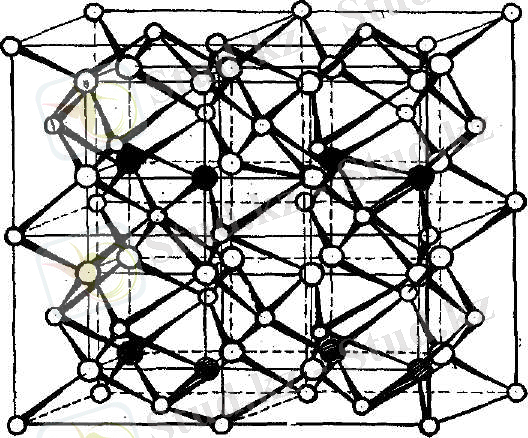
О - СЖЭ; • - Са, Sr; ® - висмут; О - оттегі
Сурет 1 - RMeBіO 4 құрылысы
Қатты фазалар синтезімен алынған күрделі висмутиттер кубтық сингонияда кристалданып, элементарлы ұяшықтар көрсеткіштері сирек-жер металдары қатары бойынша азаяды, ал тығыздықтары артады.
РФА нәтижелері барлық синтезделген фазалардың изоқұрылысты және формулалық бірлігі 16-ға тең кубты көлемі центрленген торда кристалданатындығын көрсетті. Кристалдық тор сегіз флюорит
типтес ұяшықтардан құралып, металл-оттегі қабаттарымен кезектесіп, қайталанып отырады (сурет 1) .
Кристаллохимиялық сипаттамалардың дұрыстығына рентгендік және тәжірибелік тығыздықтардың жуық шамада сәйкестігі толығымен дәлел болады [26] .
Синтезделініп алынған қоспалардың тәжірибелік тығыздықтары пикнометр әдісі бойынша анықталды. Индифферентті сұйықтық, ретінде толуол таңдалып алынды. Ceбeбі, ол зерттеліп отырған қосылыстарға химиялық инертті және оның тығыздығы температураға байланысты мүлдем аз өзгереді.
RMeBіO 4 қосылысының кристалдық ұяшық параметрлерін иондар радиусы арқылы сызықты теңдеу түрінде сипаттауға болады. Егер құрамында бірдей иондары бар құрылыстары изоқұрылысты өкілдерді қарастырсақ формулада бірдей мүшелер пайда болады [27] .
СЖЭ оксидтері қатарынан кейбіреулерінің жоқтығына байланысты, синтезделініп алынбаған фазалардың элементар ұяшықтар параметрлерін анықтау үшін біз теңдеулер жүйесін құрдық:
... жалғасы
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz