Коллоидты ерітінділер: мицелла құрылымы, қос иондық қабат және тұрақтылық


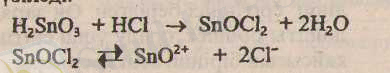
ерітіндісі түзіледі.
SnО 2+ иондары қалайы қышқылына адсорбцияланып заряд береді де, оны ерітіндіге көшіреді. Коллоидты бөлшек мицелласы:
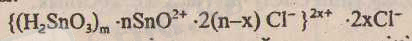
Егер, пептизатор ретінде натрий гидроксидінің ерітіндісі пайдаланылса, онда коллоидты бөлшек теріс зарядқа ие болады.
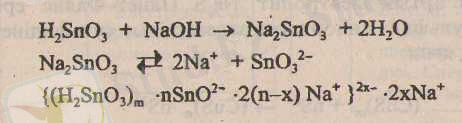
4. 4. 4. Коллоидты ерітіндідегі дисперсті фаза құрылымы
Коллоидты ерітінділердің кәдімгі ерітінділерден басты айырмашылығы, онда еріген зат бөлшектерінің ірі болып келуі дедік. Ерітілген зат бөлшектері коллоидты ерітінді құрамында мицелла түрінде ұшырасады. Жалпы, коллоидты ерітінді құрамындағы бөлшектер құрылымын оларды химиялық конденсация жолымен алу барысында әңгімеледік. Есімізге түсіру үшін хлорлы күмістің судағы зольін қарастыралық.
- Күміс нитраты артық алынған жағдайдағы бөлшек құрылымы:
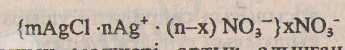
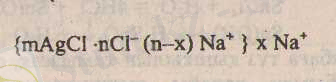
- Ас тұзының мөлшері артық алынған жағдайдағы бөлшек құрылымы.
Мұндағы mAgCІ -
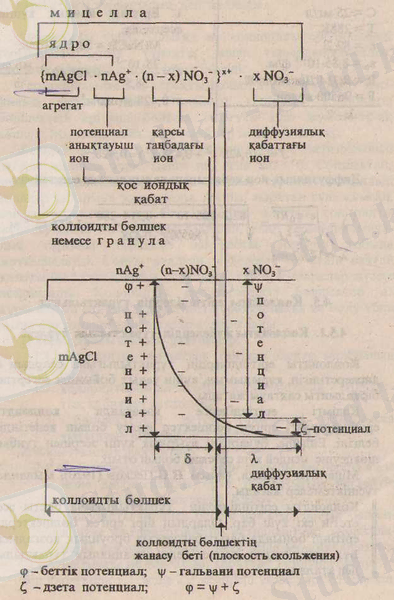
mAgCІ nAg немесе агрегат деп аталынады. Кейбір оқулықтарда mAgCІ ядро деп те аталынады.
mAgCІ nCl - коллоидты ерітінді бөлшегінің ядросын құрайды.
Агрегатқа тартылған иондар потенциал анықтауыш иондар деп аталынады да ядроға φ-ге тең потенциал береді.
Потенциал анықтауыш ионға қарсы таңбадағы қос иондық қабат түзуге тартылған иондар - қарсы таңбадағы иондар (противоионы) деп аталады. Қарастырылып отырған бірінші жағдай үшін қарсы таңбадағы иондар NO 3 . aл екінші жағдайда Nа + .
Потенциал анықтауыш иондар мен қарсы таңбадағы иондар коллоидты бөлшектің қос иондық қабатын құрайды. Ядро және қарсы таңбадағы иондар құрылымы коллоидты бөлшек немесе гранула деп аталады. Коллоидты бөлшек заряды потенциал анықтауыш ион зарядымен анықталады.
Қос иондық қабат бөлігінде қарсы таңбадағы иондар саны потенциал анықтауыш иондар санынан кем болады.
Қарсы таңбадағы иондардың жетіспейтін шамасы қос иондық қабаттың сыртында орналасқан диффузиялық қабатта болады.
Қос иондық қабаттың қалыңдығы "5", ал диффузиялық қабат қалыңдығы "X. " деп белгіленеді.
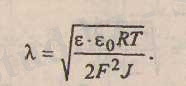
Диффузиялық ион қабатының қалыңдығы төмендегі формула бойынша есептелінеді:
Мұндағы: £ - диэлектрлік өтіміділігі;
бо = 8, 85-10~ 12 ф/м - электрлік тұрақты шама; К, Т - универсалды газ тұрақтысы және температуа; Ғ - Фарадей саны, 96500 кулон; I - ерітіндінің иондық күші.
Коллоидты бөлшек және диффузиялық қабаттағы иондар коллоидты ерітіндінің мицелласын құрайды. Мицелла электр бейтарап бөлшек.
Коллоидты бөлшектің қос иондық қабатындағы қарама-қарсы иондарға қарағанда потенциал анықтауыш иондарының артығы дзета потенциал немесе электростатикалық потенциал шамасын білдіреді.
Демек, дзета потенциал коллоидты бөлшек пен диффузиялық ион қабаты арасында туындайды. Дзета потенциал £- таңбасымен белгіленіп, оң да теріс те мәндерге ие бола береді. Коллоидты бөлшектің қос иондық қабатында потенциал анықтауыш иондар саны мен қарама-қарсы таңбадағы иондар саны тең болса, дзета потенциал мәні нольге айналып, оны-изоэлектрлік күй-деп атайды. Мицелла құрылымы хлорлы күміс зольі негізінде 4. 1 -схема түрінде келтірілген.
1 - мысал.
Барий сульфатының коллоидты ерітіндісі алынды. Коллоидты ерітіндідегі электролит - ас түзының концентрациясы 25 мг/л. Ерітіндінің диэлектрлік өтімділік шамасы 82, 2, ал температурасы 288К. Диффузиялық қабаттың қалыңдығы қандай?
Талдау.
Барий сульфатының ерітіндісінің мицелласы:
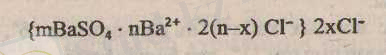
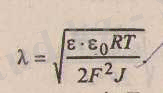
Диффузиялық қабаттың қалыңдығын анықтайтын формуланы еске түсіреміз:
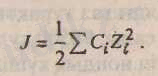
Ерітіндінің иондық күші Льюис-Рэндалл формуласы бойынша есептеледі, яғни:
Енді есептің берілгенін жазып алып, диффузиялық қабат қалыңдығын есептеуге болады.
4. 1- схемасы. Хлорлы күміс мицелласы, құрылымы
м и ц е л л а

4. 5. Коллоидты ерітінділердіц тұрақтылығы
4. 5. 1. Коллоидты жүйелердің тұрақтылық түрлері
Коллоидты ерітінділердің тұрақтылығына олардың өз дисперстілігін, құрылымын, күйін уақыт бойынша өзгертпей бірқалыпты сақтауы жатады.
Кәдімгі ерітінділерге қарағанда коллоидты ерітінділердегі еріген бөлшектер ірілеу болып келетіндігі белгілі. Ендеше, бұлардың ауырлық күші әсерінен тұнбаға шөкпсуіне нендей күш себепші болып отыр.
Міне, бұл сүраққа, ғалым Н. П. Песков (1920), мынандай түсініктемелер жасады.
Коллоидты ерітінділердің тұрақтылығына басты әсер ететін екі күш бар. Олардың бірі еріген бөлшектердің ерітінді бойында бағыт-бағдарсыз броундық қозғалысы.
Бұл кинетикалық немесе седиментациялық тұрақтылық деп аталады.
Екіншісі - коллоидты бөлшектердің өз құрылымы, дисперстілігін өзгертпсй сақтауы. Бұл құрылымдық немесе агрегативті тұрақтылық деп аталады.
Агрегативті тұрақтылыққа ие коллоидты ерітінділерді термодинамикалық тұрақты және термодинамикалық тұрғыда тұрақсыз деп екі түрге бөледі.
Термодинамикалық тұрақты коллоидты ерітінділер лиофильді зольдер деп аталынып, олардың коллоидты бвлшектері еріткіш бойына сырттан күш жұмсамай-ақ көшеді. Мысалы, шайырлар, майлар және т. б. заттар.
Аталған зольдер түзілу барысында Гиббс энергиясының өзгеріс шамасы теріс мәнге ие, яғни ДС< 0. Сондықтан, мұндай жүйелерді термодинамикалық тұрақты лиофильді зольдер қатарына жатқызады. Ал біз, сырттан күш жұмсап, өзіміз ұнтақтап немесе ірілендіріп алатын коллоидты жүйелерімізде АС> 0 болғандықтан, олар термодинамикалық тұрғыда тұрақсыз лиофобты зольдер тобына жатқызылады. Соңғы аталған жүйелерге өз күйін сақтап қалатындай тұрақтылық беру үшін, түрлі іс-шаралар жүзеге асырылады. Коллоидты ерітінділердегі бөлшектер өз құрылымын сақтап, агрегативті тұрақтылыққа ие болу үшін мына факторларға баса назар аударылады.
1. Термодинамикалық факторлар:
1. 1. коллоидты бөлшектің бетінде электр зарядының болуы;
1. 2. коллоидты бөлшектердің адсорбциялық - сольваттық қабатпен қапталуы;
1. 3. бөлшектердің ретсіз броундық қозғалысқа үмтылуы- энтропиялық фактор.
2. Кинетикалық факторлар:
2. 1. жүйе түтқырлығын өзгерту арқылы дисперсті фаза жәнедисперсионды орта тығыздығын реттейтін гидродинамикалық эсерді ескеру;
2. 2. коллоидты бөлшек бетіне арнайы беттік белсен-ділікке ие (поверхностно активные) зат молекула-лары арқылы серпімділікке жәнемеханикалық бе-ріктілікке ие қорғауыш қабаттар түзілуін ескеру.
Бір қарағанда 1. 2 және2. 2 эсерлері ұқсас көрінуі мүмкін.
Агрегативті тұрақтылық беретін 1. 2 - әсср коллоидты бөлшекке адсорбцияланған иондардың еріткіш молекулаларымен сольваттануы арқылы түзілетін қабат. Ал 2. 2 түрдегі әсер - сырттан коллоидты жүйеге қосымша қосылатын беттік белсенділікке ие заттар, яғни стабилизаторлар қосу арқылы қорғауыш қабатының түзілуі.
Мысалы, кремний диоксидінің зольін тұрақтандыру үшін желатина ерітіндісін қосады. Коллоидты бөлшектер беті -соңғы зат түзетін қабықшамен қапталады. Бұл қабықшалар қалыңдығы 1 нм, яғни мономолекулалық қалындыққа сәйкес келеді. Осындай түрдегі қабықшалар коллоидты бөлшектердің бір-біріне қосылып кетпеуіне себепші болады.
Р. Зигмонди деген ғалым осы тақілеттес заттардың коллоидты бөлшектерді қабықша түзіп қорғауын санды түрғыда сипаттау үшін "алтын саны" деген көрсеткіш енгізді.
Алтын ұнтағынан түзілген коллоидты ерітіндінің түсі қызғылт болып кследі. Коллоидты жүйеде аздаған өзгеріс болса әлгі золь лезде ауа көк түске боялады, яғни өте сезімтал.
Міне осындай қорғауыш қабат түзетін қасиетке ие заттардың зольдерді қорғау қабілетін анықтауға алтын ұнтағынан түзіжен золь пайдаланылады.
Алтынның қызыл түсті 10 мл зольіне 1 мл 10% ас түзы ерітіндісін құйғанда, "оны ұйытпай, яғни ауа көк түске өткізбей қорғап тұратын, қорғауыш қабат (пленка) түзетін заттың ең аз шамасы (мг) сол заттың алтын саны деп аталады.
Алтын санының шамасы неғұрлым аз болган сайын, ол зат солғұрлым жақсы қорғауыш қабілетке ие екендігін қөрсетеді. Аталған заттар қатарына крахмал, гемоглобин, желатина сияқты көптеген дүниеліктер жатады.
Мысалы, желатинаның алтын саны 0, 01 мг -ға тең болса, крахмал үшін бұл көрсеткіш 20 -ға теңеледі.
Коллоидты ерітінділердің өз тұрақтылығын сақтауында қорғауыш заттардың алар орыны ерекше. Мысалы, адам бойындағы қан құрамында нашар еритін кальций фосфаты, карбонаты коллоидты бөлшектер түрінде ұшырасады. Осы
сияқты бөлшектердің сырты белоктық немесе осы тұрғыдағы заттармен қаптальш келеді. Кейбір науқасқа шалдыққан кезде адам қанының құрамында қорғауыш қабықша түзетін заттар азаяды да, әлгідей тұздар өзара бірігіп тұнбаға шөгеді. Осының салдарынан буын-буында, бүйректе, бауырда тас тәріздес шөгінділер пайда болады. Көп жағдайларда қолданыс табатын-колларгон, протаргол-сияқты дәрі-дәрмектердің қорғауыш қабат түзетін қасиеттері бар.
Сонымен, коллоидты ерітінділердің өз күйін сол қалпында сақтауын сипаттайтын көрсеткіштер қатарына олардың кинетикальщ және агрегативті немесе құрылымдық тұрақтылыңтары жатады.
Аталған көрсеткіштердің, езара, кейде бір-біріне қарсы әсері барын да ескерген жөн.
Мысалы, кез-келген сүйыққа жылу түрінде энергия берілсе, ол осы жүйе бөлшектерінің қозғалысын арттырады, яғни температурасын жоғарылатады. Қозғалыс артуы нәтижесінде бөлшектердің өзара соқтығысуы жиілейді. Өзара соқтығысқан бөлшектер қосылып, . іріленуі ықтимал, Соңғы жағдай бөлшектердің құрылымы өзгергенін, яғни агрегативті тұрақтылықтың төмендегеніне сэйкес келеді. Іріленген бөлшектер ауырлық күшінің эсерінен ыдыс түбіне шөге бастайды.
Көптеген коллоидты ерітінділердің қыздыру барысында. лайқаланып. тұрақсыз күйге көшетіндігін жиі ұшырастыруға болады.
4. 5. 2. Коллоидты ерітінділердің кинетикалык тұрақтылығы
Физика курсынан мынандай жайттар белгілі. Егер, тұтқырлығы г\- ға тең сұйық бойында радиусы г - ге тең шар тәріздес бөлшектер ерітілген болса, онда олар өз ауырлық кушінің әсерінен, шөгу барысында, сұйық бойынан ке тең қарсы кедергі күшін сезінеді, яғни:
Сұйықтың тығыздығьш "р", ал ерпілген заттың тығыздығын "<Г, еркін түсу үдеуін"§" деп қабылдасақ, әрбір шар тәріздес бөлшектің салмағы мына формулалар арқылы анықталар еді:
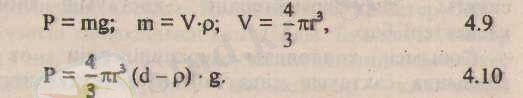
Сүйық бойындағы кедергі "Ғ" күші мен олардың ауырлық "Р" күші тең болса, ерітінді бойында мына теңдік орынды:
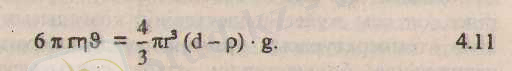
Осы теңдіктен қозғалыс жылдамдығы "&" шамасын анықталық:

Мұндағы: г - ерітіндідегі еріген бөлшектер радиусы;
ё - ерітілген зат тығыздығы;
р - еріткіш тығыздығы;
§ - еркщ түсу үдеуі;
г\ - ерітінді түтқырлығы.
1. 4. 12 теңдіктен ерітілген зат тығыздығы еріткіш тығыздығынан кіші болса (сі-р < 0) өрнек теріс мәнге ие бо-лады. Бұл теріс мэн, ерітілген бөлшектердің ыдыс түбіне шөгу орнына ерітінді бетіне жиналуға үмтылатындығын білдіреді. Мысалы, су бойында еріген бензин, керосин, май түйіршіктері
2. 4. 12 теңдіктегі д-р > 0 болса, онда коллоидты ерітінді бөяшсктері ыдыс түбіне щөгуге үмтылады.
Лл-, бөлщектердің қозгалыс жылдамдығының шамасы оның ірілігіне, яғни радиусының квадратына қарайлас болып келеді, сондықтан аталған шаманың коллоидты ерітшді тұрақтылығын сақтауда айырықша орын алатындығын ескерген жөн.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz