Ерітінділердің қасиеті мен құрылымы: электролиттік диссоциация, химиялық теория және концентрация


Жоспар
Кіріспе
Негізгі бөлім
1 Ерітінділердің қасиеті мен құрамы
2. С. Аррениустың электролиттік диссоциация теориясы.
3 Ерітінділердің химиялық теориясы.
4 Ерітінділердің концентрациясы
Қорытынды
Пайдаланылған әдебиеттер
Кіріспе
Ерітінділер- кем дегенде екі құрамдас бөліктерден тұратын құрамы өзгермелі гомогенді (біртекті) жүйелер. Ерітінділер газ тәрізді, сұйық және қатты болуы мүмкін. Олардың ішінде жан-жақты зерттелгені және жиі қолданылатыны сұйық, әсіресе, сулы ерітінділер. Сондықтан тұрмыста ерітінділер деп, көбінесе, сұйық күйдегі молекула-дисперстік жүйелерді айтады. Ерітінділердің құрамы құрамдас бөліктердің конценрацияларымен сипатталады. Ерітінділер қаныққан, қанықпаған және аса қаныққан деп бөлінеді. Берілген температурада жақсы еритін заттардың ерігіштігінің де шегі бар. Еріген заттың концентрациясы белгілі бір мөлшерден асқанда, оның артығы ерімей, ерітіндінің түбіне шөгеді. Бұл кезде ерітінді мен еріген зат тепе-теңдік жағдайда болады. Мұндай ерітінділерді қаныққан ерітінділер, ал концентрациялары қаныққан ерітіндінің концентрациясына дейінгі барлық ерітінділерді қанықпаған ерітінділер деп атайды. Кейбір еріткіштің белгілі бір мөлшерінде еритін заттың ерігіштігіне сәйкес мөлшерінен де артық мөлшерін ерітуге болады. Мұндай ерітінділер аса қаныққан ерітінділер деп аталады. Аса қаныққан ерітінділердің тұрақтылығы нашар болады. Кез келген сыртқы әсерден еріген заттың артық мөлшері ерітіндіден бөлініп, тұнбаға түседі. Сөйтіп аса қаныққан ерітінді жай қаныққан ерітіндіге айналады. Кей заттар ерігенде олардың молекулалары иондарға ыдырайды, яғни диссоциацияланады. Электр тогын өткізетін болғандықтан, ондай заттардың ерітінділерін электролит ерітінділері деп атайды. Оған көптеген қышқылдар мен негіздердің, әсіресе, тұздардың ерітінділері жатады. Керісінше, ерігенде молекулалары иондарға ыдырамайтын, сондықтан электр тогын өткізбейтін заттардың ерітінділері бейэлектролиттердің ерітінділері деп аталады.
1 Ерітінділердің қасиеті мен құрамы
Ерітінді деп екі немесе бірнеше компоненттен тұратын гомогенді системаларды айтады. Әдетте ерітінділердің тығыздығы, қайнау және қату температурасы, тұтқырлығы сияқты касиеттері өзгеріп отырады. Ерітінділерді жай механикалық қоспа деп те, химиялық қосылыс деп те қарастыруға болады.
Ерітіндінің механикалық қоспадан басты айырмашылығы ондағы әрбір микроскопиялық (өте кіші, ұсақ) бөлшектерді химиялық құрамы мен физи-калық қасиеттерінің көлемде бірдей болуында. Ал химиялық қосылыстардан негізгі өзгешелігі оның құрамында еритін зат көп еріткіштің мөлшеріне тәуелділігінде және еселік қатынас заңына бағынбауында. Мысалы, ас тұзы суда тек белгілі мөлшерде ғана ериді. Айталық, 20°С (293Қ) -та алынған 100 мл суда ас тұзының 36, 8 грамы ғана ериді де, одан әрі оның мөлшерін қанша көбейтсек те ол ерімейді. Бұл қалыпты жағдайда кездесетін құбылыс. Ерітіндінің химиялық қосылыстан тағы бір өзгешелігі - химиялық байланыс табиғатында. Егер химиялық қосылыстар негізінен ионды, ковалентті байланыстармен сипатталса, ерітіндідегі байланыс, газдарда кездесетін аса әлсіз ван-дер-ваальстік, ал кейбір жағдайларда қосымша сутектік байланыстармен түсіндіріледі.
Жай қоспалардағы заттар өзара ешбір байланыссыз-ақ араласса, ерітіндідегі еріткіш пен еритін заттар арасында әлсіз болса да химиялық байланыс болады. Мысалы, бірдей өлшемдегі құм мен ағаш немесе темір үгіндісін араластырса, қоспа пайда болады және оларды бір-бірінен бөлуге болады. Ал, ас тұзын немесе қантты су да ерітсе, олар оңайлықпен әуелгі жеке заттарға бөлінбейді.
Еріткіші су болатын ерітінділер табиғатта кең тараған. Жер қыртысындағы, өсшдіктер мен тірі организмдердегі процестер су-сыз жрмейді. Осыдан ерітінді дегешміз жай ғана құбылыс емес, ол өте күрделі физикалық және химиялық касиеттері бар күрделі құбылыс екенін көреміз.
Еру процестері кейде жылу бөліну арқылы жүрсе, енді бірде жылу сіңіру арқылы да жүреді, яғни зат қыздырғанда ғана ериді.
Сондай-ақ кей заттарды еріткенде ерітіндінің көлемі кемуі немесе артуы мүмкін. Мысалы, күкірт қышқылын не натрий гидроксидін суда еріткенде едәуір жылу бөлінеді. Бұл еріген зат пен еріткіш арасында химиялық реакцияның жүргендігін көрсетеді. Бұл процесті сольватация, ал пайда болған қосылысты сольват дейді. Зат суда еритін болса, процесс, гидратация, қосылыс гидрат делінеді.
2. С. Аррениустың электролиттік диссоциация теориясы.
Швед ғылыми С. Аррениус 1887жылы электролиттік диссоциация теориясын пәнге енгізген. Онда: электролиттер - негіздер, қышқылдар, тұздар балқығанда немесе суда ерігенде оң және теріс иондарға ыдырайды. Электролит молекулаларының иондарға ыдырау процесін электролиттік диссоциация деп аталады.
Оң зарядталған иондар - катиондар, теріс зарядталған иондар - аниондар деп аталады. Ерітінділерде оң зарядты және теріс зарядты иондардың болуы оның электр тогын өткіздің қамтамасыз етеді. Электролиттерге молекулаларында иондық немесе полюті байланысы бар қосылыстар жатады.
Қазіргі көзқарас бойынша электролитік диссоциация - электролит молекулаларының еріткіш судың полюсты молекулаларымен әрекеттесуі нәтижесінде жүретін күрделі процесс. Мысал ретінде бромсутек қышқылын полюті молекуласының иондарға ыдырауын қарастырайық
HB + H 2 O H + * m H 2 O +B * nH 2 O
Бромсутек қышқылы су молекулалармен әрекетесудің нәтижесінде әуелі полюсті молекулалардан ионды молекулаға, одан соң гидроттанған жеке иондарға айналады.
Диссоциация процесі қайтымды болғандықтан, теңдіктің орнына қарама - қарсы бағытталған стрелкалар қойылады. Электролиттердің судағы ертінділерінде иондарға ыдырауына судың диэлектриктік тұрақтысы үлкен әсер етеді және оны мына формуладан көруге болады.
F
;
Мұндағы F - зарядталған иондардың бір -біріне тартылу күші, I 1 мен I 2 -зарияттардың мөлшері, τ -иондардың арақашықтығы, Е - судың диэлектірлік тұрақтысы.
Судың диэлектірлік тұрақтысы ерітіндідегі қарама -қарсы иондардың бір -біріне тартылу күші бос кеңістікпен салыстырғанда 80 есе төмендейтінін көрсетеді.
Қышқылдардың, тұздардың және негіздердің диссоциялануы.
Электролиттік диссоциациямен танысқаннан кейін электролиттерге негіздерге, қышқылдарға, тұздарға анықтама беруге болады.
Негіздер дегеніміз судағы ерітінділерде диссоциацияланып металдың катионына және гидроксидтің анионына ыдырайтын электролиттер. Мысал ретінде калий гидроксиді мен барий (II) гидроксидінің диссоциациясын көрсек болады.
КОН К + ОН -
Ва(ОН) 2 ВаОН + +ОН Ва +ОН
Негіздерде негіздік қасиетті гидроксид иондары береді.
Қышқылдар дегеніміз судағы ерітінділерде сутегінің катионына, қышқыл қалдығының анионына диссоциацияланатын қосылыстар. Мысалы:
НСI H + +CI
H 3 PO 4 H + +H 2 PO 4 2H + +HPO 2 4 3H + +PO 3 4
Қышқылдарға тән қышқыл дәм, көк лакмусты қызыл түске бояу, негіздермен әрекеттесіп тұз және су түзу сияқты қасиеттер ертіндіде сутегінің катиондары болуына байланысты.
Нағыз негіздермен қышқылдардан басқа амфотерлік гидроксидтер болады. Амфотерлік гидроксидтер нейтрал ортада бір мезгілде әрі негіздерше, әрі қышқылдарша иондарға ыдырайды. Мысалы:
Н 3 С О 3 Н + +Н 2 С 2 О 3 2Н + +НСО 2 3 3Н + +С 2 О 3 3
С (ОН) 3 С (ОН) 2 + +ОН С ОН 2+ +2ОН С +3 +3ОН
Тұздар деп суда ерітінділерінде металдың катиондарына, қышқыл қалдығының аниондарына ыдырайтын қосылыстарды атайды, мысалы:
Na NO 3 Na + + NO 3
AI 2 (SO 4 ) 3 2AI 3+ +3SO 2 4
Диссоциациялану дәрежесі.
Электролит суға еріп диссоциацияланған түзілген катиондар мен иондар көбейген сайын олар ерітінді ішінде кездесіп, бірін -бірі тартып ерген заттың молекуласын қайта түзеді, демек тролиттік диссоциациялану дейтініміз қайтымды процесс, мысалы:
диссоциациялану
NaCI Na +CI
молекулалану
Қайтымды процесс болғандықтан мұнда тепе -теңдік тууы керек. Тепе -теңдік туған жағдайда уиссоциаланбаған молекулалар және иондар саны тұрақты қалыпқа келеді: қорытып айтқанда еріген заттың молекулалары түгел диссоциацияланбайды.
Электролиттер табиғатына және олардың молекулаларындағы атомдарының арасындағы химиялық байланыстының беріктігіне байланысты электролиттер әр түрлі дәрежеде иондарға ыдырайды.
Электролиттердің иондарға ыдырау қабілетін сан жағынан диссоциациялану дәрежесі арқылы көрсетеді. Диссоцация дәрежесі дегеніміз - иондарға ыдыраған молекулалар санының жалпы ерітілген молекулалар саныға айтылады. Оны а әріпі мен белгілейміз.
d=
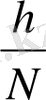 *100 %
*100 %
Мұнда. n -иондарға ыдыраған молекулалар саны
N- жалпы молекулалар саны.
Диссоциациялану дәрежесіне қарай электролиттер күшті және әрі әлсіз болып екіге бөлінеді. Әлсіз электролиттердің диссоциациялану дәрежесі 0, 3 яғни 30% болып иондарға өте аз ыдырайды. Мысалы NH 4 OH6 CH 3 COOH
Күшті электролиттер иондарға толық ыдырайды. Олардың диссоциациялану дәрежесі 1-тең. Мысалы барлық суда жақсы еритін тұздар, қышқылдар, сілтілер жатады.
(KCI. HNO 3. NaOH)
Диссоциация дәрежесінің мәні электролиттің табиғатына және ерітіндінің консентрациясына тәуелді шама.
Ерітіндінің консентрациясы артқан сайын диссоциациялану дәрежесі мәні төмендейді. Себебі ертіндің консентрациясы артқан сайын иондардың өзара әрекеттесуі өседіде молекулалар түзеді.
3. Ерітінділердің химиялық теориясы.
Д. И. Менделеев ерітінділерді зерттеуге 40жылдай ғылыми жұмысын арнаған оның ерітінділердің химиялық теориясы 1887ж жасалды және экспериментпен бекітілді.
Бұл теорияның негізгі шарты:
- Еру - ол, физика - химиялық күрделі процесс, оған энергияны жұмсауды талап ететін (∆H>0), бөлінуімен (∆H2<0) байланысқан, еріген заттың молекуласы мен еріткіш молекуласының әрекеттесуі енеді.
- Еру процесі экзотермиялық (мысалы, суда NaOH H2SO4ерігенде), эндотермиялық (мысалы, суда NH4NO3ерігенде) болуы мүмкін. Зат ерігенде бөлінетін жылуды еру жылуы деп атайды.
- Еріткіш пен еріген заттың химиялық әрекеттесуі нәтижесінде сольваттар немесе гидраттар (егер су еріткіш болса) түзіледі. Құрамында су молекуласы болатын кристалды заттарды криссталлогидраттар деп атайды.
Ал, кристаллогидрат құрамына енетін суды кристалдық су дейді. Табиғи минералдардың көпшілігі кристаллогидратқа жатады:
Na 2 SO 4 ∙10H 2 O - глаубер тұзы
KAl (SO 4 ) 2 ∙10H 2 O - алюминий ашутасы.
Сольваттар (гидраттар) донорлы - акцепторлық, ион - дипольдік әрекеттесу есебінен, сутектік байланыс, сол сияқты дисперсиялық әрекеттесу (мыс, бензол мен толуол ерігенде) есебінен түзіледі.
CuSO 4 - сусыз тұзы ақ түсті.
CuSO 4 ∙5H 2 O - көк түсті, оның спирттегі ерітіндісі (сольват) қоңыр түсті. Ерітінділердің химиялық теориясы затты еріткенде пайда болатын жылу эффектісін түсіндіруге мүмкіндік береді. Еру процесінің жылу эффектісін (∆H еру ), заттың кристалдық торын бұзу үшін қажетті (∆H тор ) және сольваттау процесінде бөлінетін (∆H сольв ) жылу қосындысы түрінде беруге болады:
∆H еру = ∆H тор + ∆H сольв
Егер ∆H тор > ∆H сольв болса, онда еру процесі эндотермиялы, егер ∆H тор < ∆H сольв болса, онда еру процесі экзотермиялы.
Құрамдастардың арасында химиялық әрекеттесудің болуы еріген кездегі көлемдік эффектіні де түсіндіреді. Айталық, 1л этанолды 1л суды еріткенде 2л ерітінді емес, керісінше 1, 93л алынады. Мұндай жағдайдағы көлемнің кішіреюі су мен спирттің гидроксиді топтарының арасында сутектік байланыстардың түзілуімен түсіндіріледі.
Д. И. Менделеевтің ерітіндінің химиялық теориясы негізінде физика - химиялық талдау, кешенді қосылыстар химиясы, сусыз ерітінділердің электрохимиясы сияқты жаңа ғылыми бағыттар пайда болады. Бұл теорияға үлес қосқан ғалымдар: Д. П. Коновалов, И. А. Каблуков, Н. С. Курнаков, В. А. Кистяковский т. б.
4. Ерітінділердің концентрациясы.
Ерітіндінің концентрациясы дейтініміз - ерітіндінің белгілі бір салмақ мөлшерінде, не белгілі бір көлемінде еріген заттың мөлшері. Ерітінділердің концентрациясын, яғни ерітінділердің құрамын кескіндеудің бірнеше әдісі бар:
1. Массалық процент пен өлшенетін (проценттік) ерітінділер, яғни ерітіндінің 100 масса бөлігінде еріген заттың массасы. Мысалы, қанттың 12 проценттік ерітіндісі десек, ол ерітіндінің 100 грамында 12г қант, 88г су бар. Еріген заттың массалық үлесі ω(омега) - ол еріген зат массасының ерітіндінің жалпы массасына қатынасын көрсететін өлшемсіз шама. Өлшем бірлігі үлес, %.

Еріген заттың массалық үлесін ерітіндінің пайыздық (проценттік) концентрациясы деп атайды.
2. Мольдікпен өлшенетін (мольдік) ерітінділер. Ерітіндінің метрінде бір моль зат еріген ерітіндіні мольдік ерітінді дейді, сондықтан ерітіндінің бір литрінде мольдің қаншасы ерігендігін көрсететін сан сол ерітіндінің мольдік концентрациясын көрсетеді: оны М әрпімен белгілейді.
С м немесе еріген зат мөлшерінің 1л ерітіндіге қатынасын көрсетеді. Өлшем бірлігі моль/л;
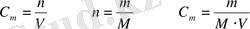
1М - бір молярлық ерітінді (1л - де еріген заттардың 1мольі болады) .
0, 5М - жарты молярлық ерітінді.
0, 1М - децимолярлылық ерітінді.
0, 01М - сантимолярлық ерітінді.
0, 001М - миллимолярлық ерітінді.
Мысалы, 3М делінсе, 1л ерітіндіде 3моль, ал 0, 2М делінсе 0, 2моль зат ерігені. Мольдік концентрациялары бірдей ерітінділер эквимольді (эквимолярлық немесе эквимолекулалық) деп атайды.
3. Нормальдықпен өлшенетін (нормальдық) ерітінділер. Ерітіндінің 1 литріндебір моль - эквивалент зат ерісе ерітіндіні нормаль ерітінді дейді; сондықтан ерітіндінің бір литрінде моль - эквиваленттің (заттың эквивалентіне тең етіп алынған грамм саны) қаншасы ерігенін көрсететін сан, сол ерітіндінің нормальдық концентрациясын көрсетеді. Оны С н немесе Н әрпімен белгілейді. Өлшем бірлігі моль/л:

Мысалы, ерітіндінің 1 литрінде 3моль эквивалент ерітілсе, оны 3 нормальдық (3н), ал 0, 5моль эквивалент ерітілсе, оны жарты нормальдық (0, 5н) ерітінді дейді.
- Титр - еріген зат массасының ерітінді көлеміне қатынасын көрсетеді. Өлшем бірлігі г/мл:

мұндағы: m - еріген заттың массасы (г) ;
V - ерітінді көлемі (мл) ;
Э - эквиваленттің молярлық массасы;
С н - эквиваленттік концентрациясы.
Титрі белгілі ерітіндіні (титрленген ерітіндіні) дайындай үшін, қажетті көлемге есептелінген заттың дәл өлшендісін алып, дистилденген суда толық ерітіп, оны керекті көлемге жеткізеді.
- Моляльдықпен өлшенетін ерітінділер.
Еріткіштің 1000 грамында еріген заттың бір молі болса, ондай ерітіндіні моляльдық ерітінді деп атайды. Еріткіште еріген заттың мөлшеріне сай ерітінді 0, 1 0, 05 2, 0 т. б. моляльды бола алады. Мәселен, қанттың С 12 Н 22 О 11 судағы децимоляльды ерітіндісі 34, 2г қанттан және 1000г немесе 1 литр судан тұрады.
Осмос. Ерітінділердің, оның ішінде сұйық ерітінділердің касиеттерін зерттегенде, ол ерітіндідегі заттың күйі газ күйіне өте ұқсас екендігі анықталды. Газдардың негізгі қасиеті - диффузия арқылы мейлінше кең көлем алуға тырысуы. Міне, осы қасиет еріген затта да болады, оны былайша дәлелдеуге болады: бір ыдысқа қанттың концентрленген ерітіндісі кұйылады және оның үстіне араласып кетпейтіндей етіп, ептеп сол қанттың сұйық ерітіндісін құяды. Бұл жағдайда екі жақты диффузия басталады, яғии қанттың молекулалары концентрленген ерітіндіден сұйық ерітіндіге, ал судың молекулалары, керісінше, сұйық ерітіндіден концентрленген ерітіндіге диффузияланады. Біраз уақыт өткен соң, қанттың да, судың да молекулалары әбден араласып біркелкі орналасып, ерітіндіміз біртектіге айналады.
Енді судың молекулаларын өткізетін, одан ірірек қант молекулаларын өткізбейтін түбі шала өткізгіштен жасалған ыдыска қант ерітіндісін құяды. Осы ыдысты ішіндегі ерітіндісімен таза су құйылған екінші кеңірек ыдыстың ішіне қойса, бір жакты диффузия байқалады.
Мұнда су молекулалары ғана диффузияланады, әрі олар қанттың, ерітіндісі құйылған кіші ыдысқа тез көшеді, кері өтуі баяуырақ болады. Осының нәтижесінде қант ерітіндісінің концентрациясы кемиді. Сонымен катар тағы мысал келтіретін болсақ, онда мынандай прибор алайық:

Прибордың сол жағында тек қана таза еріткіш, ал оң жағында ерітінді. Екі сұйықтықтың ортасына шала өткізгіш қойылған. Ол арқылы еріткіштің молекуласы өте алады да, еритін заттың молекуласы өте алмайды. Бұл жағдайда да бір жақты диффузия байқалады. Осындай шала өткізгіш арқылы болатын, бір жақты диффузияны осмос деп атайды (грек тілінде osmos - итеру, басу деген мағынада) .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz