Сандық талдау әдістері: гравиметриялық және титриметриялық әдістердің теориясы мен әдістемесі


2. Сандық талдау әдістері . . . 3
2. 1 Гравиметрия . . . 4
2. 2 Гравиметриялық анализ әдістерін жіктеу . . . 4
2. 3 Зерттеу бөлімі . . . 5
2. 4 Әдістің жалпы бағалануы . . . 7
3. Титриметриялық анализ . . . 8
3. 1 Әдістің теориялық негіздері . . . 8
3. 2 Қышқылды- негізді титрлеу әдістері . . . 10
3. 3 Тұндыру әдісімен титрлеу . . . 16
3. 4 Тотығу - тотықсыздану титрлеу әдісі . . . 19
3. 5 Комплексометриялық титрлеу әдісі . . . 23
4. Қорытынды . . . 26
Пайдаланған әдебиеттер
2. Сандық талдау әдістері
Сандық талдау әдісі - заттың мөлшерлік құрамын анықтауға мүмкіндік туғызатын әдістерді оқып үйрену. Сандық анализдің - анализденетін заттық құрамына кіретін әртүрлі компоненттердің мөлшері сондай-ақ анализденетін қоспаның құрам бөліктерінің мөлшерлік арақатынасын анықтау болып табылады.
Сандақ анализ көмегімен көптеген мәселелер шешіледі. Олардың негізгілері мыналар:
Заттардың, атомдық, мольдік және эквиваленттік массаларын анықтайды. Зерттелетін заттар құрамына кіретін иондар мен молекулалардың элементтердің мөлшерін анықтайды. Зерттелетін затта оның құрам бөліктері қандай арақатнаста болатынын табады.
Сандық анализ көмегімен тұрақты химиялық бақылау арқылы өндірістегі технологиялық процесстердің жүргізілу дұрыстығын тексереді. Химиялық бақылаусыз өндіріске материалдың ешқайсысы түспейді және дайын өнімнің еш қайсысы шықпайды.
Анализдің химиялық әдістеріне гравитациялық, титреметриялық әдістер кіреді(қышқылды - негіздік, тотығу - тотықсыздану, комплексометриялық, тұндыра титрлеу) .
Гравиметриялық анализ - құрамы анық белгілі қосылыс түрінде немесе химиялық таза күйінде бөлінген анықталатын компоненттің массасын дәл өлшеуге негізделген мөлшерлік анализ әдісі.
Титриметриялық анализ - анықталатын заттың берілген мөлшерін өткізуге жұмсалған нақты концентрациялы реактив ерітіндісінің көлемін өлшеуге негізделген мөлшерлік анализ әдісі. Титреметриялық анализ негізінде эквиваленттер заңы жатыр.
Гравиметриялық және титриметриялық әдістер аналитикалық химияның классикалық әдістері болып табылады, олар ғылыми зерттеулерде, завод лабораториясының тәжірибесінде жан - жақты қолданылады. Оларды тамақ өндірісінің технологиялық бақылауында: өнімдердің зольдігін (күлдігін) және ылғалдығын, қант мөлшерін, белокты, күкіртті қышқылды судың кермектігін және тағы басқа анықтау үшін кеңінен пайдаланылады.
Сандық аналидің маңызды операцияларының бірі аналитикалық таразыда жүргізілетін массаны өлшеу болып табылады.
2. 1 Гравиметриялық әдіс
Анықталатын татпаның құрамдас бөлігінің массасын дәл өлшеуге негізделген сандық анализ гравиметриялық әдіс деп аталады. Сандық гравиметриялық анализ жәрдемімен көптеген есептерді шешуге болады. Мысалы, заттардың атомдық, мольдік және эквиваленттік массасын белгілеп анализденетін зат құрамына енетін құрамдас бөліктердің мөлшерін анықтайды, химиялық құрамы бірдей немесе шамамен тең келетін, бірақ физикалық - химиялық қасиеттері әртүрлі заттың құрам бөліктерінің арақатынасын табады.
Сандық анализ әдістерімен материалдық сапасы мен оның мөлшерлік құрамының қосынды және пайдалы қосымша арасындағы байланысты анықтайды. Мысалы, талшықты оптикада жарық жүргізуші дайындау үшін өте таза кремний диоксиді пайдаланылады, оның құрамындағы микроқоспаның мөлшері 10 -7 % массадан аспауы тиіс. Мөлшері одан көп болған жағдайда жарық жүргізуші дайындауға арналған материалға жарамсыз болып табылады.
Мөлшерлік гравиметрия әдістерімен өте қарапайым да нақтылы болғандықтан ғарыштық обьектілерге анализ жасайды. Гравиметрия көмегімен әртүрлі этолондарды бір үлгіге салады.
Гравимертияда анализденетін құрамдас бөліктің гравиметриялық формасының массасын дәл өлшеудің маңызы зор. Гравиметриялық әдістер зат құрамының тұрақтылық және массасының сақтау заңдарына, эквиваленттер заңына негізделген. Олар дәлме - дәлдігімен (0, 2% массаға дейін) барынша жақсы қайталанғыштығымен, сан - алуандығымен ерекшеленеді. Бұл әдістің кемшілігі - уақытында. Осыған қарамастан гравиметриялық анализдің химия тарихында маңызы ерекше, негізгі химиялық заңдар, оның ішінде гравиметрияға тірек болатын заңдар соның көмегімен анықталады.
2. 2 Гравиметриялық анализ әдістерін жіктеу
Гравиметриялық анализ әдістері үш топқа бөлінеді:
1. Бөлу
2. Тұндыру
3. Айдау
Бөлу әдісі - бұл әдіс зерттелетін заттың немесе материалдан анықталатын құрамдас бөлікті бос күйінде бөліп алып, соңынан дәл өлшеуге негізделген. Мысалы, қатты отындардың, көмірден (массалық үлесін) белгілі бір массасын таразыда өлшеп алады да, ауада жандырып жібереді. Бірінші жағдайда анализ жасау үшін алдын - ала өлшенген тигельдегі отынды тұрақты өлшемдік массасына дейін өртеп қатты қыздырады, қалған күл массасын тарзыда тартады. Күлдің және өлшендінің массасын біле отырып мына формула бойынша күлдің массалық үлесін есептеп шығарады:
х( % масса=
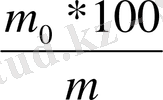 Equation. 3 )
Equation. 3 )
Мұндағы m 0 және m - күлдің және отын өлшендісінің массасы анализ жасалатын сұйықтық өлшендісін сүзеді немесе центрифугалап, қалдықты жуады, кептіріп аналитикалық таразыда өлшейді.
Айдау әдісі - бұл әдіс анықталатын құрамдас бөлікті ұшқыш қосылыс түрінде толық бөліп алып, қалдықты немесе тұтылған ұшқыш өнімді өлшеуге негізделген.
Айдау әдісі бірнеше модификацияда қолданылады:
- анықталатын затты қоспадан айдап, түзілген затты өлшейді.
- анықталатын затты айдап, қандай болса да, сіңіргішке сіңіреді, сіңіргішті өлшейді, массаның қосылуы бойынша айдамның мөлшерін анықтайды.
- анықталатын затты дәл өлшеуден айдап, айдау аяқталған соң қайтадан өлшейді де массаларының айырмасы бойынша айдамның мөлшерін анықтайды.
2. 3. Зерттеу бөлімі
Ерігіш сульфаттардағы күкіртті анықтау.
Ерігіш сульфаттардан тұратын заттардағы күкіртті анықтау,
ВаSO
4
кристалды тұнба түрінде тұндыруға негізделген SO
 +Ba
+Ba
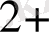 =BaSO
=BaSO


Тұнбаны қыздырылған әлсіз қышқыл ерітіндіден бөліп аламыз. Тұнбаны 800 0 С температурада қыздырады.
Гравиметриялық форма BaSO
 SO
SO
 -тың гравиметриялық факторы FSO
-тың гравиметриялық факторы FSO
 =0. 4116 ал F
S
=0. 1374
=0. 4116 ал F
S
=0. 1374
Қажетті реагенттер.
Тұз қышқылы, HCl, 2M ерітінді
BaCl 2 *2H 2 O 5%-тік ерітінді
AgNO 3 -тің 1%-тік ерітінді
Азот қышқылы HNO 3 , 2M ерітінді
Анықтау тәсілі. Аналитикалық таразыда 0, 3-04г NaSO 4 алып, 300-400 мл стаканға 150-200 мл HCl қосып, ерітіндіні қыздыра отырып, үстіне қайнағанға дейін тамшылатып BaCl 2 қосамыз. Тұндырғышты қосқанда шыны таяқшамен араластырып отырамыз. Тұнба толық түскен соң, стаканды шынымен жауып 12 сағатқа қалдырамыз.
Тұнбаны көп ленталы сүзгі, оны таза стаканға құйып қоямыз. Қалған тұнбасы бар бөлігін суық сумен шайып деконтациялаймыз.
Деконтацияны 2-3 рет қайталау керек. Соңғы сумен шайған соң, оны AgNO 3 -пен 2М HNO 3 ортасында тексереміз. Одан соң сүзгісімен варонканы кептіргіш шкафқа салып, кішкене дымқыл болғанша кептіреміз.
Одан соң, сүзгі қағазын тұбасымен қоса бүктеп, тұрақты массаға келтірілген фарфор тигельі ие салып, муфель пешіндегі сүзгі қағазы жанып кеткенше түтін жойылғанша ұстап, одан соң муфель пешіне тұрақты массаға келгенше қыздырамыз.
Одан соң есептеу жүргіземіз:
Na
2
SO
4
+ BaCl
2
 BaSO
4
+2NaCl
BaSO
4
+2NaCl
m=m 2 -m 1 =24. 4768-24. 0794=0. 3974
m 2 =бюкспен тұздың массасы
m 1 =бюкстің массасы
Қай есептеу факторы. F=
 Equation. 3
Equation. 3
F=
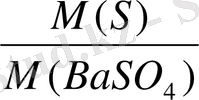 =
=
 Equation. 3 =0. 1374
Equation. 3 =0. 1374
M тұнба =0, 3788 Аналитикалық таразыда өлшегенде
W
тәж
(S) =
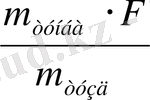 100%
100%
W
тәж
(S) =
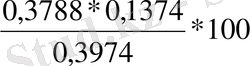 %=13. 10%
%=13. 10%
Тұнбаға түсірілмейтін көлемін есептеу

Na
2
SO
4
+ BaCl
2
 BaSO
4
+2NaCl
BaSO
4
+2NaCl
Анализденетін заттың массасы 0, 3974 тең. BaSO 4 түріне толық тұнбаға түсіру үшін қажет тұнбаға түсіргіштің көлемін анықта BaCl 2 =(5%)
n Na
2
SO
4
=
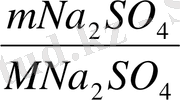 =
=
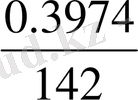 =0. 0028 моль
=0. 0028 моль
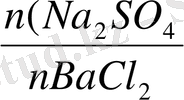 =
=
 n(BaCl
2
) =n BaCl
2
=0. 0028 моль
n(BaCl
2
) =n BaCl
2
=0. 0028 моль
m(BaCl 2 ) =n(BaCl 2 ) *M(BaCl 2 ) =0. 0028*208=0. 58г
тер-ді=
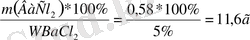 Equation. 3
Equation. 3
V
BaCl
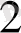 Equation. 3 =
Equation. 3 =
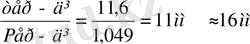 Equation. 3
Equation. 3
 Equation. 3
Equation. 3
142г-208г
x =0. 58г
0, 3974г-Хг
Қолданатын сүзгі 1) тығыз баритті деп аталады-ұсақ түйіршікті тұнбаны сүзуге арналған-ең тығыз сүзгі-“көк”.
Жоғарыда айтылғандай гравиметриялық анализ әмбебапты әдістердің бірі болып табылады. Ол кез келген элементті анықтау үшін қолданылады, оның өзінде олардың әрқайсысына бірнеше әдістер жасалған. Әдетте анализ жасалатын қоспадан қызықтыратын құрамдас бөлікті бөліп алу қажет болғанда көбінесе тікелей анықтау пайдаланылады, оны гравиметриялық форма түріпде өлшеп алады. Тек элеметтердің кей бөлігін, мысалы, сілтілік металдарды және басқаларын жанама методика бойыиша ғана анализдейді.
2. 4 Әдістің жалпы бағалануы
Гравиметриялық әдістің ең маңызды жетістігі анализдің өте дәлме-дәлдігі болып табылады. Әдеттегі қателік 0, 1-0, 2 болады, ол татпаның құрамы күрделі болғнда анализденетін құрамдас бөліктері бөлу мен бөлім алу әдістерінің жетімсіздігінен бірнеше процентке дейін артады. Бұл әдіске стандартты үлгі бойынша қандай да болсын стандарттау немесе градуирлеудің қажеттігі жоқ. Гравиметриялық анализ нәтижелерін есептеу үшін мольдік масса, стехиометриялық коэффициент және өлшенді массасы мен гравиметриялық форма ғана пайдаланылады.
Пайдаланылатын реагенттер бірнеше элементтерді тұндыра алатындықтан гравиметриялық анализдың сұрыпталуы үнемі жоғары бола бермейді. Сұрыпталатын реагенттер массасы мысалы әзірге бірен-саран ғана.
Гравиметриялық әдістің маңызды кемшілігі анықтаудың ұзаққа созылуында болып табылады, сондықтан оны анализді орындау жылдамдығы шешуші мәнге ие болатын болатын жерлерде жедел анализ жасауға қолдануға болмайды.
Гравиметриялық әдіс көбінесе анализ жасауға бірнеше сағат және күн бөлінетін татпаның негізгі құрамдас бөлігін анықтауға, басқа әдістерді, пайдаланылатын эталондарды анализдеуге, арбитраждық анализге, әр түрлі мианралдардың, қоспалардың, заттардың, солардың ішінде алғаш синтезделгендердің, әр түрлі композициялардың және т. б. құрамын дәл анықтау үшін қолданылады. Гравиметриялық әдіс іс жүзінде өте кең қолданылады.
3. Титриметриялық анализ
Егер гравиметриялық анализде құрамдас бөлікті көп жағдайда мөлшерлеп тұнбаға түсіріп алып, соңынан тұнбаны жуу, кептеру немесе гравиметриялық формаға дейін қатты қыздыру керек болса, титриметрияда әдетте зерттелетін заттың ерітіндісіне титранттық эквиваленттік мөлшерін қосса жетіп жатыр. Оны алдымен эквиваленттік нүкте деп аталатын белгілі сәтке дейін біртіндеп қосады.
Ертеректе бұл әдіс көлемдік әдіс деп аталды, өйткені әдетте өлшенетін шама қосылытын титрант ерітіндісінің реакцияға жұмсалатын көлемі болып табылады. Сондай-ақ волюмометриялық әдісі де бар, мұнда бөлінетін немесе сіңірілетін газдың көлемі өлшенеді, сондықтан бұл да көлемдік әдіс деп аталады. Сол себепті «титриметриялық» деген термин қатаңырақ сақталады, оның үстіне жұмсалған титранттың көлемі өзгеруден өзге басқа да операциялар (өлшеу, электрохимиялық айналу және т. б. ) болуы мүмкін.
Анализдің титриметриядық әдістері анализдейтін затпен бірге реакцияға жұмсалатын реагенттің массасын тіркеуге негізделеді.
Реагентті (титрантты) концентрациясы нақтылы белгілі реагент ерітінді түрінде ғана емес, қатты күйінде де (ұнтақ, таблетка, реагент сіңірілген қағаз) қосады. Жұмсалған титрантты өлшенетін ерітіндісі бар ыдысты және қосылатын реагенттің (травиметриялық титрлеу) салмағын өлшеп те анықтауға болады.
Анализдің титриметриялық әдістері мөлшерлік анализде ең маңыздыларының бірінен саналады, олар өте қарапайым және инструменталды анализ әдістерінің прогрессивті бәсекелестігіне қарамастан әлі де кеңінен қолданылап келеді. Шешу үшін ең алдымен тириметриялық әдістер тура келетін ғылыми есептер өте көп. Көптеген жүйелер үшін анықтау қателігі 1% - тең аспайды, сезімталдық басталу реті 10 -3 М немесе 0, 10%.
Анализ дәлдегі аз болса да гравиметриялық әдіспен титриметриялық әдістер анализді орындау жылдамдығы және қарапайымдығы бойынша артығырақ болады.
3. 1 Әдістің теориялық негіздері
Титриметриялық анализ эквиваленттер заңына негізделеді. Титранттың әр үлесін жүйеге қосқан сайын мынандай теңдеумен бере аламыз:
аА+bB
 A
a
B
b
(өнімдер) (12. 1)
A
a
B
b
(өнімдер) (12. 1)
Тепе-теңдік анықталып, мұнда анықталатын зат пен титранттың концентрация тепе-теңдігі азаяды, ал реакция өнімдері арта түседі. Егер титранттың мөлшері титрленетін заттың мөлшеріне эквиваленттік шамаға дейін жетсе, онда реакция аяқталады. Осы кезең эквиваленттік нүкте деп аталады. Іс жүзінде эквиваленттік нүктеге қандай дәрежеде болса да жуықтаса, реакцияның анықталу нүктесі болып тұжырымдалады.
Титриметриялық анализде реакцияның анықталу кезеңі эквиваленттік нүкте деп аталады.
Химиялық анализ әдістерінде реакцияның соңғы нүктесін ерітінді бояуының өзгеруі бойынша мөлшерлеп тұнба түсіне қарай анықтайды немесе бастапқы қосылыстардың, реакция өнімдерінің немесе жүйеге арнайы енгізілген зат - индикатордың біреуінің әсер етуі бойынша нақтылайды. Физика - химиялық әдістерінде (немесе инструменттік анализде) титрилеудің соңғы нүктесін тіркелетін физикалық параметрдің жеткілікті дәрежеде өзгеруі бойынша анықтайды, мысалы, рН нақтылау, потенциал, электр өткізгіштік немесе кедергісі және т. б. бойынша анықтауға болады. Идеал жағдайда титрлеудің соңғы нүктесі эквиваленттік нүктеге дәл келуі қажет, алайда әр түрлі себептермен, мысалы индикатор бояуының дер кезінде өзгермеуі, жүйенің тіркелетін параметрінің дәл өзгермеуі және т. б. дәл келмеуі себебінен, бұл нүктелерде біраз өзгерістер болады.
Титриметрияда сан алуан реакция типтерінің: бейтараптау, тотығу - тотықсыздану, комплекс түзу және тұну реакцияларының пайдаланылуы мүмкін.
Титриметриялық анализде реакция типтері санының көп болуына қарамастан, олардың барлығы қолданыла бермейді. Ең дұрысы, титриметриялық анализде пайдаланылатын реакциялар мына талапқа сай келсе болғаны:
- реакция қайтымды болу керек - ол іс жүзінде соңына дейін жүретін болыу керек;
- реакция нақты эквивалентті мөлшерде, жеткілікті түрде және жылдам жүруі қажет, өйткені баяу өтетін реакциялар кезінде эквиваленттік нүктені дәлме-дәл тұрақтандыру мүкін емес; эквиваленттік нүкте дәл де, оңай анықталуы қажет;
- титрлеу кезінде жанама реакция жүрмеуі керек;
- ерітіндідегі қосымша заттар негізгіреакция кедергі жасамайтын болуы керек.
Жоғарыда сөз болған талаптар реакцияларға титрлеу анализін қолдану аймағын шектей түседі.
Химиялық реакциялардағы әрекеттесуші заттардың эквиваленттігі туралы ұғым аналитикалық химиядағы негіздердің бір болып табылады. Титриметриялық анализдің нәтижелерін есептеу осы эквиваленттікке негізделеді.
Эквиваленттік факторы f - берілген қышқылдық негіздік реакцияларында сутегінің бір ионына немесе берілген тотығу-тотықсызданы реакциясында бір электронға х заттың (мысалы, В затының молекуласы) нақтылы бөлшегінің қай үлесі эквивалентті екенін білдіретін сан, эквиваленттік факторын осы реакцияның стехиометриясы негізінде есептеп шығарады:
f экв (B) =1/Z B (12. 2)
мұнда Z B - алмасқан (немесе қосылған) сутек иондарының (қышқылды -негіздік реакциясы үшін) саны немесе берген (немесе қабылданған) электрондардың (тотығу - тотықсыздандыру реакциясы үшін) саны; В-заттың химиялық формуласы.
3. 2 Қышқылды- негізді титрлеу әдісі
Қышқылды негіздік титрлеу барысында титранттан анализденетін заттқа немесе керісінше анализденетін заттан титрантқа қарай протон өтеді. Әдетте, қышқылды негіздің өзара әрекеттесу реакциясы жоғары жылдамдықпен және стехиометриялықпен сипатталады.
Бейтараптау(нейтрализация) әдісімен бейорганикалық аздаған қосылыстар мен жүздеген органикалық қосылыстар санын анықтайды, олардың қышқылдық та, негіздік те қасиеттері болады. Органикалық қосылыстарды көбінесе сусыз еріткіштерде титрлейді. Кейбір заттарды жанама жолмен қышқылды - негіздік титрлеп анықтауға болады, мұнда, мысалы, алмасу реакциясын пайдаланады. Мәселен ионның алмасуының жәрдемімен калий хлоридін тұз қышқылының эквиваленттік мөлшеріне көшіруге болады, сөйтіп титрлеу арқылы калийдің немесе натридің иондарын анықтайды.
Қышқылды - негіздік титрлеудің соңғы нүктесін түсін өзгертетін индикатор жәрдемімен көз мөлшерлеп те, рН-метрдің (ионометр) жәрдемімен де анықтайды.
Эквиваленттік нүктедегі рН мәні күшті қышқылды күшті негізбен 25 0 С температура кезінде сулы ортада титрлегенде ғана 7-ге тең болады. Қалған жағдайлардың көпшілігінде эквиваленттік нүкте қышқылдық та, сілтілік те күйде бола береді, эквиваленттік нүктеде рН шамасы титрленетін заттың табиғаты мен титрлеуде индикаторды іріктеп алудың маңызы зор, олардың жалпы саны барынша үлкен. Әртүрлі индикаторлар түсін өзгерту рН-қа және титрлеу жағдайына байланысты болады.
Ацидометрия - ол стандарт титрлеу ерітіндісі ретінде қышқыл ерітіндісін пайдалану әдісі.
Алкалиметрия - ол негіз ертінділері жұмысшы ерітінді болып табылатын әдіс.
Титрлеу қисықсызығын жасау үшін рН мәнін анықтайды немесе қосылған стандартты ерітінділер көлеміне байланысты есептеп шығарады. Мысал үшін күшті қышқылды күшті сілтімен титрлеудің қисық сызығын есептепшығаруды қарастырамыз, яғни 100мл 0, 1 моль/л НСІ ерітіндісін 0, 1 моль/л NaOH ерітіндісімен титрлейді. Есептеудің қарапайым болуы үшін титрлеу кезінде ерітіндінің көлемі өзгермейді және иондардың концентрациясы мен активтігі арасындағы айырмашылық мардымсыз болады. Күшті қышқыл мен негіз сулы ерітіндіде іс жүзінде толық диссоциацияланады, сондықтан Н + иондарының концентрациясы HCl-дың концентрациясына тең болады, демек бастапқы сәтте:
[H
+
] =[HCl] =0. 1 моль/л, ал рН=1, 00 HCl ерітіндінің рН мәні эквиваленттік нүктеге дейін титрленбеген қышқылдың концентрациясымен анықталады. 50 мл 0, 1 моль/л NaOH ерітіндісін қосқан кезде қышқылдың 50 проценті реакцияға түседі де сонша мөлшері титрленбей ерітіндіде қалады. Бұл ерітіндіде Н
+
иондарының концентрациясы [H
+
] =0, 1*0, 5=0, 05 моль/л, яғни рН=2, 70=1, 3 болады. 90мл сілті қосқанда ерітіндіде қышқылдың 10 проценті титрленбей қалады, ал [H
+
] =0, 1*0, 1=0, 01 моль/л, яғни рН=2, 00 болады. 99, 0 мл сілті енгізгенде ерітіндіде [H
+
] =0, 1*0, 01=1, 0*10
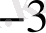 , рН=3, 00, ал егер 99, 9 мл сілті қосылса, рН=4, 00 болады. Қышқылдың барлығы сілтімен толық әрекеттессе эквиваленттік нүктеде ерітіндінің рН шамасы судың автопротолизімен анықталып, 7, 00 - ге тең болады.
, рН=3, 00, ал егер 99, 9 мл сілті қосылса, рН=4, 00 болады. Қышқылдың барлығы сілтімен толық әрекеттессе эквиваленттік нүктеде ерітіндінің рН шамасы судың автопротолизімен анықталып, 7, 00 - ге тең болады.
Эквиваленттік нүктеден кейінгі ерітіндінің рН шамасы қосылған сілтінің артық мөлшерімен анықталады, Н + иондарының концентрациясын судың иондық көбейтіндісін есептей отырып анықтау керек. Егер эквиваленттік нүктеден кейін NaOH қосылса, онда [ОН] =0, 1*10 -2 *0, 1=1*10 -4 моль/л, [H + ] =1*10 -14 /10 -4 =1*10 -10 моль/л және рН=10, 00 болады. 1, 0мл сілті қосқан кезде
ОН - =1*10 -2 =1*10 -3 моль/л [H + ] =1*10 -14 /10 -4 =1*10 -11 моль/л ал, рН=11, 00 болады (12. 1-сурет)
рН=7, 0 кезіндегі абсцисса осіне параллель және ордината осін қиып өтетін түзу бейтараптау сызығы деп, ал ордината осіне параллель, абсцисса осін қиып өтетін түзу реагенттердің эквиваленттік мөлшері кезінде эквиваленттік сызық деп аталады, бұл сызықтың сол жағында қышқылдың артық мөлшері, оң жағын ала артық сілті ерітіндісі болады. Титрлеу қисық сызығының эквиваленттік сызықты қиып өткен қиылысындағы нүкте эквиваленттік нүкте, ал титрлеу қисық сызығының бейтараптау сызығындағы қиып өткен нүктесі бейтараптау нүктесі деп аталады. Күшті қышқылды күшті негізбен титрлеу кезінде эквиваленттік нүкте бейтараптау нүктесіне дәл келеді.
Эквиваленттік нүкте аймағында рН шамасының шұғыл өзгеруі титрлеу секіруі деп аталады.
Қисық сызықтың бұл бөлігі ең маңыздысы болып табылады, өйткені титрлеу секіруі бойынша титрлеу үшін индикаторды іріктеуді қажет етеді де кейбір басқа мәселелер де шешімін табады. РН-тың шұғыл өзгеру аймағын мен титрлеу кезінде өтетін реакция тепе-теңдігімен анықталады. Секірудің мөлшерлік құны берілген анализ дәлдігіне байланысты белгіленеді. Көптеген титриметриялық әдістердің қателігі
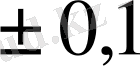 %-тен аспайды, сондықтан секіртпе шамасы ерітінді күйі 0, 1% - ке дейін титрленбегендей, 0, 1% артық титрленгендегі күйінің рН өзгеруі болып саналады. Егер рұқсат етілген анализ қателігі 1% болса, онда титрлеу секіруі ерітіндінің 1%-ке дейін титрленбей, 1%-ке артық титрленуінен рН-тық өзгеруімен есепке алынады. Бұдан жоғары қателік іс жүзінде рұқсат етілмейді. Жоғарыда қарастырылған нақтылы мысалда - 0, 1% аралықта титрлеу секіруі 6, 0 рН бірлігін түзеді (рН-4-тен рН-10-ға дейін) .
%-тен аспайды, сондықтан секіртпе шамасы ерітінді күйі 0, 1% - ке дейін титрленбегендей, 0, 1% артық титрленгендегі күйінің рН өзгеруі болып саналады. Егер рұқсат етілген анализ қателігі 1% болса, онда титрлеу секіруі ерітіндінің 1%-ке дейін титрленбей, 1%-ке артық титрленуінен рН-тық өзгеруімен есепке алынады. Бұдан жоғары қателік іс жүзінде рұқсат етілмейді. Жоғарыда қарастырылған нақтылы мысалда - 0, 1% аралықта титрлеу секіруі 6, 0 рН бірлігін түзеді (рН-4-тен рН-10-ға дейін) .
Іс жүзінде титрлеу секіруі біраз
төмен болады, өйткені титрлеу кезінде
ерітінді сұйылып эквиваленттік нүктесі
маңындағы ерітінді көлемі 2 есеге дейін
артады. Демек, сутек иондарының дәл-
ме дәл концентрациясын қосылған тит-
рант көлемін ескере отырып есептеген
жөн. 99, 9 мл сілті қосылған кезде титр-
ленген ертіндінің көлемі 100+99, 9 мл болады, мұнда [H + ] =0, 1*10 -3 *100, 0/199, 9=5, 0*10 моль/л, рН=5, 7=4, 3*100, 1 мл қосқан кезде ерітінді көлемі 100+100, 1=200, 1 мл, ал [ОH - ] =0, 1*10 -3 *100/200, 1=5, 0*10 -5 моль/л, [H + ] =10 -14 /5*10 -5 =2*10 -10 , ал рН=9, 7. Яғни титрлеудің шынайы секіруі рН 4, 3-тен 9, 7-ге дейін сұйылмаған есеп бойынша есептелген 6, 0 емес, рН-тың 5, 4 бірлігі болады. Тек бұл айырмашылықтың онша үлкен шама еместігін ескеру керек. Күшті қышқылды күшрті сілтімен титрленген кезде эквиваленттік нүктесіндегі рН судың автопротолизімен анықталады және реагенттердің концентрациясына тәуелсіз болады. Бөлме температурасында теория бойынша судың рН=7, 0-ге тең болады.
Титрлеудің секіру шамасы реагенттердің концентрациясына тәуелді болады. Мұны есептеуден көрнекі көре аламыз. Реагенттердің концентрациясы неғұрлым аз болса, титрлеу секіруі де соғұрлым төмен болады. Суретте 100 мл 0, 01 моль/л НСІ ерітіндісін сондай концентрациялы NaOH-пен титрлеудің қисық сызығы үзік сызықпен белгіленген. Мұндай жағдайда секіруі тек рН-тың 4, 0 бірлігі болады. Концентрация одан әрі азайған сайын реагенттердің секіруі азая түседі.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz