Алкендер: құрылымы, алынуы, атаулары, химиялық қасиеттері және қолданылуы


Мазмұны
Кіріспе
1. Алкендер
2. Алкендердің атаулары мен изомерлері
Негізгі бөлім
1. Алкендердің алынуы және қасиеттері
2. Физикалық қаcиеттері
3. Химиялық қасиеттері
Қорытынды
1. Қосылу реакциялары
2. Алкендердің жеке өкілдері және олардың қолданылуы
Қосымша
1. Сокольский Дмитрий Владимирович
2. Марковников Владимир Васильевич
Пайдаланылған әдебиеттер
Алкендер
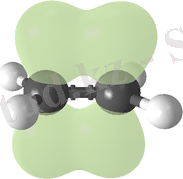
Этилен
Қанықпаған көмірсутектермен танысуды құрамында бір қос байланысы бар көмірсутектер - алкендерден бастайық.
Алкендер - молекула құрамында бір қос байланысы бар, жалпы формуласы С n Н 2n болатын қанықпаған көмірсутектер.
Алкендердің ең қарапайым өкілі - құрамында екі көміртек атомы бар - этилен С 2 Н 4 . Алкендердің гомологтық қатары этиленнен басталатындықтан, алкендер этилен қатарының көмірсутектері немесе олефиндер деп те аталады. Алкендердің жалпы формуласын С n Н 2n (n= 2) деп есептеп, этиленнің молекулалық формуласын табуға болады:
C 2 H 2•2 =C 2 H 4
ықшамдалған құрылымдық формуласы:
CH 2 =CH 2
Алкендердің құрылысы. Алкендердің құрылысын олардың ең карапайым мүшесі-этиленнің (этеннің) С 2 Н 4 мысалында қарастырайық. Этилен молекуласындағы көміртек атомының әрқайсысы екі сутек атомымен байланысқан және олар өзара қос байланыс арқылы жалғасқан .
Алкендерде көміртек атомдары sр 2 -гибридтенген күйде болады. Этилен молекуласындағы әр көміртек атомының бір s-және екі р-электрон орбитальдары гибридтенуге қатысады. Яғни, әр көміртек атомында үш гибридтенген электрон бұлты және бір гибридтенбеген р-электрон орбиталь болады. Үш гибридтенген орбитальдың екеуі сутек атомдарының s-электрон бұлттарымен екі σ-байланыс, ал үшінші гибридтенген орбиталь екінші көміртек атомының осындай орбиталімен қаптасып тағы бір σ-байланыс барлығы бес σ-байланыс [бір sp 2 - sp 2 (С - С) және төрт sp 2 - s(С - Н) ] түзеді. Гибридтенбеген р- электрон орбитальдары σ-байланыстар орналасқан жазықтыққа перпендикуляр орналасып, бір-бірімен жазықтықтың екі жағында (астында және үстінде) каптасып, екі π-электрондар арасында (С - С) бір π-байланыс түзеді. Яғни, этеннің молекуласындағы көміртек атомдары өзара бір σ-және бір π-байланыстар арқылы жалғасады. Қос байланыстың ұзындығы 0, 134 нм, байланыс энергиясы 612 кДж/моль болады. π-байланыс σ-байланысқа қарағанда әлсіз болады да, реакцияға түскенде оңай үзіледі.
Алкендердің атаулары мен изомерлері
Нормальді алкендерді атағанда көбіне сәйкес алканның -ан жұрнағын -илен жұрнағына алмастырады: этанға сай алкен - этилен, пропанға сай - пропилен және т. б.
Халықаралық номенклатура бойынша атағанда, сәйкес алканның -ан жұрнағы -ен жұрнағына алмастырылады: алкан - алкен, этан - этен, пропан - пропен жәнет. с. с. Алкендерді халықаралық номенклатура бойынша атауды қарастырайық:
1. Алкеннің құрылымдық формуласынан қос байланысы бар ең ұзын тізбек таңдап алынады. Тізбекті нөмірлеу қос байланыс жақын орналасқан шетінен басталады.
2. Орынбасар байланысқан көміртек атомының нөмірі көрсетіліп, содан кейін орынбасар аталады. Бірнеше радикал болса, әрқайсысының орны мен аты аталады.
3. Ұзын тізбек аталады да, атаудың соңында қос байланысы бар көміртек атомының нөмірі көрсетіледі.
Алкендердің радикалдары алкандар радикалдарына ұқсас аталады: СН 2 = СН - этенил (винил) .
Алкендерге изомерленудің бірнеше түрі тән:
1. Алкендерде қаныққан көмірсутектердегі сияқты көміртек қаңқасының изомерлері болады.
2. Еселі байланыстың орнына қарай изомерлену. Бутен молекуласындағы еселі байланыстың орнына сәйкес екі түрлі изомерлері болады. Қос байланыс шеткі көміртек атомында немесе ортаңғы көміртек атомында орналасуы мүмкін.
3. Класаралық изомерлену. Алкендер мен циклоалкандардың жалпы формулалары бірдей С n Н 2n . Бутеннің С 4 Н 8 класаралық изомері - циклобутан және метилциклопропан.
4. Кеңістіктік изомерлері (геометриялық немесе цис-, транс- изомер деп те аталады) . Қаныққан көмірсутектердің молекулаларында көміртек атомдары σσ-байланыс айналасында еркін айнала алады. Ал алкендерде көміртек атомдары өзара қос (σ- және π-) байланыс арқылы жалғасқан жағдайда π-байланыс үзілмейінше еркін айналу мүмкін емес. Қос байланыспен жалғаскан көміртек атомдары осы байланыс осі арқылы еркін айнала алмайды. Сондықтан бутен-2-нің орынбасарлары - метил топтары кеңістікте екі түрлі жағдайда орналаса алады. Бірдей орынбасушы топтары қос байланыстың бір жағында орналасқаны цис-изомер деп, ал екі жағында орналасқаны транс-изомер деп аталады (лат. cis - біржақта, trans - басқа жақта) .
Алкендердің алынуы және қасиеттері
Алкендер химиялық белсенді болғандықтан табиғатта өте сирек кездеседі. Алкендердіңгаз тәрізді мүшелерінмұнайға серік газдардан немесе мұнай өңдегенде және көмірді кокстегенде бөлінетін газдардан алады. Алкендерді алкандардан және олардың туындыларынан да өндіреді.
1. Алкандарды крекингілеу . Өнеркәсіпте алкандарды 700°С-қа дейін қыздырғанда, алкендер түзіледі:
С 8 Н 18 → С 4 Н 10 + С 4 Н 8
2. Алкандарды дегидрлеу . Өнеркәсіпте алкендерді жоғары температурадасутек бөле отырып, сәйкес алкандарды айырып алады. Мысалы, этаннан этилен алуды қарастырайық:
H 3 C - СН 3 → CH 2 = CH 2 + H 2
Сутек бөліне журетін айырылу реакциялары дегидрлену деп аталады.
Лабораторияда алкендерді бірнеше жолмен алуға болады:
3. Спирттерді дегидраттау . Өршіткі ретінде концентрлі күкірт қышқылы, фосфор қышқылы, алюминий оксиді сияқты су сорғыш заттар қолданылады.
Су бөліне жүретін айырылу реакциялары дегидратациялану деп аталады.
4. Галогеналкандарды дегидрогалогендеу . Галогеналкандарға сілтілердің спирттегі ерітінділерімен әсер еткенде алкен түзіліп, галогенсутектер бөлінеді.
Физикалық қаcиеттері
Алкандардың гомологтық қатарындағы жалпы заңдылықтар (сан өзгерісінің сапа өзгерісіне ауысуы) алкендердің қатарында да байқалады. Гомологтардың молекулалық масcаларының өсулеріне байланысты балкқу және қайнау температуралары мен тығыздықтары артады. Алкендердің алғашқы үш мүшесі (этен, пропен, бутен) газдар, пентеннен С 5 Н 10 бастап сұйық, ал С 18 Н 36 -дан бастап қатты заттар.
Нормальді құрылымды алкендер тармақты изомерлерінен жоғарырақ температурада қайнайды. Цис- және транс- изомерлердің қайнау және балқу температураларында айырмашылықтар болатыны туралы өткен тақырыпта қарастырылды. Алкендер судан жеңіл, суда нашар, органикалық еріткіштерде жақсы ериді.
Химиялық қасиеттері
Құрамында қос байланыс болғандықтан, алкендер едәуір белсенді қосылыстар. Алкендердің химиялық қасиеттері, негізінен, молекула құрамындағы қос байланыспен анықталады. Қос байланыс екі молекулалық орбитальдан тұрады: біреуі σ-, ал екіншісі π-типті. Әр түрлі реагенттердің әсерінен әлсіздеу π-байланыс үзіледі.
Алкендердегі қос байланыстың электрондары бір-бірінен тебілуі нәтижесінде π-байланыстың электрон тығыздығы көміртек атомдарының ортасындағы осьтің бойынан қашығырақ орналасады. Сондықтан электрон беретін реагенттердің (теріс зарядты) жақындаулары қиын болады да, ал электрон қабылдайтын реагенттердің әсерінен әлсіздеу π-байланыс үзіледі.
Этилен мен оның гомологтары қосылу, полимерлену және тотығу реакцияларына түседі.
Қосылу реакциялары
Қанықпаған көмірсутектерге қосылу реакциялары тән. Еселі - қанықпаған (қос) байланысы бойынша алкендер қосылу реакцияларына жеңіл түседі. Себебі σ-байланысқа қарағанда әлсіз π-байланысы оңай үзіліп, көміртек атомының босаған валенттіктеріне әрекеттесуші реагент молекуласының атомдары мен атом топтары қосылады.
Реакция нәтижесіне көмірсутек молекуласындағы қос байланыстың біреуі - дара (σ-) байланыс қалып, алкандар немесе олардың туындылары түзіледі.
1. Гидрленуі (сутектің қосылуы) . Алкендер сутекті қосып алып, сәйкес алкандарға айналады. Реакция металл катализаторлар Ni, Pt, Pd қатысында жүреді. Мысалы, пропенге сутек косылғанда, пропан түзіледі:
CH 3 -CH = CH 2 + H - H → CH 3 - CH 2 - CH 3
Немесе осы реакцияны ықшамдап жазсақ:
C 3 H 6 + H 2 → C 3 H 8
Сутек қосыла журетін реакцияларды гидрлену реакциясы деп атайды.
Гидрлену реакциясын зерттеуде Д. В. Сокольскийдің еңбегі зор.
2. Галогенденуі (галогендердің қосылуы) . Алкендер галогендермен әрекеттескенде, реакция қос байланыс бойынша жүріп, нәтижесінде, алкандардың дигалогентуындылары түзіледі. Реакция алкенді галогеннің ерітіндісімен кәдімгі температурада әрекеттестіргенде жүреді. Алкендерді бромды сумен (бромның судағы ерітіндісі) әрекеттестіргенде, ерітіндідегі бромның қызыл қоңыр түсі жойылып, түссіз дибромалкандар (С n Н 2n Вг 2 ) түзіледі:
Н 2 С = СН 2 + Вг 2 → ВгН 2 С - СН 2 Вr
Бромдау реакциясы алкендердің сапалық реакциясы болып табылады, бромның түссізденуі бойынша алкендерді сапальщ анықтауға болады.
Алкендердің фтормен әрекеттесуі шабытты жүреді, ал йодпен әрекеттесуі баяу жүреді.
Этиленге хлор қосып, дихлорэтан С 2 Н 4 С 12 алуға да болады.
3. Галогенсутпектперді қосу . Алкендерге галогенсутектердің қосылуы оңай жүріп, нәтижесінде, галогеналкандар түзіледі:
H 2 C = CH 2 + Н - Сl → H 3 C - СН 2 Сl
Қосылу реакцияларының жылдамдығы, галогенсутек қышқылының күші өсуіне байланысты артады:
HF < HCl < НВг < HI
Галогенсутектердің симметриялы емес алкендерге қосылу реакциялары В. В. Марковников ережесі бойынша жүреді. Галогенсутектің сутек атомы сутек көп көміртек атомына, ал галоген сутек аз көміртпек атомына қосылады:
H 2 С = СН 3 - СН + Н - Вг → Н 3 C - СНВг - CH 3
sp 2 -гибридтенген көміртек атомының электртерістігі sp 3 - гибридтенген көміртек атомына қарағанда жоғары. Сондықтан пропен молекуласындағы дара байланыстыңэлектрон тығыздығы ортаңгы sp 2 -гибридтенген көміртек атомына қарай ығысады. Соның әсерінен қозғалғыш π-байланыстың электрондары шеткі көміртек атомына қарай ауысады, яғни [δ 2 - ] < [δ 1 - ]
Галогенсутек молекуласы полюсті Н δ+ - X δ- болатынын білесіңдер. Теріс заряды көбірек көміртек атомына реагенттің оң зарядты бөлігі (галогенсутектегі сутек атомы) келіп қосылады. Ал қалған бөлігі қос байланыс жанындағы екінші көміртек атомына қосылады.
4. Гидраттану . Алкендер қос байланыс бойынша су молекуласын қосып алып, сәйкес спирттер түзеді:
H 2 C=CH 2 + H - OH ->H 3 C - CH 2 OH
Бұл реакцияның өнеркәсіптік маңызы зор.
Пропен молекуласына судың қосылуы Марковников ережесі бойынша жүріп, пропанол-1 емес, пропанол-2 түзіледі:
СH 3 -СH =CH 2 + H - OH -> H 3 C - CHOH-CH 3
5. Этиленді полимерлеп, полиэтилен алады.
Тотығу реакциялары. Алкендер алкандармен салыстырғанда оңай тотығады.
6. Алкендердің қалыпты жағдайда тотығуы. Этиленді калий перманганатының ерітіндісі арқылы өткізсе, оның күлгін түсі жойылып кетеді. Бұл перманганаттың этиленді тотықтыратындығын көрсетеді. Реакция нәтижесінде екіатомды спирт - этиленгликоль түзіледі.
7. Қатаң жағдайларда тотықтырғанда (күкірт қышқылы, перманганат немесе хром қоспасы катысында) алкен молекуласының қос байланысы үзіліп, оттекті органикалық қосылыстар түзіледі:
HC 3 - CH=CH - CH 3 + /O/ → 2CH 3 - COOH
8. Алкендердің жануы. Сапалық құрамы алкандардай - көміртек пен сутектен тұратын болғандықтан, алкендер де жанады. Бірақ алкендер алкандарға қарағанда шала жануға (CO немесе күйе түзе) бейім болады. Оттек жеткілікті болғанда, алкендердің толық жануы нәтижесінде су мен көміртек (IV) оксиді түзіледі. Мысалы, этилен ауада жаркырап, жылу бөле жанады:
С 2 Н 4 + 3О 2 2СО 2 + 2Н 2 О + Q
Бірақ алкендерді отын ретінде пайдалану тиімсіз болғандықтан, олар энергия көзі ретінде қолданылмайды.
Алкендердің жеке өкілдері және олардың қолданылуы
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz