Мыс: өндіру әдістері, химиялық қасиеттері және қолданылуы


XIX тарау
БІРІНШІ ЖӘНЕ ЕКІНШІ ҚОСЫМША ТОПТАРДАҒЫ МЕТАЛДАР
Қосымша топтардағы металдарды Менделеев кестесінін бірінші тобынан бастап сегізінші тобына қарай, бұрынғы негізгі топтардағы элементтерді оқыған бағытқа қарама-қарсы бағытта өтеміз.
Мыс топшасы. Бірінші қосымша топқа- мыс, күміс және алтын жатады. Бұл қосымша топтағы бірінші элемент мыс болғандықтан бірінші қосымша топты мыс топшасы деп те атайды. Бұл элементтер үлкен периодтардың тақ қатарына орналасқан, бұлардың жалпы сипаттамасы 71-кестеде көрсетілді. Мыс
2Ғе+30
2
= 2ҒеО + 250
2
∆Н°= − 966, 5
кДж/моль
2Сu
2
S+30
2
= 2Сu
2
0 + 2S0
2
∆Н°= - 765, 7
кДж/моль
2Сu
2
0 + Сu
2
S = 6Сu + S0
2
∆Н° = 891, 2
кДж/моль
ҒеО + 5Si
2
O = ҒеSіОз ∆Н°=-24, 7
кДж/моль
Мұндағы реакциялардың көпшілігі экзотермиялық болғандықтан, конверторда керекті 1 100°-1 200° С қызу өзінен-өзі болып тұрады.
Конвертордан шығатын мысты шикі немесе тазартылған мыс дейді, онда 95-98% Сu болады (қоспалары- Zп, Lі, Ғе, РЬ, Аg, Аu т. б. )
Шикі мысты тазалау (рафинирлеу) үшін қайтадан балқытып ауамен араластырады, тотыққан қоспалар шлак түрінде қалқып шығады, мұнан 99, 5% Сu бар мыс шығады
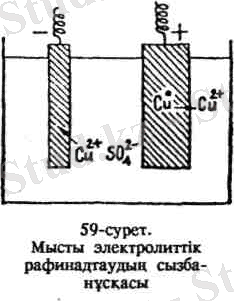
Электр сымдарын жасауға жұмсалатын мыс өте таза болуы керек, өйткені азғана мөлшердегі қоспа болса да металдың электрөткізгіштігін төмендетеді, ондай мыс алу үшін, мысты электролиз арқылы тазалайды. Ол үшін электролит ретінде СuS0 4 ерітіндісі алынады. Анод - тазартылмаған мыс, катод - таза мыс. Ток жібергенде, анодтағы мыс және кернеу қатарын- да мыстың алдында тұратын металдар (Zп, Ғе, Nі) катион түрінде ерітіндіге көшеді. Қалған қоспалар электролиздің түбіне шөгеді, оны анод шламы деп атайды. Ерітіндідегі катиондар катодқа келген жерде, жіберілген ток кернеуінің мөлшері тек мыс катиондары ғана катодтан электрон алып металл түрінде бөлініп шығатындай болады. Сөйтіп катодта өте таза мыс алынады. Анод шламынан күміс, алтын, селен басқа да бағалы заттар алынады, олар қымбат болғандықтан барлық өндіріс шығынын ақтайды.
Химиялық қасиеті
Мыс қызыл түсті, созылғыш, соғылғыш металл. Құрғақ ауада өзгермейді, дымқыл ауада сырты жасыл қақпен қапталады, ондағы реакция:
2Сu + 0 2 + Н 2 0 + С0 2 = СuС0 3 ∙Сu(ОН) 2
Мысты 375° С дейін қыздырғанда, СuО одан жоғары температурада Cu 2 0-ға айналып кетеді. Құрғақ галогендер қалыпты температурада әсер етпейді. Су буы бар жерде фтор, бром және хлор мысты тотықтырады. Мысты қыздырса, хлорда және күкіртте жанып, СuСl, Сu 2 S айналады.
Сутек, көміртек, азотпен мыс тікелей реакцияласпайды. Жоғары температурада көміртекпен Сu 2 С- карбид түзеді.
Мыс (сол сияқты күміс пен алтын да) металдардың кернеу қатарында сутектен кейін орналасқандықтан, оған тек анионының тотықтырғыш қасиеті бар қышқылдар ғана әсер ете алады. Қышқылдардың ішінде мысты жақсы ерітетін концентрленген күкірт қышқылы (қыздырғанда) мен сұйытылған және концентрленген азот қышкылы:
Сu + 2Н 2 S0 4 = СuS0 4 + S0 2 + 2Н 2 0
Сu + 4HN0 3 = Сu (NO 3 ) 2 + 2NO 2 + 2Н 2 0
Мыс қосылыстарда бір және екі валенттік көрсетеді.
Бір валентті мыстың қосылыстары - мыстың (I) оксиді Сu 2 0 табиғатта кездеседі. Қолдан алуға да болады. Cu 2 0 қыздырғанда (200°С жоғары) диспропорциялан а д ы .
Сu 2 0 + Сu 2 0 = 2Cu0 + 2Сu
Сu 2 0 сәл негіздік қасиеті бар, бірақ суда ерімейді, жанама жолмен алынған СuОН-та суда ерімейтін зат.
Cu 2 0- қызыл түсті шыны жасауға, кемелердің суға батып тұратын жерін бояуға қолданылады. Мыстың (I) оксиді мен тұз кышқылы реакцияласқан кезде мыс (I) хлоридінің түссіз ерітіндісі түзіледі, осыған су араластырсақ, ол суда ерімейтіндіктен, ақ тұнба түрінде шөгеді. Табиғатта кездесетін мыс жылтыры Cu 2 S, мыспен күкірт тікелей қосылғанда түзіледі.
Бір валентті мыстың басқа тұздары, екі валенттіге ауысуға бейім келеді. Комплексті қосылыстарынан тұрақтылары аммино-комплекстер, сондықтан бір валентті мыстың суда ерімейтін қосылыстары NН 3 қатынасында еріп кетеді, мысалы:
СuС1 + 2NНз= [Сu(NН 3 ) 2 ] С1
Осы комплекс типтес гидроксидтер [Сu(NН 3 ) 2 ] (ОН) бар, оларда сілтілік қасиет білінеді. Ал, Сu 2 0 амфотерлі болғандықтан, күшті сілтілермен әрекеттескенде қышқылдық қасиет көрсетіп куприттер түзеді, мысалы:
Сu 2 0 + NаОН+Н 2 0 = 2Nа[Сu(ОН) 2 ]
Суда ерімейтін тұздары, концентрленген галогенсутек қышқылдарында ериді:
CuС1 + НС1 = Н[СuС1 2 ]
Екі валентті мыстың қосылыстары. Мыс (II) оксиді СuО- мысты ашық ауада қыздырса қара түсті оксид - СuО айналады. Бірақ оны қаттырақ (800°) қыздырса, мыс (I) оксидіне айналады:
4СuО = 2Сu 2 0 + 0 2
Мыс (II) оксидін алу үшін мыстың негіздік карбонатын немесе нитратын, гидроксидін қыздырса да болады:
СuС0 3 + Сu(ОН) 2 = 2СuО + С0 2 + Н 2 0
Мыс оксидінің тотықтырғыш қасиеті бар, оны кей жерде, әсіресе органикалық анализде қолданады.
Мыс (II) г и д р о к с и д і Сu(ОН) 2 -екі валентті мыс тұзы сілтімен әрекеттескенде түзіледі, мысалы:
СuS0 4 + 2NаОН=Сu(ОН) 2 + Na 2 S0 4
Мыс (II) гидроксиді - көк түсті, суда еруі қиын зат, әлсіз негіздік қасиеті бар. Аздап қыздырғанның өзінде-ақ айрылып мыс (I) оксидін және су түзеді:
Сu(ОН) 2 = СuО + Н 2 0
Екі валентті мыстың тұздарының ішінде маңыздысы мыс сульфаты, оны алу үшін мыс қалдықтарын мына заттармен әрекеттестіреді:
1. Ауа қатынасында сұйылтылған ыстық күкірт қышқылы:
2Сu + 0 2 + 2Н 2 S0 4 = 2СuS0 4 + 2Н 2 0
2. Концентрленген ыстық күкірт қышқылы:
Cu + 2Н 2 S0 4 = СuS0 4 + 2Н 2 0 + S0 2
Мыс (II) оксидін күкірт қышқылында еріткенде де мыс (II) сульфаты түзіледі.
Мыс (II) сульфаты суда жақсы ериді, ерітіндісі көк түсті болады. Ол мыс катионының гидраттанған комплекс ионының [Сu(Н 2 0) 4 ] түсі. Екі валентті мыстың басқа тұздарының да судағы ерітіндісі осы түсті болады. Судағы ерітіндісінен мыс (II) сульфаты СuS0 4 -5Н 2 0 кристаллогидрат түрінде кристалданады. Оны мыс купоросы дейді. Мыс купоросын қыздырса, ақ түсті ұнтақ (СuS0 4 ) және су түзіледі. Ақ ұнтаққа су тиген жері көгеріп шыға келеді, өйткені кристалдық су қосылады.
СuS0 4 + 5Н 2 0 = СuS0 4 ·5Н 2 0
Бұл процесс (гидратация) экзотермиялық процесс.
СuS0 4 ·5Н 2 0 судың ролі әр түрлі, олардың бір бөлігі сутектік байланыс арқылы аквокомплекспен S0 4 2- иондарының арасын жалғайды, оның схемасы:
"н 8 о он, і' +
Сондықтан СuS0 4 ·5Н 2 0 дәлірек формуласы [Сu(Н 2 0) 4 ] S0 4 ·Н 2 0.
Басқа кристаллогидраттардың құрамындағы су молекулаларының саны тақ болып келетіндері (ҒеS0 4 ·7Н 2 0, МgS0 4 ·7Н 2 0 т. б. ) осы принциппен құрылған.
Мыс купоросы басқа металдарға мыс жалатқанда, кейбір бояулар жасауда, ауыл шаруашылығы зиянкестеріне қарсы күресте т. б. жерлерде қолданылады.
[Мұнан басқа, мыстың - мыс (II) хлориді СuС1 2 ·2Н 2 0, мыс нитраты Сu(NOз) 2 ·ЗН 2 0, гидроксокарбонаты СuС0 3 •Сu(ОН) 2 , мыс ацетаты Сu(СН 3 СОО) 2 ·Н 2 0 сияқты әр түрлі іске жаратылатын тұздары бар.
Мыс тұздарының барлығы у, сондықтан мыстан жасаған ыдыстардың барлығын қалайылайды.
Күшті қышкылдардың тұздары суға ерігенде гидролизденіп негіздік тұздарға айналады, ерітіндісі қышқылдық реакция көрсетеді, мысалы:
СuС1 2 + Н 2 О →Сu(ОН) С1+НС1
Басқа тұздардың гидролизінің салдарынан суда нашар еритін - Сu(NO 3 ) 2 ·ЗСu(ОН) 2 , СuS0 4 ·2Сu(ОН) 2 , кейде СuС1 2 •ЗСu(ОН) 2 -«негіздік тұздар» түзіледі. Бұл тұздар полимер түзген катионның туындысы
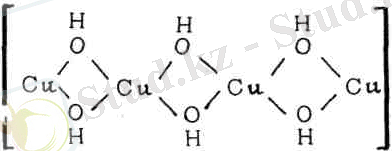
деп қарастыруға болады.
Екі валентті мыс катионы комплекс түзгіш катион, әсіресе аммиак молекулаларын координациялағыш.
Мысалы, мыс сульфаты ерітіндісіне аммиак қоссақ:
CuSO 4 + 4NH 3 = [Сu(NOз) 4 ] S0 4
түзіледі, осы ерітіндіні суалтса, [Сu(NН 3 ) 4 ] S0 4 ·Н 2 0 қара көк түсті кристалдары бөлініп шығады. Комплекс түзу екі валентті мыс ионының қасиеті болғандықтан мыстың гидроксиді де комплекс түзеді:
Сu(ОН) 2 + 4NH 3 = [Сu(NН 3 ) 4 ] + 20Н'
Бұл түзілген ерітіндінің бір маңызды қасиеті клетканы (қағазды, мақтаны т. б. ) ерітеді, сондықтан оны жасанды маталар жасағанда қолданылады.
Бұл айтылып өткен комплекстердің барлығы катиондық комллекстер, бұлармен катар мыстың аниондық комплекстері - купраттар бар.
Мыс гидроксиді концентрленген сілтілерде де ериді, онда
мынадай реакцияның нәтижесінде: Сu (ОН) 2 + 2NаОН→Nа 2 [Сu(ОН) 4 ] натрий тетрагидроксокупрат (II) түзіледі. Бір назар салатын нәрсе, комплекс түзуші мыс катионы бұл арада бейтарап молекула емес, гидроксид аниондарын координациялайды.
Мыстың алынуы
Мыс кендерін алдымен бос жыныстар-дан бөліп байытады. Байытылған оттекті қосылыстардан мыс өндіру үшін оларды кокспен қосып, қыздырып, тотықсыздандырады, мысалы:
Сu 2 0 + С° = 2 Cu + СО
Байытылған мыс колчеданынан мыс өндіру үшін алдымен оны өртеп құрамында күкірттің мөлшерін азайтады:
2 СuҒеS 2 + 0 2 = Сu 2 S + 2 ҒеS + S0 2
Бұдан кейін кеңге бос жыныстармен шлак түзетін флюстер (мысалы SіO 2 ) қосады да, арнаулы пештерде қорытады. Пештін түбіне жиналған балқыған штейндегі ҒеS пен Сu 2 S конверторларға құйып, ауа үрлегенде мы-надай реакциялар жүреді:
2 Сu 2 S 2- + 3 0 2 = 2 Сu 2 0 2- + 2 S0 2
2 ҒеS 2 + 3 0 2 ° = 2 Ғе0 2 + 2S0 2
Темір (II) оксиді флюс кремнии (IV) оксидімен әрекеттесіп шлак түзеді:
ҒеО + Sі0 2 = ҒеSiO 3
Шлактың астыңда мыс (I) сульфиді мен мыс (I) оксидінің әрекеттесуінен мыс түзіледі.
2 Сu 2 0 + Сu 2 S = 6°Сu + S0 2
Осы әдіспен алынған металдың 98-99, 5%-і мыс. Бұл алынған онша таза емес мысты анод ретінде пайдаланып ерітіп, ал мыс иондарын катодта тотықсыздандыру арқылы өте таза рафинадтанған мыс алады. (59-суретте) .
Мыстың химиялық қасиеті.
Мыс қызғылт түсті, созылғыш, электр тогы мен жылуды жақсы өткізетін ауыр металл.
Мыс металдардың электрохимиялық кернеу қатарында сутегінен кейін орналасады. Сондықтан ол активтігі төмен металл. Өзінің химиялық қосылыстарындағы тотығу дәрежелері 1+, 2+, 3+.
Мыс қыздырғанда галогендермен, күкіртпен, оттегімен әрекеттеседі. Ол құрғақ ауада өзгермейді, ал дымқыл ауада оның бетінде мыс гидроксокарбонатының жасыл түсті қабаты түзіледі:
2 С + 0 2 + Н 2 0 + С0 2 = (СuОН) 2 С0 3
Мыстың кешен қосылыстар түзуге қабілеті күшті болғандықтан, циан қышқылдары тұздарының ерітінділерінде сутегі катиондары арқылы оңай тотығады:
Сu° + 2 Н + ОН + 4 NаСN = Nа 2 [Сu(СN) 4 ] + 2 NaОН + Н° 2
Мыс сұйытылған қышқылдармен әрекеттеспейді, бірақ тотықтырғыш ретіндегі ауадағы оттегінің әсерінен оларда ериді:
Сu 0 + 0 2 0 + 4 НСІ = 2 СuС1 2 + 2 Н 2 0 2-
Дегенмен өте жоғары температурада мыс хлорсутекпен әрекеттесіп сутегін ығыстырады:
Сu + 2 НСІ = СuС1 2 + Н 2
Бұл реакцияның жүруі жоғары температурада энтропиялық фактордың артуымен, соған сәйкес ∆С мәнінің азаюымен түсіндіріледі .
Мыс концентрлі күкірт қышқылымен әрекеттесіп тотығады:
Сu + 2 Н 2 S0 4 = СuS0 4 + S0 2 + 2 Н 2 0
Мыс концентрлі азот қышқылын азот (IV) оксидіне, ал сүйытылған азот қышқылын азот (II) оксидіне дейін тотықсыздандырады:
Сu + 4 НNO 3 = Сu (NO 3 ) 2 + 2 NO 2 + 2 Н 2 0
3 Сu + 8 НNОз + ЗСu (NO 3 ) 2 + 2 N0 + 4
Мыстың осы қышқылдармен әрекеттесу жылдамдығы температуранын жоғарылауына байланысты артады.
Мыстың қосыластары. Тотығу дәрежесі 1+ болатын мыстың қосылыстарына Сu 2 0, СuОН, СuСІ, Сu 2 S тұздары жатады.
Мыс (II) оксиді Си 2 0 қызыл түсті ұнтақ зат. Мыс (II) оксидін жоғары температурада қыздыру арқылы мыс (I) оксидін алады.
4 СuО 2- = 2 СuО + 0 2
Мыс (I) оксидіне тұрақсыз мыс (I) гирдоксиді сәйкес келеді. Бір зарядты мыс гидроксиді аммиакпен тұрақты кешен қосылыстар түзеді:
СuОН + 2 NH 3 = [Сu (NH 3 ) 2 ] ОН
Мыс (I) оксидіне тұз қышқылымен әрекет ете отырып, мыс (I) хлоридын аламыз:
Сu 2 0 + 2 НСІ = 2 СuСІ + Н 2 0
Мыс (I) хлориды тұз қышқылында мыс (II) хлориды мен металл мыстың қоспасын қыздыру арқылы да алынады:
СuС1 2 + Сu = 2 СuСІ
Бұлардан басқа мыс (I) ионы броммен, иодпен сәйкес тұздар түзеді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz