Металдардың жалпы сипаттамасы, физикалық және химиялық қасиеттері мен алу тәсілдері


МЕТАЛДАРДЫҢ ЖАЛПЫ СИПАТТАМАСЫ
Барлық химиялық элементтерді4 4 / 5 -нен көбі металдар. Менделеев кестесін сол жақтағы жоғарғы бұрышынан оң жақтағы төменгі бұрышына қарай, Ве, А1, Gе, Sb, Ро элементтерінің үстімен екіге бөлсек, астыңғы үш бұрышта (және 8-топта) металдар болады. Кестеден металдар негізгі топтарда да, қосымша топтарда да бар екенін, ал қосымша топтардағы элементтердің барлығы металдар, негізгі топтардан, біз әлі оқымаған, III, II, I топтардын, да элементтерінің көпшілігі металдар екенін көреміз. Бұл тарауда металдардың жалпы сипаттамасына, табиғатта таралуына, алу тәсілдері, физикалық және химиялық қасиеттеріне т. т. тоқталамыз.
ТАБИҒАТТАҒЫ МЕТАЛДАР ЖӘНЕ ОЛАРДЫ АЛУДЫҢ НЕГІЗГІ ТӘСІЛДЕРІ
Табиғатта металдар көбіне түрлі қосылыстар түрінде кездеседі, кейбіреулері бос, еш затпен қосылыспаған күйде болады. Ондай жеке кездесетін түрін сап металл дейді, ол - платина, алтын, күміс және мыс, қалайы, сынап сиякты металдар. Соңғы үш металл, көбіне қосылыс түрінде болады.
Металдардың жер кыртысында кездестін косылыстары, түрлі минералдар түрінде болады.
Ішінде металдарды4 қосылыстары бар минералдар мен тау жыныстарын, құрамындағы металды өнеркәсіптік жолмен шығарып алу экономика жағынан тиімді болса, кен (руда) деп атайды. Демек қандайда болсын кен құрамында керекті бөлігімен қатар, керексіз кұм, саз, әктас т. б. бос жыныс деп аталатын бөлімі болады. Мысалы, темір кендерінде таза темір 50-70% болса, ондай кенді іске асыру экономика жағынан пайдалы дейді, мыс кендерінде, таза мыс 1% болса да, ол бай кен болып саналады, ал алтынға келсек, онда проценттін, оннан, жүзден бөліктері бар жыныстардың өзі тиімді деп есептеледі.
Металдардың кені болып саналатын қосылыстар көбіне оксидтер, сульфидтер және түрлі тұздар (карбонат, галогенид, сульфат, силикат, фосфат т. б. ) .
1. Оксид-кендердің мысалдары - қызыл темір тас (Ғе 2 Оз), қоңыр темір тас (2Ғе 2 Оз-ЗН 2 О), магнитті темір тас (ҒеО-Ғе 2 О 3 ) ; боксит (А1 2 Оз-2Н 2 О) ; пиролюзит (МпО 2 ) ; калайы тас (5пО 2 ) ; қызыл мыс кені (Си 2 О), хромды темір тас [Ғе(СгО 2 ) 2] т. т.
2. Сульфид кендері, жер қыртысында біраз терендікте жатады, мысалы, колчедандар: мыс колчеданы (СиҒе3 2 ) ; темір колчеданы (ҒеS2) ; жалтырлар: мыс жалтыры (Си 2 5) ; қорғасын жалтыры (Рb5) ; а л д а у ы ш т а р: мырыштікі (ZnS), күмістікі (Аg 2 5), сыр (Нg5) т. б. Сульфид кендерінің көпшілігінде бірнеше металл аралас болады, мысалы, қорғасын мен мырыш аралас, оның үстіне алтын, күміс т. б. қоспасы болады. Мұндай көп металды кенді полиметалды кен деп атайды.
3. Тұз кендері. Кей металдар, әсіресе, периодтық системаның I, II негізгі топтарындағы металдар және сирек металдардың біразы жаратылыста көбінесе тұздар түрінде кездеседі. Ол тұздар теңіздердің, не ащы көлдердің суында еріген күйде және қазба тұз түрінде жер қабатында болады (бұлар да бұрынғы теңіздердің қалдығы) . Ол тұздардың да химиялық құрамына қарай химиялық атымен қатар минералдық аты бар. Айталық, галогенидтер - карналит (КС1-МgС-6Н 2 О), сильвинит (КСІ-NаСІ), сильвин (КСІ), галит (NаСІ), флюорит (СаҒ 2 ), бишофит (МgС1 2 -6Н 2 О), сульфаттар - каинит (КСL •МgCL 4 -6Н 2 О), кизерит (МgSО 4 -Н 2 О), полигалит (Қ 2 SО 4 -МgSО 4 -2СаSО4-2Н 2 О), лангбейнит (К 2 SО 4 -2Мg5О 4 ), эпсомит (МgSО 4 -7Н 2 О), гипс (СаSО 4 -2Н 2 О), ангидрит (СаSО 4 ), тенардит (Nа 2 SО 4 ), мирабилит (Nа 2 SО 4 • 10Н 2 О), карбонаттар - доломит (СаСОз-МgСОз), мрамор (СаСОз), сидерит (ҒеСОз), смитсонит (2пСО 3 ), церусит (РbСОз) сода (Nа 2 СОз* 10Н 2 О) т. б
Енді кен ішінде осы қосылыстар түрінде болатын металдарды шығарып алу мәселесіне келелік. Металды адам баласы мұнан 5 000 жылдай бұрын өндіре бастаған. Содан кейінгі жердегі адамзаттың материалдық, рухани және мәдени тұрмысынын дамуы, металл алу және оны пайдалана білумен байланысты болған. Бірақ, XX ғасырдың басында бар болғаны 15 металл, негізінен темір, мыс, корғасын, қалайы, мырыш, күміс, алтын ғана қолданылып келді. Соңғы қысқа мерзімде алюминий, магний, хром, никель, марганец және басқа металдардың маңызы артып, сонымен қатар қазіргі ғылым мен техника металдардың бәріне де қолданылатын орын тауып, барлығын адам баласының қызметіне косты.
Қазіргі кезде адам керегіне тұтынылатын металл мөлшері орасан көп, мысалы, осы ғасырдың ортасында бүкіл жер жүзінде жылына 150 миллион тонна темір, мыс, корғасын, алюминий әрқайсысы 2 миллион тоннадан, қалайы, никель әрқайсысы 200 мың тоннадан артық өндірілді.
Отанымызда металл өндіру жыл сайын өсуде, әсіресе темір (шойын) өндірісі жедел дамуда.
Металл қоры жағынан, оны өндіруде Қазақстанның қосар үлесі зор. Қазақстан Ғылым академиясының президенті, академик Қ. И. Сәтпаевтың айтуынша Қазақстан еліміздің гауһар қоры; Қазақстан хром және ванадий байлығынан жер жүзінде бірінші орын алады, ал темір, мыс, қорғасын, мырыш, күміс, қадмий, ванадий, хром, вольфрам, молибден және баска кейбір металдардың қоры жөнінде біздің елде бірінші орын
алады.
Кен кұрамындағы металды шығарып алатын өнеркәсіп саласын металлургия дейді. Химия металлургиямен тығыз байланысты ғылым, өйткені металл өндіру процестері химиялық реакцияларға негізделген. Металлургия сол химиялық реакцияларды өндірістік масштабта жүргізудің әдістерін, оған керекті аппараттарды табады.
Қазіргі заман металлургиясының теориялық және практикалық негіздерін кұруға Д. К. Чернов, Н. С. Курнаков, М. А. Павлов, И. П. Бардин т. б. Кецес . ғалымдары үлкен үлес косты.
Кендегі металды шығарып алудан бұрын көп жағдайда ол кенді әуелі байыту к е р е к. Кенде керекті бөлігімен қатар, керексіз құм, саз, әктас т. б. сиякты, бос жыныстар болады, ол бос жыныстар кейде өте көп те болады, кеннің сол керекті бөлімін бос жыныстан бөліп ажыратуды кенді байыту деп атайды. Кен байытудың қарапайым түрлерінен басқа флотация (ағылшынша flataton қалқып шығу деген сөзден) көп қоланылады. Флотацияның техникасы оңай, оның негізі - кен мен бос жыныстың бөлшектерінің адсорбтағыш қасиеттерінің әр түрлі болуында. Флотация жасау үшін кенді өте ұсақ етіп ұнтақтап, сумен араластырып (пульпа түрінде) арнаулы ыдысқа құяды; суға полюстілігі нашар бір органикалық зат, айталық карағай майын қосады (1 г кенге 400 г есебінен) . Бос жыныс бөлшектерінің сыртына су молекулалары адсорбцияланады (өйткені олар гидрофильдік заттар), кеннің, әсіресе сульфидтің, бөлшектерінің сыртына су молекулалары адсорбцияланбайды (өйткені олар гидрофобтық заттар) ал майдың молекулалары адсорбцияланады.
Ыдыстың астыңғы жағынан сығылған ауа жібергенде, сол ауа көпіршіктерінің сырты майдың жұқа қабыршағымен қапталады. Осындай ауаның көпіршігі жоғары көтеріліп ыдыстың бетінде көбік түзеді, оның сыртындағы маймен адсорбцияласқан кеннің бөлшектері, ілесіп жоғары шығып, көбік ішінде болады. Бөлшектеріне су сіңген бос жыныс ауырлап ыдыс түбіне шөгеді.
Көбікті сыпырып алып, сығып байытылған кенді алады .
Кен ішіндегі металды алу әдісі - оның химиялық құрамына байланысты.
Оксидкендері тотықсыздандырып барып ішіндегі металды алады. Тотықсыздандырғыш ретінде көбінесе көміртек қолданылады, мысалы:
Кенмен араласып пешке түскен бос жыныстарды (олар көбіне кұм SіО2) бөліп шығару үшін шахтаға флюс, немесе балқытқыш араластырады. Бос жыныспен флюс реакцияласып оңай балқитын қосылыстар - шлак түзеді. Шлак жеңіл болғандықтан сұйық күйде балқыған металдың үстінде болады, оны пештің арнаулы аузынан бөлек ағызып алады. Кейбір қиын балқитын металдарды алуда тотықсыздандырғыш ретінде алюминий колда-нады, өйткені алюминий тотыққанда өте көп жылу бөліп шығарады (бір моль (А1 2 О 3 ) түзілгенде 1, 610 33 кДж), бұл реакцияны шағын ыдыста өткізсе, 3 500°-қа дейін қызу береді. Бұл әдісті алюминотермия дейді, оны орыс ғалымы Н. Н. Бекетов (XIV тарау, § 5) ұсынған. Хром, марганец, молибден және басқа қиын балқитын металдар осы алюминотермия арқылы алынады:
Таза металл және сирек металдар алу үшін тотықсыздандырғыш ретінде сутек қолданылады:
Сульфид кендерін әуелі арнаулы пештерде (конвертор, немесе ватержакет) күйдіріп, құрамындағы күкіртті де, металды да оксидке айналдырады:
Одан әрі, оксидтерді жоғарыда айтқандай тотықсыздандырады.
«Қайнаған тәрізді күйде» күйдіру. Ұсақталған қатты заттарды «қайнаған тәрізді күйде» әрекеттестіру, өнеркәсіптің түрлі салаларында өріс алды. Ұсақ ұнтакталған затты шілтер үстіне салып, астынан шілтердің тесік-тесігінен ауа (баска газ) үрлейді, сонда ұнтақ заттың ауа тесіп шыққан беті бүлкілдеп, қайнап жатқан тәрізді болады. Соның нәтижесінде ұнтақ зат, тозан, түрінде көтеріліп, ауамен (басқа газбен) жақсы араласып, бұл «қайнаған тәрізді күйде» реакцияласуы өте жылдам болады.
Сульфид кендерін күйдіріп өртегенде осы әдісті қолданатын болды, сонда өндірістің өнімі 3-4 есе артады.
Т ұ з кендеріндегі литий, натрий, калий, кальций, магний, бериллий т. б. сияқты металдарды, ол тұздарды балқытып, электролиздеп алады. Алюминийді балқыған глиноземді (АІ 2 Оз) электролиздеп алады.
Тұздар құрамындағы металдар, оң зарядты ион түрінде болады. Электролиздегенде ол оң иондар теріс электродқа (катодқа) келіп, тиісті мөлшерде электрон қосып алып, нейтрал атомға айналып, балқыған тұздан бөлініп шығады.
Электролиз әдісін тек балқыған емес, еріген тұздарға және мыс, никель т. б. металды тазалауға (рафинация) қолданады.
Электролизден басқа әдістердің барлығы жоғары темпаратурада жүреді, оларды пирометаллургия әдістері деп атайды.
Кейбір кендерде керекті металдың аздығы сондай, олар флотациямен де байымайды, ондай кендерге гидрометаллургия әдістерін қолданады. Оның мазмұны - кенді өте ұсақтап түрлі реагенттермен (қышқыл, сілтілердің ерітінділері) әрекеттейді. Сонда ерітіндіге тұз түрінде көшкен металды көбінесе электролиздеу арқылы шығарып алады.
Бұл айтылған металдарды алудың жалпы ортақ әдістері, жеке металды алудың бұдан өзгеше ерекшеліктерімен сол металды өткенде танысамыз.
Таза металдар алу. Қазіргі металлургияның алдында тұрған басты міндеттердің бірі - кейбір металдарды аса таза күйінде беліп алу. Оның себебі, олар бүгінгі техникада шектен асқан таза күйінде қолданылады. Мәселен, жартылай (шала) өткізгіштерде ядролық реакторлар мен қазіргі аса төзімді болаттың арнайы түрлерінде металдардың тазалығы өте жоғары бо-луы талап етіледі. Осыған орай өнеркәсіп кейбір металдардың тазалығын 99, %-тен астам етіп отыр.
Металдарды тазалаудын, әр түрлі әдістері бар. Мәселен, вакуумда айдау мен қайта балқыту аркылы металдардың әртүрлі ұшқыштығына сай қоспадан бөліп алады. Ал, кейбір металдар төменгі температурада аса ұшқыш қосылыстар түзеді, оларды қатты қыздырса, ыдырап таза металл бөледі. Зоналап балқыту әдісі қоспаның қатты және балқыған металда әртүрлі еруіне негізделген. Өте жоғары қызуы бар зонадан әрлі-берлі баяу жылжып өтіп тұратын металдың таза кристалдары ортасына шоғырланып, қоспасы шеттеріне ығысады. Осылайша көптеген қайталаулардан соң өте таза металл алынады.
Өте таза күйдегі металдардың қасиеттері қалыпты жағдайдағыдан біршама өзгеше болады. Мысалы, олардың серпімділігі, иілгіштігі өте жоғары болып, электр, жылу өткізгіштігі артады.
МЕТАЛДЫҚ БАЙЛАНЫС
Металдардағы химиялык байланыстың табиғатын түсіну үшін, оның бұрын қарап өткен коваленттік және иондық байланыстардан басты екі ерекшелігі бар екенін білу қажет. Біріншісі - металдардың жоғары электрөткізгіштігі мен жылуөткізгіштігі, екіншісі - қалыпты жағдайда кристалдық күйде болуы (сұйық сынапты қоспағанда) . Металдарға ғана тән бірінші ерекше қасиет оның өне бойында еркін қозғалатын электрондардың (бұрын «электрон газы» деп атаған) болатынын көрсетсе, екінші қасиет кристалдағы атомдар өзара қос электронды локальданған (бір жерге шоғырланған) байланыспен ұстаса алмайтындығын көрсетеді, себебі олардың арасындағы валенттік электрондар саны мұндай қос электронды ковалентті байланыстар түзуге жетімсіз келеді.
Металдардағы химиялық байланыстың табиғаты, әрі олардағы ерекшеліктерді литийді мысалға ала отырып түсіндірейік. Литий кубтық көлемді центрлеген тор кұра кристалданады (138, а-сурет) демек, оның кубтың ортасында орналаскан 1 атомы көрші тұрған бұрыштардағы 8 атоммен байланыс түзеді. Кәдімгі ковалентті қос электронды 8 байланыс түзу үшін, ортадағы литий атомы 8 электрон жұмсар еді, ал оның бар болғаны бір ғана валенттік 2в' электроны бар. Кристалдық тор түзіп атомдар жақындасқанда көрші орналасқан атомдардың валенттік орбиталь-
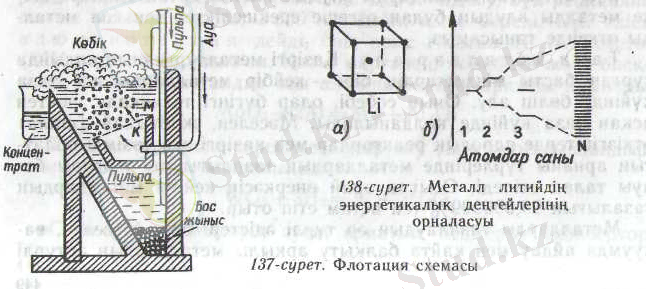
дары қаптасады. Әрбір литий атомынан байланыс түзуге 4 валенттік орбитальдар (бір 5, үш р) қатынасады. Ал, әрбір литий атомы байланыс түзуге бір ғана электроннан беретін есепке алсақ, кристалдағы орбитальдар санынан электрондар саны әлдекайда аз болатыны өзінен-өзі түсінікті. Сондықтан ортақ электрондар бір орбитальдардан екінші орбитальдарға оңай ауыса алады. Оның үстіне металдардың иондану энергиясы кішірек келетін-діктен, валенттік электрондардың бөлінуі оңай болады, олар бүкіл кристалдың өне бойында еркін қозғалады. Осы еркін электрондар барлық атомдардың арасында металдық байланыс туғызады.
Сонымен, коваленттік және иондық қосылыстармен салыстырғанда металдарда аз ғана электрондар көптеген атом ядроларын өзара байланыстырып, еркін қозғалыста болады екен. Басқаша айтқанда металдағы химиялық байланыс локальданбаған болып шығады. Олардың электрөткізгіштігінің жоғарылығы да осымен түсіндіріледі.
Металдық байланыс түзетін элементтердің атомдарының сыртқы деңгейінде аз ғана электрондар саны болады, олар 5- және й- металдар. Бірақ байланыскан атомдардың қаптасатын орбитальдарынық көптігі сондай олар энергиясы жуықтау (пз пен пр) болғандыктан өзара бірігіп бір өткізгіштік зона береді (138, б-сурет) . Сыртқы өрістің әсерінен электрондар өткізгіш зонаға ауысып, металдық өткізгіштікті іске асырады.
Металдық байланыс қатты күйдегі, сұйық күйдегі металдардың бәріне тән. Тек бу күйіне ауыскан металл атомдары өзара ковалентті қос электронды байланыспен байланысқан. Кристалдағы байланыс, металдың бу күйіндегі молекуласындағы байланыстан берік, сондықтан металл қатайып кристалданғанда көп жылу бөліп шығарады.
Мысал ретінде литийдің металл және молекула түріндегі энергетикалық сипаттамаларын келтірейік. Кристалдағы Lі-Li байланысының ұзындығы 0, 300 нм., ал Lі2 молекуласындағы 0, 267 нм. Бірақ, металдың кристалының атомдану энергиясы ΔН ат =163, 1 кДж/моль, молекуланікі Δ Ң ат = 108, 7 кДж/моль, яғни моль-атомға шаққанда кристалдағы металдық байланыс энергиясы газдағы коваленттік байланыстан 3 еседей берігірек келеді.
Металдық байланыс металдардың барлық қасиеттерін: физикалық, механикалық, оптикалық, магниттік т. б. түсіндіре алады.
МЕТАЛДАРДЫҢ ФИЗИКАЛЫҚ ҚАСИЕТТЕРІ
Металдарды сипаттаушы қасиеттерінің бастылары - олардың электр-және жылуөткізгіштігі, бұлар бұрында айтылған бос электрондардың болуынан. Металдардың бұл қасиетін электртехникада, қыздырғыш және суыткыш аспаптар жасауда кең қолданады. Электрөткізгіштік пен жылуөткізгіштік пропорциялы, бір бағытта өзгереді (60-кесте) . Жылуды да, электр тоғы да жақсы өткізетін элементтер - күміс, мыс, алтын мен алюминий болып есептеледі.
60-кесте
Кейбір металдар абсолюттік нөл температурасына жуық суығанда, асқынөткізгіштік деп аталатын қасиет көрсетеді. Бұл кезде металдар, электр тогының өтуіне ешбір кедергі келтіре алмай, іс жүзінде өзінің бойынан кез келген мөлшерлі токты өткізіп жіберіп отырады. Металдардық асқынөткізгіштік қасиеті температура төмендеген сайын туа бастамайтын, белгілі бір кризистік температурада бірден пайда болатын құбылыс.
Металдардың барлығы жалтырайды, оның себебін былай түсіндіреді. Жарық сәулесі жолында кездескен заттан бөгелмей өтіп жатса, ондай зат біздің көзімізге мөлдір (шыны) болып көрінеді сәуле түгел сіңіп жатса, зат кара (күйе) болып көрінеді. шағылысып бетінен қайтып жатса-ак, ақ жалтыр болып көрінеді, Демек, металдардың жалтырауы түскен сәуленің шағылуынан. Металдар тек кесек, тұтас күйінде жалтырайды, ұнтақ түрінде, алюминий мен магнийден басқасы, жалтырамайды. Металдардың өте жалтырауығы күміс, одан кейін палладий; бұлардың ол қасиеттерін айна жасауға пайдаланады.
Металдардың пластикалық - созылғыш, иілгіш, соғылғыш - қасиеті де ішкі құрылымымен байланысты. Сырттан механикалық әсер еткенде ион қабаттары жанасқан жерлерінде ығысып, сәл ауысады. Ертедегі адам металды балқытудан бұрын оны соғып, керекті балға, балта, садақ жебесін т. т. жасауды білген. Пластикалық жағынан металдарда бірінші орынды алтын алады - алтыннан тартқан сым қылдан жіңішке, көзге көрінер-көрінбес болады. Сурьма мен висмут морт келеді.
Бұл айтылған қасиеттерден басқа металдарды іс жүзінде қолданғанда керекті бірнеше қасиеттері бар, ол - балқығыштық, қаттылык және меншікті салмағы.
Металдардың балқу температуралары әр түрлі - оны мына кестеден көруге болады (61-кесте) .
61-кесте Кейбір металдардың балқу температуралары
Әдетте металдардың балқу температурасы 800°-тан кем болса, оңай балқитыңдар 800°-тан жоғары болса, қиын балқитындар деп бөледі. Бу күйіне ауысқанда металдар жеке-жеке атомдардан тұрады. ,
Металдардың сынаптан басқасы қатты болғанымен, қаттылығы әр түрлі, мысалы, хромға алмаздан басқа еш қатты зат батпайды, ал калийді саз балшықтай саусақпен илеуге болады (62-кесте) .
62-кесте Кейбір металдардың қаттылығы (Мосс шкаласы)
Меншікті салмақ жағынан да металдардың айырмашылығы үлкен; жер бетінде белгілі қатты заттардың ең ауыры осмий, ең жеңілі литий, екеуі де металл, бірінен бірі 40 есе ауыр.
Металдарды ауыр, жеңіл деп бөледі, шартты келісім бойынша 5-ке тең меншікті салмақ (63-кесте) шекаралық меншікті салмақ деп алынады.
63-кесте
Металдарды тегіне сай, химиялық ұқсастығына, табиғатта таралуына қарай мынадай топтарға бөледі:
Қара металдар - бұған темір және оның құймалары жатады; түсті металдар - бұған темірден баска барлық металл біткен кіреді; Асыл металдар: Ag, Аu, Рt, Іr; сілтілік металдар: Li, Nа, К, Rb, Сs, Ғr. С і л т і л ік же р металдар: Са, Sr, Ва, Ка; с и р е к кездесетін металдар: V, Мо, Ве, In, Zr, Lа, Nb, Rе, Gе. (Сирек металл деген ұғым металдың табиғаттағы қорының молаюына қарай, әрі оларды таза күйінде алу әдісінің жеңілдеуіне сәйкес өзгеруі де мүмкін, онда ол сирек металдар қатарынан шығып қалуы ықтимал. )
ҚҰЙМАЛАР
Осы кезде металдарды жеке, таза күйінде сирек қолданады, өйткені ғылым мен техниканың талабын жеке металдардың қасиеттері қанағаттандыра алмайтын болды. Металдарды араластырып құйма жасаса, құаймалардың құрамын қажетке сәйкес
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz