Катализ және ферменттік катализ: механизмдері, түрлері және әсер етуші факторлар


Жоспар
- Кіріспе.
- Негізгі бөлім
А) Катализ- катализаторлар туралы ілім.
Б) Катализатор әсер ететін факторлар.
С) Катализ түрлері.
Д) Ферменттер
Е) Ферменттер катализаторлар ретінде
III. Қорытынды.
Пайдаланған әдебиеттер.
Катализаторлар- (грекше тоқтату, қыздыру, ыдырау реакциясы) жылдамдығын тез өзгертетін, бірақ өздері реакция кезінде химиялық құрамы өзгермейтін затарды айтамыз.
Катализатор қатысында жылдамдықтары өзгеретін реакцияларды каталиттік деп атайды.
Өте ертеден биологиялық катализаторлардың (ферменттердің ) әртүрлі ішімдіктерді дайындауда нан, сыр пісіруде, тері илеуде ролі белгілі ХVIII ғ. Соңы және XIX басында эфирлену (К. Шееле 1782 ж) , дегидратация (Ж. Пристли, 1778 ж) полисахариттердің гидролизі (Г. Кирхгоф 1811 ж) , раекциялары арқылы басқа катализаторлар ашылды . М . Кучеров ацителенді сұйытылған күкірт қышқылының гидратациялау реакциясын сынап тұздары қатысында жасады, М. Зайцев (1877ж ) . Платина катализаторын органикалық реакцияларға қолданды.
Катализатор қызметін кез келген агрегаттық күйде болатын әр түрлі бейорганикалық және органикалық заттар атқарады.
Кейбір жағдайларда реакция өнімі, ыдыстың беті мен қабырғасы, шаң, бу сияқты әр түрлі қоспаларда катализаторлық қызмет атқаруы мүмкін.
Егер катализатор реакцияның жылдамдығын арттырса катализ оң, ал реакция жылдамд
 ығын төмендетсе, теріс деп аталады. Мысалы, ретінде сутек пероксидін алайық. Оған марганец (IV) оксидін аздап қосса, оның ыдырауы тез жүреді ; ал ацетанилидті қосса мүлдем ыдырамайды.
ығын төмендетсе, теріс деп аталады. Мысалы, ретінде сутек пероксидін алайық. Оған марганец (IV) оксидін аздап қосса, оның ыдырауы тез жүреді ; ал ацетанилидті қосса мүлдем ыдырамайды.
Кейде реакциялық қоспаға еш бір катализатор қоспаса да, ондағы реакция өнімі катализатор болып реакция жылдамдығын өзгертеді. Мұндай реакцияларды автокаталиттік, ал құбылысты автокатализ деп атайды.
Өзін өзі катализдейтін реакцияларға мысал ретінде сіркеэтилді эфирдің бейтарап ортадағы сабындалу реакциясын алуға болады :

Бұл реакция кезінде пайда болған сірке қышқылының түзілген алғашқы малекулалары ацетат анионы мен сутек катионына ыдырайды.

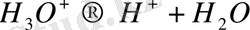
Сутек ионы сірке этилді эфирге шабуыл жасап, оның сабындалу реакциясын тездетеді. Сутек ионы көбейген сайын негізгі реакция жылдамдығы арта түседі де, реакция нәтижесіндегі қышқыл өзін өзі катализдейді.
Автокаталиттік реакциялар ерекше сипатқа ие олар катализатордың ауыспалы өсу канцентрациясында өтеді. Сондықтан бұл реакциялардың жылдамдықтары бастапқы кезде тез өсіп, тек келесі сатыларда әрекеттесуші заттардың концентрацияларының кенді себебінен жылдамдық азая бастайды . Автокаталиттік реакция өнімінің кенетикалық қисығы суретте берілген .
Автокатализ мысалына KMnO
 тотығуын да келтіруге болады, оның жылдамдығының артуы реакциялық ортада жүрген Mn
тотығуын да келтіруге болады, оның жылдамдығының артуы реакциялық ортада жүрген Mn
 катионының әсерінен жүзеге асады .
катионының әсерінен жүзеге асады .
Сол сияқты кейбір үдерістерде қолданылатын катализатордың құрамына енетін өте аз қоспа оның қабілетін не активтілігін төмендетіп, қайсыбір жағдайларда мүлдем жояды . Мұндай зиянды қоспаларды
ингибиторлар
немесе
каталиттік улар
деп атайды. Мысалы, мыс катализаторды көміртек (II) оксидінің өте аз мқлшері уландырса платинаның каталиттік әсерін селен металының қоспа іздері ақ төмендетеді, ал темірден әзірленген катализаторлар үшін күкірт пен оттек және олардың қосылыстары, оксидтері өте зиянды . Ингибиторлар практикада концерванттар, антиоксиданттар және т. б. . жылдамдықтарын реттеу үшін қажет. Кейде екі не одан көп катализатор қоспасының активтілігі осы қоспа құрамына енетін жекеленген катализаторлардың активтілігінен едәуір артық болуы мүмкін. Мысалы аммиакты оттекпен тотықтырып азот (II) оксидін алып, одан азот қышқылын синтездеу працесін платина не висмут (III) оксидімен, не темір (III) оксидімен катализдеп, реакция жылдамдығын, оған байланысты өнім шығымдылығын артырады. Әрине, платинаны катализатор ретінде қолданғанда, реакция жылдамдығы жоғарлайды, ал оксидтерді пайдаланса, төмендейді . Катализатор құны да платинадан темір (III) оксидіне қарай бірнеше есе арзандайды . Осы үдеріске висмут (III) пен темір (III) оксидінің (Bi
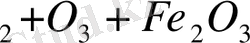 ) арзан қоспасын катализатор ретінде қолданса, аммиактың тотығу реакциясы жоғарыда келтірілген үш катализатордың да жеке жылдамдығынан артық болады екен .
) арзан қоспасын катализатор ретінде қолданса, аммиактың тотығу реакциясы жоғарыда келтірілген үш катализатордың да жеке жылдамдығынан артық болады екен .
Таңдамалы әсер биологиялық катализатор ферменттерде ерекше сезіледі. Әр ферменттер белгілі бір мөлшеріне зат молекуласындағы беллгілі бір химиялық байланысқа әсер етеді. Мысалы, сахароза ферменті сахарозадағы глюкоза мен фруктоза арасындапғы глюкозидтік байланысты және трисахарид рафинозадағы осындай байланысты дисахарид (мелибиоза және фруктоза түзетіндей үзеді) .
Катализге әсер ететін факторлар
Реакция жылдамдығына қандай факторлар әсер етсе, катализге де солар әсер етеді.
Температура әсері: температура артқанда каталиттік үдерістердің жылдамдықтары артады, бұл реакция бағытына және катализатор активтілігіне де әсер етеді. Әрбір катализатордың жоғары активтілігі сол реакцияға тән белгілі температурада байқалады . Үдерістің оңтайлы температурасын өзгерту катализатор активтілігіне нұқсан келтіреді . Бұл, әсіресе, табиғаты ақсылдық ферменттерде қатты білінеді .
Қысымның әсері . Қысым (немесе көлем) өзгеруі кейбір каталиттік реакцияларға елеулі әсер етеді . Кейбір каталиттік реакциялар қалыпты қысымда өтпейді (жоғарғы спирттер синтезі және т. б) . Қысымды арттырғанда молекулалар арасындағы тиімді соқтығысулар артып, реакция жылдамдығы да өседі.
Еріткіштер әсері. Ерітінділерде өтетін каталиттік үдерістерде еріткіштің молекулалары әрекеттесуші молекулаларды реакцияға қабілеттірек етуі мүмкін. Мысалы, полярлы еріткіштердің молекулалары әрекеттесуші молекулаларды белсенді ионды түрге оіңай ауыстырылады . Промоторлар және ингибиторлар әсерлері туралы жоғарыда айтылды.
Катализ түрлері .
Каталиттік реакцияларды катализаторлардың және әрекеттесуші заттардың фазалық күйлеріне байланысты гомогенді және гетерогенді катализ деп бөледі мұнан басқа, ферменттік үдерістермен байланысты микрогетерогенді катализ түрі бар.
Гомогенді катализ .
Әрекеттесуші заттар мен катализаторлар біртекті сұйық немесе газ жүйесін құраса, яғни олар бір фазалық жағдайда болса, онда катализ гомогенді деп саналады . Реагенттер мен катализаторлар біртекті араласады және олар бейтарап молекула, немесе иондық, немесе комплекс түрінде болады .
Мысалы, көміртек (II) оксиді су буының катализдеуімен көміртек (IV) оксидіне айналады . Сол сияқты күкірт (IV) азот оксиді(II) оксидінің катализдеуімен күкірт (VI) оксидіне айналады, күрделі эфирлердің сабындалуы, дисахаридтердің күшті қышқыл мен немесе сілтілік ерітіндісі арқылы гидролизденуі т. б.
Гомогенді катализдің жүруін аралық қосылыстар теорисы түсіндіріледі . Бұл теория көптеген дәл, жетілген зерттеу әдістерімен дәлелденген,
А + В
 АВ каталиттік реакцияда К катализатор реагентпен (А) әсерлесіп, аралық тұрақсыз өнім береді :
АВ каталиттік реакцияда К катализатор реагентпен (А) әсерлесіп, аралық тұрақсыз өнім береді :
А + К
 АК
АК
АК- аралық өнім.
Бұл үдеріс қайтымды болуы да мүмкін . Аралық зат не ыдырайды немесе екінші зат молекуласымен әсерлеседі :
АК+В
 АВ+К
АВ+К
Бұл реакция катализаторды жүйеге енгізу үдерістің активтендіру энергиясын төмендетуге әкелгенде ғана жүреді . Мысалы, жоғарыда келтірілген күкірт (VI) оксидінің азот (II) оксидінің қатысуымен тотығатын реакциядағы аралық қосылыстарды және жалпы процесті былай көрсетуге болады :
2SO
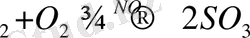
- 2NO+O
- 2NO
Мұндағы 1 және 2 реакциялар аралық қосылыстардың түзілуін және катализатордың бастапқы қалпына келуін көрсетеді .
Ерітінділердегі гомогенді катализде химиялық әрекеттесу сипаты бойынша каталиттік үдерістерді негізгі екі топқа бөлінеді : қышқылдық -негіздік және тотығу - тотықсыздану .
Гетерогенді катализ.
Гетерогенді катализ деп әрекеттесетін реагент пен ондағы катализатор әр түрлі фазада болатын реакцияларды айтады . Гетерогенді катализде катализатор қатты зат, ал реагенттер не сұйық, не газды күйінде болады . Мұндай реакциялар екі фаза аралығындағы, яғни ф
 азалық бетте, катализатордың бетінде жүреді.
азалық бетте, катализатордың бетінде жүреді.
Өндірісте гетерогенді катализ мысалы, ретінде күкірт қышқылын контакт әдісімен алуды, SO
 ні SO
ні SO
 ке айналдыру үшін қолданылатын Pt катализаторын аммиакты H
ке айналдыру үшін қолданылатын Pt катализаторын аммиакты H
 пен N
пен N
 ден синтездеу (катализатор жұмсақ Fe+Al
ден синтездеу (катализатор жұмсақ Fe+Al
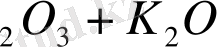
 ) т. б. реакцияларды алуға болады.
) т. б. реакцияларды алуға болады.
Гетерогенді катализ көптеген органикалық заттарды алу үшін қолданылады . Мысалы, мұндай өнімдерін (бензин, солярка, керосин т. б заттар) каталитикалық крекинг әдісімен алады . H
 мен CO
мен CO
 синтезі арқылы метил спирті алады . Оны тотықтырғанда, формальдену түзіледі, соңғы зат пластмассаларды дайындауда бастапқы зат ретінде саналады .
синтезі арқылы метил спирті алады . Оны тотықтырғанда, формальдену түзіледі, соңғы зат пластмассаларды дайындауда бастапқы зат ретінде саналады .
Химия және фармация өндірістерінде қолданылатын катализаторлар периодтық жүйедегі көптеген элементтерден, металдардан және тұздарынан, сульфидтерінен, оксидтерден тұрады .
Гетерогенді катализдің жүруі әрекеттесуші зат молекулаларының катализатор бетімен әсерлесуіне, яғни адсобцияға байланысты. Катализатордың әсері оның беттік ауданы артқан сайын өседі, ол үшін катализаторды өте майда бөлшектер түрінде қолданылады . Бірақ ұнтақ катализатор газ ағынымен тез ұшып кетеді, ал оның үлкен массасы газ ағынына кедергі келтіреді . Сондықтан катализаторды майда күйінде инертті төсеуіштер тасымалдағыш заттар (силикагель, алюмогель, тұздар т. б) бетіне себеді немесе катализаторға таблетка, шар тәріздесі не цилиндрлі пішін беріп, нығыздайды . Гетерогенді катализаторларда сутек пен азоттан алынатын аммиак сияқты маңызды заттарды синтездеу күйіндегі экзотермиялық реакцияларды қолданған ыңғайлы . Мұндай реакциялардың активтендіру энергиясы жоғары, өнім шығымы тиімді емес, Ле-Шателье ережесіне сәйкес жоғары температурада тепе теңдік бастапқы ығысады . Ал катализаторды қолдану жылу бөлінетін реакцияларды тепе теңдікке төменірек температураларда тез жетуге мүмкіндік береді .
Катализ үдерісі мына сатылардан тұрады :
- Бастапқы заттардың катализатор бетінде адсорбциялануы:
A+B+Kт
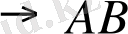 Kт
Kт
Бұл үдеріс әдетте активтелген және экзотермиялық.
- Адсорбцияланған күйдің активті жағдайға ауысуы:
ABKт
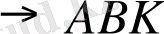 т
т

Бұл үдеріске гетерогенді каталиттік реакцияның шынайы активтендіру энергиясы деп аталатын белгілі бір энергия қажет .
- Адсорбцияланған күйде соңғы өнімдері түзу реакциясы :
АВКт
 өнімдерКт
өнімдерКт
- Адсорбцияланған өнімдердің десорбцияланып, катализатордың қайта қалпына келуі:
өнімдерКт
 өнімдер+Кт
өнімдер+Кт
Демек, гетерогенді катализде де катализатордың жылдамдату әсері гомогенді катализдегәдей, аралық қосылыстардың түзәләп, активтендіру энергиясының төмендеуіне байланысты .
Ферментті гомогенді катализ .
Ферменттер деп тірі ағзада өтетін химиялық реакцияларды жеделдететін, жасушалар мен ұлпалар құрамындағы ақсылдық заттарды айтады .
Қазіргі кезде 1 жуық биохимиялық реакция белгілі, олардың әрқайсысы ферменттердің қатысуына жүзеге асырылады (2 мыңдай ферменттер белгілі) .
Ферменттердің ерекше қасиеті - жоғары тиімділігінде . Мысалы, сутектің асқын тотығуының ыдырауы катализаторсыз активтендіру энергиясы 75 кДж/молге дейін төмендейді, ал фермент каталазаның қатысуына активтендіру энергиясының шамалы небәрі 23 кДж/молге ие болады . Мұндай активтендіру энергиясының өзгерісі реакция жылдамдығын 2 және және 3*10
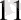 есе арттыруға әкеліп соқтырады .
есе арттыруға әкеліп соқтырады .
Ақсыл заттардың HCl әсерінен гидролизге ұшырауы үшін активтендіру энергиясы 80 кДж/моль болу қажет, ал асқазан сөлінде кездесетін фермент - трипсиннің қатысуында оның шамасы 50 кДж/ моль болады, сөйтіп асқазанның ақсыл затты тамақты сіңіруі іске асырылады .
Бір моль фермент 1000-1 моль затты бір секунд ішінде тасымалдап ферментті жоқ реакцияның жылдамдығын 10
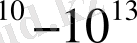 есе арттырады . Ферменттің мұндай әсер көрсетуі, біріншіден, ферменттің концентрациясына тәуелді, яғни ферменттің концентрациясы артқан сайын оның субстратты өзіне сорбциясы өсіп реакция жылдамдығын мың есе арттырады.
есе арттырады . Ферменттің мұндай әсер көрсетуі, біріншіден, ферменттің концентрациясына тәуелді, яғни ферменттің концентрациясы артқан сайын оның субстратты өзіне сорбциясы өсіп реакция жылдамдығын мың есе арттырады.
Екіншіден, ферменттер кеңістіктік бағдарлану құбылысын танытады, ол реакция жылдамдығын шамамен мың есе арттырады . Осы құбылыс негізінде фермент пен субстрат кеңістікте оңтайлы түйіседі.
Үшіншіден, ферменттер полифункциялық эффектке ие, ол олардың шешімі маңызын көрсетеді . Бұл эффектің негізінде субстраттың молекуласына бір уақытта бірнеше шабуылдайтын ферменттер тобының әсерінде жатыр .
Ферменттер бұл ақсыл заттар және олардың туындылары, өздерінің үшіншілік құрылымына орай жоғары ерекшелікті биохимиялық катализаторлар қызметін атқарады . Жалпы жасуша әртүрлі ферменттерді қажет етеді, ал әрбір фермент тек өзіне тиісті реакцияны катализдейді. Мысалы, эстераза ферменті күрделі эфир гидролизінің катализаторы болып табылады . Ферменттердің активаторлары ретінде металл иондары немесе органикалық молекулалар болып табылады, оларға нуклеотидтер немесе витаминдер жатады . Оларды коферменттер деп атайды .
Ферментті катализдің негізгі сипаты, фермент қатысуында жүретін реакция жылдамдығының белгілі шамаға жетіп тұрақты болып қалуында . 1913 жылы Михаэлис пен Ментен ферментті жылдамдығының субстрат концентрациясына тәуелділіктің теориясын ұсынды . Ферментті үдерістің схемасын былай ұсынуға болады :
E+S
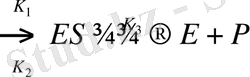
Ондағы Е және S фермент және субстрат, ES- аралық фермент-субстратты комплекс, P- реакция өнімі, ал К
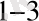 реакцияларға сәйкес жылдамдық тұрақтылары .
реакцияларға сәйкес жылдамдық тұрақтылары .
Ферменттер адам өмірінде ерте кезден қолданылады . Ашыту, қышқылдау құбылыстары, жеміс жидектерді өңдеу үдерістерінің негізінде ферменттік катализ үдерістері жатыр .
Кейінгі кездері медициналық энзимология қарқынды түрде дамып келе жатыр, ол ферментті дәрілік заттар ретінде пайдаланумен шұғылданады, сонымен қатар ферменттер көмегімен диагностика әдісін ойлап табуда кең көлемді жұмыстар жүргізіліп жатыр .
Химиялық кинетика заңдылықтарының медицина ғылымында қолдау табуы фармококинетика және токсикинетика, оның мақсаты дәрілік заттардың және улы заттардың әсер ету жылдамдығы мен ағзадан шығарумен шұғылдану болып табылады.
Ферменттер.
Тірі клеткаларда зат алмасу процесі үздіксіз жүріп жатады. Зат алмасу процесі дегеніміз белгілі бір тәртіппен кезектесіп келіп отыратын әр түрлі химиялық реакциялардың жиынтығы. Дәл осы реакциялар клеткадан тыс жерде (іп vіtrо) өте қиындықпен және өте баяу жүреді. Тірі клеткада бұл реакциялардың жүрісін ферменттер тездетеді.
Ферменттер дегеніміз жануарлардың, өсімдіктер мен микроор-ғанизмдердің клеткалары жасап шығаратын биологиялық катализаторлар.
Ферменттік әсер ету механизмі . Химиялық реакциялар-дың жылдамдығы реакцияға түсетін молекулалардың соқтығысу жиілігіне байланысты. Ал соқтығысу жиілігі молекулалардың концентрациясы мен ортаның температурасына байланысты.
Температураның артуына қарай молекулалар қозғалысының кинетикалық энергиясы да артады, бұл молекулалар соқтығысуы-ның жиілігіне әсер етеді. Сонымен қатар реакдияның өтуі үшін молекулалардың соқтығысуы жеткіліксіз. Бұл кезде олар активті күйде болуы қажет, басқаша айтқанда, оларда реакция үшін қажетті энергияның біршама артық қоры болуы тиіс. Мұндай энергияны активация энергиясы деп атайды. Фермент осы реакцияға қажет активация энергиясын кемітеді. Ол үшін фермент реакцияға ұшырайтын заттың молекуласымен (оны субстрат деп атайды) бірігіп комплекс түзеді. Комплексті қысқаша Ф + С (фермент+ + субстрат) деп белгілейді. Бұл комплекстің түзілуіне әлдеқайда аз мөлшердегі энергия қажет.
Фермент + субстрат аралық комплексін түзу кезінде субстрат молекулалары біраз деформацияға ұшырайды, сондықтан реакция-ның активация энергиясы кемиді. Бұл деформация субстраттың молекула ішілік байланыстарын әлсіретеді және молекуланы белгі-лі бір реакцияға неғұрлым қабілетті етіп шығарады. Комплекстің түзілуі спектрлік методтардың жәрдемімен дәлелденген.
Ф + С аралық комплексін түзуде субстрат ферменттің бүкіл мо-лекуласымен емес, оныд активтік орталықтар деп аталатын жеке-легең учаскелерімен қосылады. Ферменттің әрбір молекуласында 1-2 активтік орталық бар екендігі анықталып отыр.
Активтік орталықтық кеңістіктік құрылысы мен химиялық та-биғаты белгілі бір субстратқа ғана сай келетіндей болып қалып-тасқан. Бұл фермент басқа субстратқа катализатор бола алмайды. Осы ерекшелік ферменттердің талдаушылық қасиетін белгілейді.
Органикалық заттар мен ферменттердің структурасын зерттей келе, Э. . Фишер фермент пен субстраттың кедістіктік сәйкестігінің жақындығы женінде қорытынды шығарып, фермент субстратқа құлпының кілтіндей сәйкес келеді деп сипаттады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz