Сілтілі ортада айнымалы токпен поляризацияланған жез электродының еру кинетикасын зерттеу


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
Қ. А. ЯСАУИ АТЫНДАҒЫ ХАЛЫҚАРАЛЫҚ ҚАЗАҚ-ТҮРІК УНИВЕРСИТЕТІ
ЖАРАТЫЛЫСТАНУ ЖӘНЕ МЕДИЦИНА ИНСТИТУТЫ
ЖАРАТЫЛЫСТАНУ ФАКУЛЬТЕТІ
ЭКОЛОГИЯ ЖӘНЕ ХИМИЯ КАФЕДРАСЫ
АЙНЫМАЛЫ ТОКПЕН ПОЛЯРИЗАЦИЯЛАНҒАН ЖЕЗДІҢ ЕРУ КИНЕТИКАСЫН ЗЕРТТЕУ
ДИПЛОМДЫҚ ЖҰМЫС
МАЗМҰНЫ
КІРІСПЕ . . .
1 МЫС ЖӘНЕ ОНЫҢ ҚҰЙМАЛАРЫНЫҢ ФИЗИКА - ХИМИЯЛЫҚ ЖӘНЕ ЭЛЕКТРОХИМИЯЛЫҚ ҚАСИЕТІ . . .
1. 1 Мыс негізіндегі құймалардың физика-химиялық қасиеттері . . .
1. 2 Жездің электрохимиялық қасиеті . . .
1. 3 Мыс пен мырыштың физика - химиялық қасиеттері . . .
1. 4 Мыс пен мырыштың электрохимиялық қасиеттері . . .
1. 5 Электрохимиялық кинетика жөнінде түсінік . . .
2 СТАЦИОНАРЛЫ ЕМЕС ЭЛЕКТРОХИМИЯЛЫҚ ҮРДІСТЕР . . .
2. 1 Стационарлы емес ток режиміндегі үрдістер . . .
2. 2 Стационарлы емес токпен поляризациялаған электродтардағы электрохимиялық реакциялар . . .
ЭКСПЕРИМЕНТТІК БӨЛІМ
3 ТӘЖІРИБЕ ӘДІСТЕМЕСІ ЖӘНЕ ОРЫНДАЛУ ТЕХНИКАСЫ . . .
3. 1 Айнымалы ток режимінде электролиз жүргізу әдістемесі . . .
3. 2 Пайдаланылған реактивтер, препараттар және алынған өнімдер
анализі . . .
4 СІЛТІЛІ ОРТАДА (КОН) АЙНЫМАЛЫ ТОКПЕН ПОЛЯРИЗАЦИЯЛАНҒАН ЖЕЗ ЭЛЕКТРОДЫНЫҢ ЭЛЕКТРОХИМИЯЛЫҚ ҚАСИЕТІ . . .
4. 1 Жез электродының еруінің ток бойынша шығымына титан электродындағы ток тығыздығының әсері . . .
4. 2 Жез электродының еруінің ток бойынша шығымына осы электродтағы ток тығыздығының әсері . . .
4. 3 Жез электродының еруінің ток бойынша шығымына электролит концентрациясының әсері . . .
4. 4 Жез электродының еруінің ток бойынша шығымына электролиз ұзақтығының әсері . . .
4. 5 Жез электродының еруінің ток бойынша шығымына ерітінді температурасының әсері . . .
4. 6 Жез электродының еруінің ток бойынша шығымына айнымалы ток жиілігінің әсері . . .
ҚОРЫТЫНДЫ . . .
ҚОЛДАНЫЛҒАН ӘДЕБИЕТТЕР . . .
КІРІСПЕ
Қазіргі уақытта жез қалдықтарын өңдеу, оларды екіншілік шикізат ретінде пайдалану, олардан бағалы компоненттерді бөліп алудың экологиялық тиімді әдістерін жасау мәселелері өте өзекті. Өндірістік қалдықтардың басқа түрлеріне қарағанда мыс негізіндегі құйма қалдықтары қымбат шикізат болып табылады, себебі оларда пайдалы компоненттердің үлкен қоры жинақталған [1] .
Олар өздерінің механикалық қасиетері жағынан кейбір жоғары маркалы болаттан артық болып келеді. Осындай бағалы физика-химиялық қасиеттерінің арқасында, мыс негізіндегі құймалар өндіріс пен техниканың әртүрлі салаларында: химия өнеркәсібінде, электротехникада, машиналардың негізгі бөлшектерін, құрал-саймандарды және радиоаппаратураны жасауда және коррозиялық агрессивті орталарда кең қолданылады [2] .
Көп қолданылып жүрген мыс құймаларының ішінен жез бен қоланы атап өтуге болады. Мыстың мырышпен және басқа металдармен құймалары, коррозиядан арнайы қорғауды қажет етпейтін, беріктігі мыстан артық конструкциялық материалдар болып келеді. Мыстың мырышпен құймасы жез деп аталады да, құрамы бойынша қызыл жез (құрамында 20%-тез аз мырыш болады және ауыр), сары жез (20-50% мырыш болады), ақ жез (50-80% мырыш болады, жеңіл) және арнайы жез (мыс және мырыштың басқа қорғасын, никель, марганец, темір, қалайы және алюминий болады) деп бөлінеді. Мыстың қалайымен құймасы қола деп аталып, құрамына қарай- қалайылы, алюминийлі, фосфорлы және арнайы қола болып бөлінеді: соңғыларының құрамында мыс және қалайыдан басқа алюминий, қорғасын, никель, марганец, темір, кремний, берилий және т. б болады [3] .
Қазіргі ғылыми зерттеулерде әртүрлі формадағы айнымалы токты пайдалану электрохимиялық технологиялардың өндірістерінде көп көңіл бөлінеді. Электрохимиялық жүйелерде айнымалы токты қолдану ерітіндідегі әртүрлі электрохимиялық реакциялардың кеңінен жүруіне, электрод-электролит фазаралық шекарасында және жүйедегі электрохимиялық реакциялардың механизмін терең зерттеуге, сонымен қатар, тиімді технологияны ұсынуға мүмкіндік береді.
Мыс негізіндегі құймалардың қолданылуының артуымен, олардың қалдық ретінде қоршаған ортаға түсуі де арта түсуде. Металл құймалары қалдықтарының көптеген мөлшері, әсіресе тұрмыстық қалдықтар қоршаған ортаны ластай отырып, түзілген жерлерінде таралады.
Металдарды қатты құйма қалдықтарынан қорыту - қоршаған ортаға жүктемені төмендететіндіктен, оларды өндірудің маңызды көзі болып табылады. Осыған байланысты, мыс және мырыш негізіндегі қатты құйма қалдықтарын өңдеудің әртүрлі әдістері ұсынылған [4] .
Әдетте, мыс және мырыш негізіндегі құйма қалдықтары мен сынықтары құйма жасау үшін шихталық материалдар ретінде немесе қара мыс өндіру үшін қолдыналады. Қара мыс өндірудегі кең тараған технологиялық цикл келесі операциялардан тұрады: шахталақ пеште балқыту, конвертерлерде үру, шағылдырғыш пеште отты рафинирлеу және еритін анодтармен электролиздеу арқылы соңғы рафинирлеу. Электролиттік рафинирлеуден өткен қара мыстың сапасы мен қасиеттері, мыс рудаларынан өңдеп алынған катодтық мыстан кем түспейді.
Жоғарыда аталған мыс және мырыш негізіндегі қатты құйма қалдықтарын заласыздандырудың белгілі әдістері көп сатылы және реагентер шығыны, арнаулы қондырғылар мен жоғары температуралы режимді қажет етеді. Осы технологиялық проблемаларды шешуде, қатты қалдықтарды өндеуде электрохимиялық тәсілдерді қолдану, перспективті сала деп есептеледі. Өндірістік қатты құйма қалдықтарын заласыздандыруда қолданылатын реагенттердің көпшілігі қоршаған орта үшін зиянды болып табылады. Сондықтан, қатты қалдықтарды өңдеуге химиялық әдістер тиімсіз болып табылады. Ал, химиялық ток көздері қоршаған ортаны ластамайтын және экономикалық тиімді энергия көздері болып табылады. Электрохимиялық әдісті қолдану - қатты құйма қалдықтарының әркелкі түрлерін өңдеуге және технологиялық схеманың жеңілдеуіне мүмкіндік береді.
Қазіргі кезде, қатты құйма қалдықтарын стацонарлы емес режимдегі ток түрлерін қолдану арқылы өңдеу, үлкен қызығушылық тудырып отыр. Бұл тәсілді қолдану - таза металдар немесе олардың қосылыстарын алуға, процестің реагентсіз болуы, қалдықсыз технологиялық процестер құруға мүмкіндік тудырады [5] .
Жұмыстың мақсаты - айнымалы токпен поляризациялау кезіндегі жез электродының сілтілі ортадағы электрохимиялық еру ерекшелігін зерттеу.
Жұмыстың мақсатына сәйкес келесі міндеттерді шешу көзделінді:
- Жез электродының еруіне титан және жез электродтарындағы ток тығыздықтарының әсерлерін зерттеу.
- Жез электродының еруіне электролит концентрациясының әсерін зерттеу.
- Жез электродының еруіне электролиз ұзақтығының әсерін зерттеу.
- Жез электродының еруіне ерітінді температурасының әсерін зерттеу.
- Жез электродының еруіне айнымалы ток жиілігінің әсерін зерттеу.
Зерттеу жұмыстары Қ. А. Ясауи атындағы Халықаралық қазақ-түрік университеті Жаратылыстану және медицина институтының экология және химия кафедрасының ғылыми зерттеу лабораториясында жүргізілді. Ұсынылған тақырып үшін, зерттеуді жүргізу кезінде методикалық әдістерді игеруде және олардың нәтижелерін талқылауда көрсетілген бағалы көмектері үшін дипломдық жетекшім х. ғ. к., доцент м. а. Р. Н. Нұрділлаеваға үлкен алғысымды білдіремін.
1 МЫС ЖӘНЕ ОНЫҢ ҚҰЙМАЛАРЫНЫҢ ФИЗИКА - ХИМИЯЛЫҚ ЖӘНЕ ЭЛЕКТРОХИМИЯЛЫҚ ҚАСИЕТТЕРІ
1. 1 Мыс негізіндегі құймалардың физика-химиялық қасиеттері
Негізгі легирлеуші (қоспасы) элементі мырыш болып табылатын мыстың екі немесе көп компонентті құймасы жез деп аталады. Cu-Zn жүйесінде алты қатты ерітінділер түзіледі: α, β, γ, δ, ε, η.
α-мырыштың мыстағы қатты ерітіндісі. Мырыштың мыста еруі бөлме температурасында 39%-ке тең, 453 0 С дейін іс жүзінде өзгермейді, ал 905 0 С- та 32%-ке кемиді. CuZn қосылысы негізіндегі β-қатты ерітіндісі келесі электрондық түріндегі (үлгідегі-тип) байланыста болады:
электрондар саны 3
( қатынас ) = = ──
атомдар саны 2
Оның қарапайым кубтік көлемді центрленген торы бар. Атомдардың ретті орналасуы тек 453-470 0 С-тан төмен температураларда сақталады. Одан жоғары температураларда мыс және мырыш атомдары көлемді центрленген торда статистикалық түрде орналасады. Атомдары ретпен орналасқан β-қатты ерітіндісі β ’ деп белгіленеді. δ-қатты ерітіндісі негізіндегі химиялық байланыс табиғаты анықталмаған. Бөлме температурасында іс жүзінде қолданылып жүрген жездер α-кристалдарынан немесе α- және β-кристалдарының қоспасынан тұрады.
Мырыш құйманың беріктігін және пластикалығын арттырады. Құрамында 30% Zn бар құйма максимальды пластикалық қасиетке ие. Мырыш мөлшері 39%-ке жеткенде құйманың пластикалығы күрт төмендейді. β-жез максимальді беріктікке (σ В =42 кГ/мм 2 ), бірақ жез үшін салыстырмалы түрде төмен пластикалық қасиетке (δ=7%) ие. Сондықтан, атап өтілген кемшіліктерге (пластикалық қасиеттері төмен) байланысты, тек γ- және β+γ жездері ғана емес, сонымен қатар β-жездері де іс жүзінде қолданылмайды. Кең қолданылатындары α- немесе α+β-құрылымды жездер.
Жез пластикалық деформациялық өңдеуге қолайлы, сондықтан жездерді жұқартып түрлі формаға келтіріп, түрлі жартылай фабрикаттар жасайды.
Жездердің механикалық беріктігі жоғары емес. α-жездерге келесі механикалық қасиеттер тән: σ В = 30 кГ/мм 2 , δ =40%, α+β-жездердің беріктігі жоғарырақ: σ В = 35 кГ/мм 2 , бірақ пластикалығы төменірек δ=40%.
1-кесте. Жай α-жездердің химиялық құрамы мен механикалық қасиеттері
Мыспен салыстырғанда жездердің беріктігі, қаттылығы, коррозияға төзімділігі жоғары және сұйықаққыштық қасиетке ие. Бірфазалы α-жездер салқын және ыстық деформацияны жақсы қабылдайды. Екіфазалы (α+β ’ ) -жездер ыстық пластикалық деформацияға (α+β) - немесе β-аумақтарындағы температуралық интервалдарда өңделеді, себебі бұл құймалардың салқын деформация температурасында пластикалық қасиеті төмен [6-7] .
Химиялық қасиеттері. Мыспен салыстырғанда жездердің беріктігі, қаттылығы, коррозияға төзімділігі жоғары. Сондықтан, жез сумен, тотықтырғыш емес қышқылдармен әрекеттеспейді. Қышқылдардың ішінен тек сұйытылған және концентрленген азот қышқылы жезге әсер етеді.
Құрамында 20%-тен жоғары мырыш бар деформацияланған жездер аммиак буы бар ылғалды ауада шытынауы байқалады.
Құймалардың химиялық бұзылу сипатына олардың кристалдық құрылымы үлкен әсер етеді. Жездің химиялық қасиетін коррозия теория тұрғысынан сипаттауға болады, ол мыс пен мырыштың стандартты потенциалдарына, легирлеуші элементтердің табиғатына және оттегінің әсеріне байланысты болып келеді.
Құрамында 29-30% мырыш бар жездің желіну процесі теңіз суының ұзақ әсерінен, құйманың барлық беттік ауданында емес және оның барлық көлемінде біркелкі жүрмейді. Агрессивті ортада құйма құрамындағы еруі таңдамалы түрде жүреді: ерітіндіге мыс өте қарқынды, ал мырыш баяу өтеді. Құрамында мырыштың мөлшері одан жоғары (>36%) мыс көп α-қатты ерітіндісі мен мырышы көп β-қатты ерітінділерінің қоспасынан тұратын екіфазалық құрылымды жездерде коррозиялық бұзылу басқаша жүреді. Мұнда да теңіз суының әсерінен жездің мырышсыздануы жүреді, бірақ ең алдымен β-фазасының кристалдарының бұзылуы басымырақ жүріп, сосын бұзылу α-кристалдарына да таралады [4] .
1. 2 Жездің электрохимиялық қасиеттері
Л-62 жездің коррозиялық және электрохимиялық қасиеті FeCl 3 , CuCl 2 концентрлі және олардың араласқан ерітінділерінде, сонымен қатар, құрамында хлоридтер бар органикалық ерітінділер мен олардың сумен араласқан ерітінділерінде әртүрлі физика-химиялық әдістер негізінде зерттелген. Сулы ерітінділердегі жездің еруі, металдық мыспен салыстырғанда аз еритіндігі және жездің еруі ерітіндідегі CuCl 2 концентрациясына және құймадағы мыс компонентінің электрохимиялық қасиетіне тәуелді екені анықталған. Су - органикалық ерітінді қоспасында жездің еруі катодтық сатымен шектеледі. Пассивтеуші қосылыстардың табиғаты анықталған: сулы нейтрал ерітінділер үшін - CuCl, CuOH және ZnO, ал органикалық сулы ерітінділер үшін - Cu (ОН) 2 және Zn (ОН) 2 [8] .
0, 1 М NaClO 4 ерітіндісінде рН=2, 0-9, 5 аралығында Cu-Zn-құймаларының анодтық қасиетіне рН және құймадағы мырыш мөлшерінің әсерлері зерттелген. Жездің электрохимиялық сипаттамасы гальваностатикалық негізінде және катодты және анодты поляризациялық қисықтар түсіру арқылы зерттелген. Ортаның рН мәнінің өзгерісін ескере отырып, жездің анодтық еруінің механизмі ұсынылған.
Жездің анодтық еру кинетикасы құймадағы мыстың еруімен анықталады, ал рН мәні 2, 0-3, 8 кезінде бұл процесті NaClO 4 ерітіндісіндегі мыстың еру схемасымен сипаттауға болады:
Cu + H 2 O = (CuOH) адс + H + + e - (1)
(CuOH) адс → CuOH + + e - (2)
CuOH + + H + = Cu 2+ + H 2 O (3)
(CuOH) адс + ClO 4 - = (CuOHClO 4 ) адс + e - (4)
(CuOHClO 4 ) адс + H + → Cu 2+ + H 2 O + ClO 4 - (5)
мұнда, (1) және (4) сатыларын сәйкес ионизация тармақтары шектейді және олар қатар жүреді. рН 3, 8-9, 5 аумағында жездің еру жылдамдығының төмендеуі Cu 2 O беттік оксидтің түзілуімен байланысты. Анодтық поляризация кезінде, Cu 2 O металдық мыстағы секілді ери алады, сондықтан жездің еруі келесі схема бойынша жүреді:
Cu + H 2 O = (CuOH) адс + H + + e - (6)
Cu(CuOH) адс → (Cu 2 O) адс + H + + e - (7)
(Cu 2 O) адс = Cu(CuO) адс (8)
(Cu 2 O) адс + H 2 O + ClO 4 - = (CuOHClO 4 ) адс + OH - (9)
(CuOHClO 4 ) адс + H + → Cu 2+ + H 2 O + ClO 4 - (10)
мұнда, жылдамдықты анықтайтын (6) және (8) сатылары да паралель болып табылады.
Z Zn коэффициенті ортаның рН мәніне және жездегі мырыш мөлшеріне тәуелді. Cu-Zn-құймаларының беттік қабатынан мырыштың таңдамалы еруі τ<0, 6 с-та өтіп, мырыш атомдарының қатты фазалық диффузиясымен шектелетінін анықтаған. ξ коэффициентінің мәні 1-ге жуық болуы таңдамалы ерудің бастапқы сатыларында фазалық айналымдардың жоқ екенін көрсетеді. Құймада мырыштың мөлшерінің артуымен жездің анодтық еруі жоғарылайды. Cu-Zn-құймаларының анодтық еруінің кинетикалық заңдылықтары, оның еру сипаттамасы мыстың еруімен анықталады, ал жездің перхлоратты ерітінділердегі анодтық қасиетін сипаттау үшін мыстың анодтық еру механизмінің схемасын қолдануға болады [9] .
Құймалардың анодтық еруінің механизмдері көрсетілген. Біртекті қатты ерітінді болып табылатын құймалардың металдық жүйелерінің коррозиялық тұрақтылық шекарасы секірісінің пайда болуына кинетикалық түсіндірме берілген. Мыстың тотығу өнімдерінің тотықсыздануымен байланысты жездің мырышсыздануы мыс пен мырыштың ионизациясының парциалды реакцияларының химиялық ілесуімен (жүруімен) түсіндірілген. Бірінші реакция бос энергияның бөлігін вакансия арқылы екіншісіне береді. Осының нәтижесінде мыстың ионизациялануы таза мыстың тепе-теңдік потенциалына қарағанда терісірек потенциалдарда мүмкін болады. Осы себептен, жезбен тотыққан мыстың құйма бетінде өз фазасында мысқа дейін қайтадан тотықсыздануына мүмкіндік туады.
Құймада белгілі бір потенциал ұстап тұрып, тек электрлігі теріс металды ерітуге болады, ал электрлігі оң металл термодинамикалық тұрақты болады. Мысалы, егер хлоридті ерітіндіде жезде Cu30Zn (30 ат. % Zn) электродты потенциал мәнін -0. 40 В ұстап тұрса, құймадан тек мырыш еритіндігі анықталған Құймалардың таңдамалы еруінің өзіне тән ерекшелігі оң компонентке бай, вакансиялардың жоғары концентрациясына ие беттік қабаттың пайда болуы. Бұл қабат дефекттерге байланысты тұрақсыз болғанымен кристалдық құрылымы сақталады. Диффузиялық қабаттың қалыңдығы уақыт бойынша үздіксіз артады, сондықтан компоненттерінің диффузия жылдамдығы кемиді. Электрлігі теріс компоненттің тотығуымен байланысты анодты ток құйманың беттік қабатындағы осы компоненттің диффузиясымен анықталады [10] .
Мыс пен жездің анодтық қисықтарының иілімдeрі бірдей, бірақ бір-бірінен ығысқан. Бұл ығысу, жезде анодтық ток мыстың да, мырыштың да ионизациялануына жұмсалуымен байланысты. Мыстың парциалды қисығы да теріс аумаққа ығысқан, ал ол керісінше болу керек. Мұны былай түсіндіруге болады, жездің таңдамалы еруі барысында мырыштың ионизациясы беттік қабаттың құрылымының дефектісіне алып келіп, ал бұл оның бос энергиясын жоғарылатады. Беттік аумақта мыс атомдарының активтілігі артады да, нәтижесінде мыстың квазитепе-теңдік потенциалы төмендейді. Осы себептен, коррозия потенциалында немесе жездің анодтық еруі кезінде мыстың тотығу өнімдерінің өз фазасында мысқа дейін тотықсыздануы жүреді. Жездің мұндай еруінің соңғы нәтижесі мырыштың еруі мен мыстың құйма бетінде жиналуы болып табылады [11] .
1. 3 Мыс пен мырыштың физика-химиялық қасиеттері
Мыс-металдық жылтыры бар қызғылт металл, мыстың жұқа беткі қабаты жарқырап көгілдір-жасыл түске ие болады. Балқу температурасы 1083, 4°С, қайнау температурасы 2567°С, тығыздығы 8, 92г/ см 3 [13] . Мыс ток өткізу және жылу өткізу жағынан күмістен кейінгі екінші орында. Құрғақ ауада өзгеріске ұшырамайды, себебі мыстың бетін қаптаған қара түсті үлдір (пленка) оны әрі қарай тотығудан қорғайды. Бірақ. ылғал және көміртек диоксиді қатысында мыстың беті жасыл түсті мыстың негіздік корбанатымен Сu(OH) 2 CO 3 қапталады. Мысты ауада қыздырғанда қара түсті мыстың оксидіне айналады, одан да жоғары температурада оттегісін жоғалтып мыс тотығына Cu 2 O айналады.
Жоғары жылу- және электр өткізгіштігіне, коррозияға төзімдігіне байланысты мыс өндірісте кеңінен қолданылады.
Таза электролиттік мыстың көп бөлігі (барлық мыстың 40%-і) электрөткізгіштер мен кабельдер жасауда қолданылады. Машина жасау өндірісі мен электротехникада және т. б өндірісте мыстың басқа металдармен құймасы кеңінен қолданылады. Олардың маңыздылары: жез (мыстың мырышпен құймасы), қола (мыстың қалайымен құймасы), нейзильбер (65% мыс, 20% мырыш және 40% никель) және мельхиор (80% мыс және 20% никель) бұның сыртқы көрінісі күміске ұқсас келеді және константин (60% мыс және 40% никель) [12] .
Мырыш - көгілдір-ақ металл. Балқу температурасы 419, 58°С; қайнау температурасы 906, 2°С; тығыздығы 7, 133 г/см 3 .
Мырыш бөлме температурасында морт сынғыш, ал 100-150°С та иілгіш, созылғыш болып келіп жұқа қабаттарға бөлінеді. Ауамен байланыстағы мырыш оксидтік жұқа қабатпен қапталып қараяды. Ылғалды ауа әсіресе көміртегі диоксидімен бірге бөлме температурасында мырышты біртіндеп бұзады. Мырышты ауада қыздырғанда жанып, мырыш оксидін түзеді [13] .
Мыс және мырыштың кейбір физикалық қасиеттері 5-кестеде келтірілген.
5-кесте. Мыс және мырыштың кейбір физикалық қасиеттері[14] .
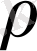 , г/см
3
, г/см
3
T балқу ,
°С
Т қайнау ,
°С
Ион радиусы,
нм
Мыс оттегімен, күкіртпен, галогендермен және басқа да элементтермен өздігімен әрекеттескенімен химиялық жағынан мысты азактивті металдар қатарына жатқызады. Кернеу қатарында суктектен кейін орналасқандықтан мыс қышқылдан оның құрамындағы сутегісін ығыстырып шығара алмайды. Сондықтан, тұз және сұйытылған күкірт қышқылдары мыспен өздігімен әрекеттесе алмайды. Алайда ауадағы оттегі қатысында мыс аталған қышқылдармен әрекеттесіп сәйкес тұздарын түзеді.
2Cu + 4HCl + O 2 = CuCl 2 + 2H 2 O (11)
Бұл реакцияны екі сатыда жүреді деп жорамалдауға болады: алдымен оттегі мысты мысоксидіне тотықтырып сосын мыс тотығы барлық тотықтар сияқты тұз қышқылымен әрекеттесіп тұз және су түзеді. Мұндай жағдайларда тіпті ең әлсіз қышқылдың өзі мысты біртіндеп ерітуі мүмкін, мыс азот қышқылында және концентрленген күкірт қышқылында қыздырғанда өте оңай ериді.
3 Cu +8HNO 3 = 3Cu(NO 3 ) 2 + 2NO↑ + 4H 2 O (12)
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 ↑ + 2H 2 O (13)
Мыс оттегімен екі оксид түзеді: мыс (II) оксиді CuO және мыс (I) оксиді Cu 2 O.
4Cu + O 2 →2Cu 2 O ∆H = -39, 8 ккал · моль -1 (14)
2Cu + O 2 →2CuO ∆H = -37, 1 ккал · моль -1 (15)
Мыс калий цианидінің KCN сулы ерітіндісімен әрекеттесіп H 2 және [Cu(CN) 4 ] 3- ионын түзеді.
Мыстың барлық қосылыстары түссіз жалынды көк немесе жасыл түске бояйды.
Мыс бірвалентті және еківалентті қосылыстар түзеді. Бірвалентті мыстың қосылыстары еківаленнтті қосылыстарына қарағанда тұрақсыздау және үлкен практикалық маңызға ие емес.
Мырыш кернеу қатарында сутегінің сол жағында орналасқанымен де оған су әсер етпейді, себебі: мырыштың беткі қабатында сумен әрекеттесу нәтижесінде түзілген гидроксид аз еритін зат, сондықтан, ол реакцияның әрі қарай жүруіне кедергі келтіреді. Сұйытылған қышқылдарда мырыш оңай еріп, сәйкес тұздарын түзеді. Сондай-ақ, мырыш берилийге және басқа металдарға тән амфотерлік гидроксид түзіп, сілтіде ериді. Егер мырышты қайнау температурасына дейін ауада қыздырса оның буы жалындап мырыштың оксидін түзе ақшыл- жасыл жалынмен жанады.
Мырыштың қолданыс аясы әртүрлі. Барлық мырыштың белгілі бөлігі болатты оның тот басуынан қорғап қаптауына (мырышталған болат) жұмсалады. Мырыштың сондай-ақ көптеген мөлшері гальваникалақ элементтер дайындауға және маңызды құймалар (мысалы, жез) әзірлеуге жұмсалады [12] .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz