Бір және көп негізді карбон қышқылдары: құрылымы, физика-химиялық қасиеттері, алыну әдістері және туындылары


VII. БІР- ЖӘНЕ КӨП НЕГІЗДІ ҚАРБОН ҚЫШҚЫЛДАРЫ-МЕН ОЛАРДЫҢ ТУЫНДЫЛАРЫ
Органикалық карбон қышқылдарының отіатіамасы, олар-дың құрамында карбоксил тобы ~ с \ бөлады. Молекула-сындағы осы топтың санына қарай карбон қышқылдары бір-екі-үш - жалпы алғанда көп негізді болып келеді. Органикалык қышқылдар қаныққан - карбоксил байланысқан және карбок-силі шексіз радикалмен байланысқан - (қанықпаған бола алады) .
- Б«Р НЕПЗДІ ҚАНЫҚҚАН КАРБОН ҚЫШҚЫЛДАРЫ
Бір негізді қаныққан карбон қышқылдарыныңі; жалпы фор-муласы: С„Н а „0 2 яғни С„Н2п+іСООН. Щ §
Изомерия жэне номенклатура. Көміртек атомы төрттен кем қышқылдың изомерлері болмайды, көміртегінің төрт атомы бар қышқылдың екі изомері болады; жалпы формуласы С 5 Ню0 2 қышқылдардың төрттен изомерлері болады. Изомерлер саны-ның көміртек тізбегінің ұзаруына қарай өсе беретіндігі, әрине белгілі жағдай еді.
СгДен С5-дейінгі қышқылдардың формулалары және аттары (тривиальдық және систематикалық номенклатура) мынадай:

Систематикалық номенклатура бойынша қышқылдар шекті көмірсутектердің атымен аталады; ал мұндағы тізбектегі көмір-тектің атомдарының есебі карбоксиль тобынан басталады.
Кейбір басқа қышқылдардың тривиальдық аттары:
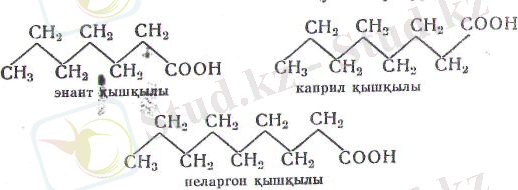
СНз-(СН 2 ) 4 -СООН капрон қышкылы
СНз-(СН 2 ) 5 -СООН энант кышқылы
СНз-(СН 2 ) ю-СООН лаурин қышкылы
СНз-(СН 2 ) н-СООН пальмитин қышқылы (31-сурет)
СНз-(СН 2 ) І6 -СООН стеарин қышқылы

31-сурет. Пальмитин қышқылы молекуласынын. моделі
Алу әдістері. Қышкылдарды алудың жалпы бірнеше әдістері бар, олардың біразы бұрын қарастырылған болатын:
1. Бірінші спирттерді тотықтыру (129 бет)
2. Альдегидтерді тотықтыру (170 бет)
3. Металлорганикалық қосылыстар аріқылы алу (238 бет) мысалы:
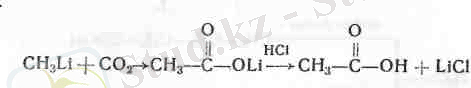
4. Галогеналкилдермен цианды калийдің әрекеттесуінен түзі-летін нитрилдердің (К-СЫ) гидролизі (сабындануы) :
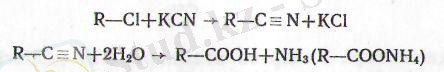
Нитрилдердің сабындалуы минералдық қышқылдардың не-месе сілтілердің судағы ерітінділерімен қыздыру арқылы жүр-гізіледі. Бұл процесте қышкылды ортада азот аммоний тұзы түрінде бөлінеді де, сілтілік ортада - аммоний гидрототығы түрінде түзіледі, ал қьгшқыл тұз түрінде пайда болады (232 бет)
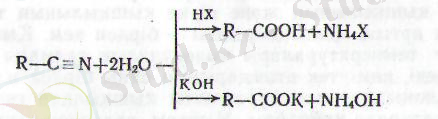
Өнеркәсіпте қышқылдарды төмендегі әдістермен алады:
1. Парафинді көмірсутектерін катализатор қолданып немесе қолданбай да жоғары температурада ауамен немесе техникалық оттекпен тотықтыру. Жеңіл көмірсутектер (көміртек атом саны 8-ге дейін) көбінесе күшті қысымда бу фазасында тотығады, ал ауыр көмірсутектер (парафиндер Сі 6 Н 3 4-С 3 оН 6 2), қышқылдар СюН 2 о0 2 -С20Н40О2 алу үшін көбінесе сұйық фазада тотықты-рылады. Тотығу процесі 500° С маңында, бір атмосфера қысым-да немесе 400° С, 130-200 атм қысымда жүргізіледі. Катализа-торлар ретінде металдар, олардың тұздары және тотықтары қолданылады. Катализатор қолданып жазық тізбекті майлы қышқылдарды алғанда тотығу температурасын 130-150°С-ге дейін төмендетеді. Көмірсутектер тотыққанда әдетте көміртек атомдарының саны әр қилы қышқылдардың қоспасы түзіледі (63 бет)
2. Оксосинтез екі вариантта қолданылады: а) оксосинтез арқылы альдегидтер алынады да (162 бет), оларды тиісті қыш-қылдарға тотықтырады: б) катализаторлардың (никельдің тет-ракарбонилі, Н 3 Р04 және б. ) қатысында, 300-400° С темпера-турада және 200-500 атм қысымда олефиндерді көміртектің тотығымен және судың буымен әрекеттестіріп нормаль және изоқүрылысты қышқылдар алынады, мысалы
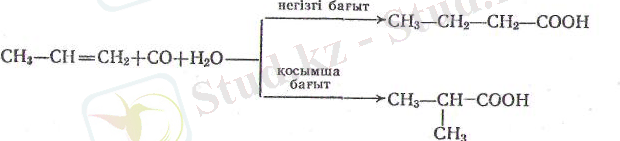
Физикалық қасиеттері. Көміртек атомдары 3-ке дейінгі же-ңіл қышқылдар-өзіндік өткір иісті түссіз сұйық заттар; олар сумен кез келген мөлшерде араласады. Көміртек атомдары 4-тен 9-ға дейінгі қышқылдардың көпшілігі жағымсыз иісті май тәріз-ді сұйық заттар. Молекулалық салмақтарының артуынан олар-дың судағы ерігіштігі күшті кеми береді. Он және оннан да артык көміртектің атомы бар қышқылдар - суда ерімейтін қатты зат-тар. Қүмырсқа қышқылының және сірке қышқылының тығыз-дықтары бірден артық, қалғандарынікі - бірден кем. Қышқыл-дардың қайнау температуралары молекулалық салмағы өскен сайын арта береді, кеміртек атомдарының саны бірдей жағдай-да нормаль, қышқылдар изо құрылысты қышқылдан гөрі жо-ғарырақ темиературада қайнайды. Мысалы, валериан қышқылы СН 3 -(СН 2 ) 3 -СООН 186°С-де қайнайды, ал триметилсірке қышқылының изомері (СН 3 ) 3 С-СООН 163, 7° С-де қайнайды
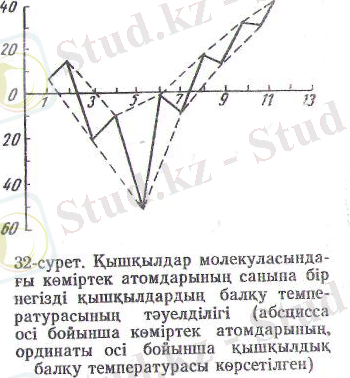
Нормаль құрылысты қышқылдарда тамаша заңдылық бай-қалады: кеміртек атомы бар жұп санды қышқылдардьщ балқу температурасы, кө^міртек атомы бар дақ санды көршілес қыш-қылдардыкінен жоғарьі бола-ды. Мысалы, каприл қышқылы СНз-(СН 2 ) 6 -СООН 16, 2°С балқиды, ал онымен көршілес қатар тұрған энант СН 3 - (СН 2 ) 5- СООН және пеларгон қышқылдарының әрқайсысына сай балқу температуралары 10, 5 және 12, 5°С (21-сурет) бо-лады. Олай болу себе, бі метил тобымен карбоксил ^обының кеңістікте өз ар& әр. түрде орналасуынан. Жұп қ«гардағы қышқылдарда ол топтар моле-кула осінің екі жағына, ал дақ қышқылдарда оның бір жағы-на орналасқан: оны қарасты-рылған мысалдар үшін схема түрінде былай көрсетуге бо-лады.
Көміртек атомдарының саны бірдей қышқылдармен спирт-тердің қайнау температураларын салыстыратын болсақ, спирт-терге қарағанда, қышқылдардың едәуір жоғары температурада қайнайтындығы байқалады. Мысалы, сірке қышқылыньщ қай-нау темп. 118, 5°С, ал этил спиртінікі 78, 3° С. Оны қышқыл моле-кулаларының көбірек* ассоцияланғандығымен түсіндіруге бола-ды. Қейбір қышлллдардың молекулалық салмақтары мен була-рының тығыздығі дәлел болады. Тәжірибемен анықталған осы көрсеткіштер екі есе көп болып шығады.

Химиялық қасиеттері. Карбон қышқылдарының қышқылдык қасиеттері айқын байқалады. Оны карбоксил тобындағы атом-дарының өз ара әсері деп тусіну керек; карбоксил тобындағы электрондық тығыздығы электрофильдігі (электроноакцептор-лығы - электрон қосып алғыштығы) күштірек атом - оттекке
Диссоциациялану дәрежесі, демек, қышқьілдарітың күші, кар-боксил тобына байланысты, радикалдың үлқен-кішілігіне, сипа-тына байланысты болады: қышқылдардың диссоциациялык константасы радикалдың үлкеюіне қарай аз да болса кемиді. Мы-салы, сірке қышқылының К=1, 76- 10 -5 , ал валериан қышқылы-нікі 1, 50- 10~~ 5 болады. Жазық тізбекті қышқылдардың арасын-дағы ең күштісі құмырсқа қышқылы (К=2, 14 • 10 -4 ) болады Жалпы алғанда органикалық қышқылдар әлсіз қышқылдар ретінде саналады.
Радикалдағы сутек атомдары, әсіресе карбоксил тобымен көрші көміртек атомдары электрофильдік (электрон акцеп-торлық - электрон тартқыш) атомдарменл немесе топтар-мен алмасса онда органикалық қышқылдардың іфші әседі.
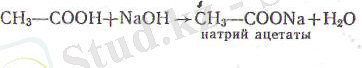
і. Органикалық қышқылдар металдармен, олардың оксид-тары (тотықтарымен) және гидроксидтеріме?! әрекеттесіп тұз тузуге қабілетті келеді.
Органикалық қышқылдар тұздарының қасиеттері бұрын қа-растырылған болатын; кальций тұздарын пирдлиздеп альдегид-тер және кетондар алынады (161 бет) ; қатты сілтілер қатысуында натрий тұздарын пиролиздеп кемір сутектері алынады (55 бет), тұздарды электролиздегенде көмірсутектер түзіледі (55 бет) .
2. Органикалық қышқылдарға фосфордың «алогендерімен эсер етсе қышқылдардың галоген а н г и, д р и д т е р і түзі-леді. Мұнда да, спирттердегі тәрізді, гидроксил галогенге алма-сады, мысалы
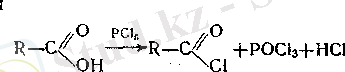
Сондай-ақ органикалық қышқылды хлорлы тионилмен әре-кеттестірсе қышқылдардың хлорангидридтерін алуға болады.
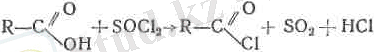
Қышқылдардың галогенангидридтерін қышқыл бойынша да, галоген бойынша да мысалы, сірке қышқылының хлорангидриді деп атауға болады. Дегенмен де көбінесе қышқыл радикалы


Ацил атының алдына галоген қойылады, Мысалы,
Жеңіл галогенангидридтері - терінің сілемейлі қабықшала-рын тітіркендіретін, өте өткір иісті сұйық зат.
галогеннің реакциялық қабілеті өте күшті. Құрамында метал атомы немесе сутектің актив-ті атомы бар қосылыстармен әрекеттескенде, оның орнын қыш-қыл қалдығы басады. Ондай реакцияларды ацилирлену деп атайды, анығырақ айтқанда (жаңа түзілген молекуланың құра-мында ацетил қосылған болса) ацетилдену делінеді. Хлорлы ацетилді мысалға алып, сондай реакциялардың бірнешеуін қа-растырайық.
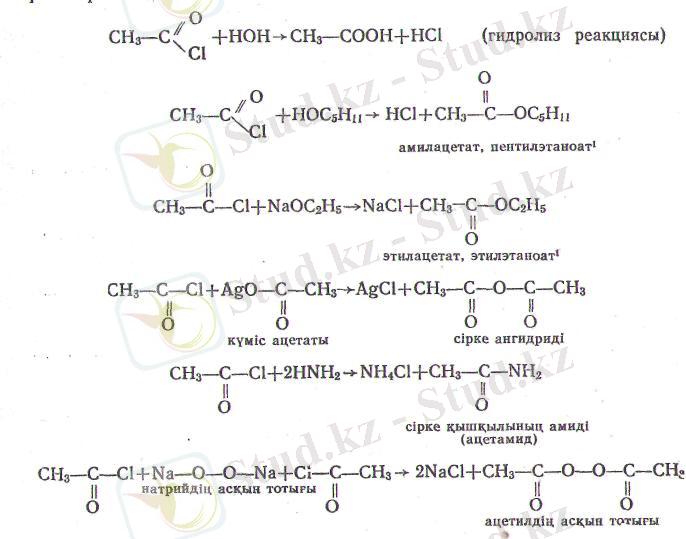
Сөйтіп, қышқылдардың галогенангидридтері арқылы қыш-қылдардың барлық туындыларын: тұздар, ангидридтер, галоген-аигидридтер, күрделі эфирлер, амидтер, асқын тотықтар, нит-рилдер және т. т. алуға болады.
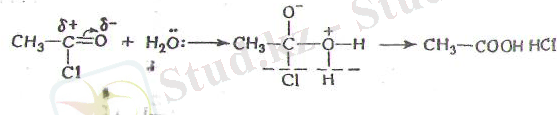
Механизмі жағынан осы реакциялардың барлығы да соңы-нан реакция нәтижесінде түзілген реакция комплексі ыдырап кететін нуклеофильдік қосылыс реакциялары болып табылады. Мысалы, хлорлы ацетилдің гидролизі мынадай схема бойынша жүреді.
Қышқылдардың ангидридтері қышқылдар-дың тұздарымен әрекеттесуі нәтижесін-де түзіледі:
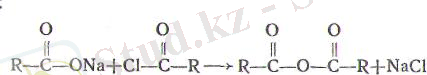
Аралас ангидрид алу үшін, әр түрлі қышқылдың керекті туындыларын алады. _ Мысалы, май қышқылының натрий тұзы хлорлы ацетилмен сірЖе-май ангидридін түзеді.
Қейбір қышіфэілдар суды күшті тартатын заттармен (Рг0 5 ) әрекеттесіп, жоғары температурада қатализатор қолданып жә-не реакция өнімдерін тез суытатын, ангидридтер түзеді
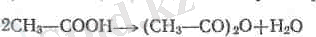
Жеңіл қышқылдардың ангидридтері - өткір иісті шайқал-малы сұйық заттар: суда нашар немесе тіпті ерімейді. Өздеріне сәйкес қышқылдарға қарағанда жоғарырақ температурада' қайнайды.
Қышқылдар ангидридтерінің химиялық активтігі күшті келе-ді және галогенангидридтер тәрізді бұлар да ацилдегіш заттар болып саналады:
а) сумен (жа$і) қайнатса бұлардың әрқайсысының өзіне сәй-кес келетін қышқылдйір түзіледі,
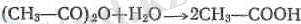
(^ ә^- спирттермен қышқылдың және күрделі эфирдің қоспасын түзеді:
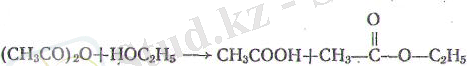
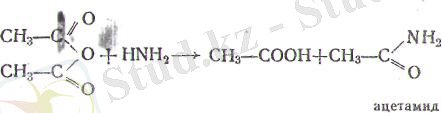
б) аммиакпен қышқылдың және оның амидінің қоспасын береді:
Осы реакциялардың барлығы, қышқыллардьщ хлорангид-ридтерінің реакциялары тәрізденіп, нуклрЬфйьдік қосылыс сатысы арқылы жүреді (194 бет) . *
Сірке ангидриді құрамында гидроксилі бар оргаңикалық қо-сылыстарды ацетилдеу үшін кеңінен қолданылады (мысалы, ацетат жібегін өндіргенде, (321 бет) .
4. Қышқылдардың амидтері галогенангидридтер, (194 бет) қышқылдардың ангидридтері (195 бет) арқылы неме-се қышқылдардың аммоний тұздарынан алынады:
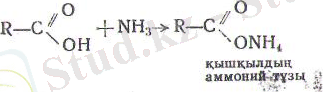
Осы тұздарды құрғақ айдағанда су бөлініп шілғып, қышқыл-дардый амидтері түзіледі:
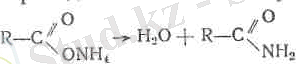
Қыінқылдардың амидтері - кристалды заттар (құмырсқа қышқнлынын сұйық амидінен - формамидтен басқасы) . Амид-тер хиииялық оцай өзгермелі келеді:
а) Рг0 5 -мен араластырып қыздырса су бөлініп шығады да
қышқылдардың нитрилдері түзіледі:
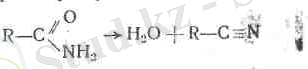
ә) амин тобының ЫН 2 сутегі металға г орнын едәуір оңай береді. Аіысалы, ацетамид сынап тотығымен әрекеттеседі.
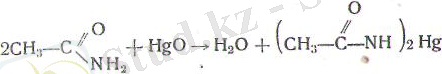
Й) амидтерді минералдық қышқылдардың немесе сілтілер-дің судағы ерітінділерімен араластырып қайнатса, гидролизде-неді де карбон қышқылы немесе оның тұзы түзіледі:
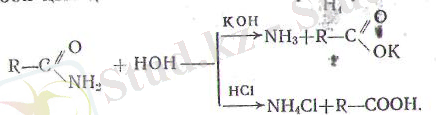
Қйшқылдардың амидтері нитрилдер сабынданғанда аралық өнімретінде де түзіледі (232 бет) .
5. Карбон қышқылдарының өздеріне тән өзгешеліктері де бар, мысалы, бұлар минерал қышқылдары болса спирттермен әрекеттесіп күрделі эфирлер түзгіш келеді (эфирлену, эфир түзілу реакциясы 1 . Бұл реакцияның қайтымды екені бұрын айтылған (127 бет. )
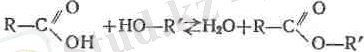
Бертлоның классикалық жұмыстары (1862 ж. ) бойынша тепе-теңдік, бастапқы алынған заттардың әрқайсысынан 2/3 мо-лі реакцияға түскенде орнайды (жай спирттер мен қышқылдар болса) . Н. А. және Б. Н. Меншуткиндердің зерттеулері бойынша эфир түзілу реакцияларының жылдамдығы спирттердің және қышқылдардың құрылыстарына байланысты болады (127 бет) . Құрылысы К-СН 2 -СООН қышқыл, К 2 СН-СООН және К 3 С- СООН қышқылдардан реакцияға тезірек қатысады.
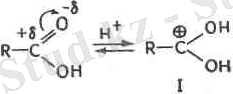
Эфирлену реакциясында катализаторлар міндетін сутектің иондары атқарады. Қышқылдың карбонил тобының оттегі про-тонды тартып алады да, онил қосылысын түзеді I:
1 Күрделі эфирлерге ат беру үшін әуелі спирттік радикал аталады да, онык аяғын оат деген жалғаумен бітіріп, . кышқылдьщ аты қосылады, мысалы
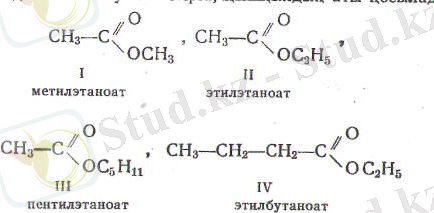
Оларды спирттік радикал және кышқыл бойынша да атайды, жалғыз-ақ онда олардыц атына «эфир» деген сез косылады: мысалы, I, II, III форму-лалармен керсетілген эфирлер жазылу ретіне сәйкес былай аталады: сірке қьшіқылынын. метил-этил-амил-(пеитил) эфирі, ал IV - эфир, май (яғни бу-тан) қышқылының этил эфирі делінеді. Бүлардың көпшілік қабылдаған мы-надай да аттары бар: алкилформиат, -ацетат, -пропионат, -бутират-, -валериат және баскалар; I, II, III эфирлер жазылу ретіне сәйкес метил, -этил, -амил (пентил) -ацетат делінеді, ал IV эфир - этилбутират болады.
Қосылыс I сиирттің молекуласын оггек фомының бөлінбей қосақталған злектрондары арқылы қосып алады, нәтижесінде аралық комплекс II түзіледі:
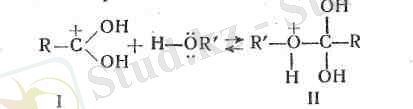
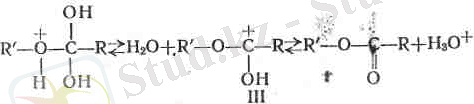
Комплекс II су бөліп шығарып күрделі эфирдің жаңа онилік катионын III түзіп қайтымды түрде ыдырауға қабілетті келеді:
Қосылыс III диссоциациялану нәтижесінде күрделі эфир түзіледі және катализатор - нротон босап шығады.
Квціл аударарлық бір жағдай: эфир түзілу реакцияларында гидроксилдердің қайсысының оттегі су түзетінін анықтау.
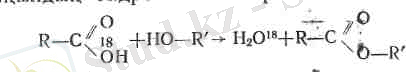
«Таңбаланған атомдар» (оттектің ауыр изотопымен О 18 ) жәрдемімен эфирлену реакциясында судың спирттің сутегінен және қышқылдың гидроксилінен түзілетіндігі дәлелденді
* . . .
Күрделі эфирлер галогенацил спирттерімен және алкоголят-тармен әрекеттескенде де (594 бет), органикалық қышқылдар-дың түздарын галогенді алкилдермен араластырып ептеп жы-лытқанда да, (194-бет) және қышқылдардың ангидридтеріне спирттермен әрекет жасағанда да түзіледі (195бет) .
Жеке өкілдері. ' Құмырсқа қышқылы НСООН - өт-кір иісті сұйық зат, қайнау температурасы 100, 8° С. Сумен азеотроп қоспа түзеді; қоспада 77, 5% қышқыл болады, 107° С-де қайнайды. Теріге тисе күйдіріп жібереді. Онымен демалса тыныс жолдарын тітіркендіреді. -Щ> ■*
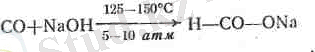
Техникада құмырсқа қышқылын аздап ьуіғалданған күйдір-гіш натр арқылы көміртектің тотығын жібергенде түзілетін өзі-нің натрий тұзынан алады:
Алынған тұзға күкірт қышқылымен әрекеттестіріп оны бос кү-йіндегі қышқылға айналдырады:
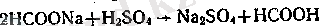
Құмырсқа қышқылында да әдеттегі қышқылдардың көптеген қасиеттері бар; ал олармен қоса оның өзіндік қасиеттері де бар:
- Оңай тотығады, сондықтан ол жақсы тотықсыздандырғыш:

Құмырсқа қышқылында тотықсыздандырғыш қасиеттердің болу себебі, ол әрі қышқыл, әрі оксиальдегид болады.
2. Концентрациялы Нг50 4 -мен қыздырса су және СО түзіп ыдырайды:
НС00Н->Н 2 О+СО
3. Сілтілік металл тұздарын балқытса қымыздық қышқыл-дың тұздарын түзіп ыдырайды:
/ Н-СООМа С-0№
+ -* Н, + О
/ Н-СОО№ С-ОЫа
Маталарды бояғанда сірке қышқылының орнына құмырсқа қышқылы жұмсалаДы, былғары өндірісінде ашытқы ұраларды дезинфеқциялау үшін консерві, спирт және сыра өндірістерінде қолданылады. Құмырсқа қышқылы катализаторлар жасау үшін де, дәрігерлік жұмыста да және әр түрлі синтездерде де қолда-нылады.
Құмырсқа қышқылы туындыларының арасында соңғы уа-қытта үлкен маңызға ие болғаны диметилформамид
/°
Н-С(
Х ^ (СН 3 ) 3
Бұл қайнау темп. 153° С сұйық зат. Газ қоспаларынан ацети-ленді бөлуде (25° С және әдеттегі қысымда диметилформамидті бір кәлемі ацетиленнің 31, 4 көлемін ерітеді), хлорлы сутекті, 50 2 С0 2 және басқа да газдарды адсорбциялауда таңдағыш (селективті) еріткіш ретінде саналады. Нитрон талшығын өндір-генде диметилформамид еріткіщ ретінде қолданылады (233 бет) . Құмырсқа қышқылының, әдеттегі эфирлерінен басқа, күр-делі зфирлері де бар; олар қышқылдың орго-формасына /ОН
Н-С-ОН сәйкес келеді; мысалы НС(ОС 2 Н5) з-ортоқұ-
х ОН мырсқаэфирі.
СІрке қышқылы СН 3 СООН (сусыр) +16, 6° С кристал-ды массаға айналып, мұз тәрізді болып, қатады; сондықтан он-дай қышқылды сірке муз қышқылы деп атайды. Қышқылдың өзіне тән (сіркелік) еткір иісі бар, сумен кез келген мөлшерде араласады; нормаль қысымда, 118, 5°С ыдырамастан қайнайды. Өнеркәсіптік мөлшерде әр түрлі әдістерімен алынады; олар бұ-рын қарастырылған болатьш; 1) сірке альдегиді арқылы ацети-леннен (102 бет) ; 2) қаныққан көмірсутектерді тотықтырып (62 бет) ; 3) спирт тотыққанда (129 бет) ; 4) ағашты құрғақ айда-ғанда түзілетін смола суынан (117 бет) ; 5) қанты бар ерітінділер сірке-қышқылданып ашығанда (304 бет) ; ё) жүзім шарабы, сы-ра, өеімдік жемістерінің шырындары және т. оі «ашып-шіріген-де». Сірке-қышқылы төменде көрсетілген скема бойынша оксо-синтездік әдісімен де жасалған.
N1
СНзОН+СО>СН 3 -СООН
жоғары қысым
Сірке мұз қышқылы көптеген органикалық заттар үшін та-ғіаша еріткіш болып табылады. Қышқылдың судағы ерітінділері сауда орындарында сірке суы (3-5%-ерітіндісі) деп және сірке эссенциясы (70-80% - ерітіндісі) деп аталады. Мұз және концентрациялы сірке қышқылы теріні қүйдіріп жібереді.
Химиялық жағынан сірке қышқылы да, әдеттегі карбон қыш-
- қылдары сияқты келеді (191 бет) . Сірке қышқылы шыт-мата
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz