Атомдық және ядролық физикадан зертханалық жұмыстардың әдістемелік нұсқаулығы


Жұмыс түрі: Дипломдық жұмыс
Тегін: Антиплагиат
Көлемі: 63 бет
Таңдаулыға:
Кіріспе
Атомдық және ядролық физика қазіргі физиканың ең алдыңғы қатарлы жетістіктерін білдіретін салалардың бірі. Атом және ядролық физиканың күнделікті тұрмыста, технологияда және энергетикадағы үлесі ұлан ғайыр.
Соңғы жылдары өндірістің әртүрлі салаларында: энергетика, транспортта байқалып жүрген прогресс, Республикадағы техникалық білім жүйесінің қалыптасуы, қажетті мамандарды дайындауға гранттардың бөлінуі физикалық білімнің қажеттілігі мен оның сапасына деген сұранысты арттырып отыр. Мектептегі физика курсы оқушыларды тек қана фундаментальды физикалық теориялармен таныстырып қана қоймай, сонымен бірге, қазіргі заманғы өндірістің физикалық негіздерімен де таныстыруы, оқушылардың алған білімдерін практикалық есептерді шығаруда қолдана білу дағдысын қалыптастыруы керек. [1]
Орта мектептің реформасы орта кәсіптік оқу орындарында жоғары квалификацияланған мамандарды, денсаулық сақтау, мәдениет, қызмет көрсету салаларындағы және өндірістің бастапқы буынының жігерлі ұйымдастырушыларын дайындауға үлкен мән беруі керек.
Арнайы орта оқу орындарын бітірушілердің кәсіби дайындық деңгейлерін көтеру және олардың дайындығы жалпы білім беруде өнімді еңбекке негізделген. Сондықтан да физиканы тереңдетіп оқу басқа кәсіптік пәндерді оқып үйренуде өте қажетті.
Соңғы жылдары атомдық және ядролық физика саласындағы қарқынды даму айқын байқалуда және оның келешектегі преспективасы да шапшаң жүргізілмек: атом мен ядроның сыры тереңірек ашылуда; 1954 жылдан бастап атом электр стансалары жер жүзі мемлекеттерінде жыл сайын көбеюде. Бұл атомдық және ядролық физиканың ғылыми-теориялық деңгейін көтереді.
Мектептегі және жоғары оқу орнындағы физика курсындағы эксперимент - бұл физика ғылымына тән, зерттеудің ғылыми методикалық көрінісі. Физикалық экспериментті негізге алып, құбылыстарды оқып үйрену - оқушылардың ғылыми көзқарасының қалыптасуына, физикалық заңдарды неғұрылым тереңірек меңгеруге, мектеп оқушыларының және студенттердің пәнді оқып үйренудегі қызығушылығын арттыруға себін тигізеді.
Әдістемелік жаңалығы. Атомдық және ядролық физика бойынша мектепте оқытылатын оқу материалының көлемі жыл сайын көбейіп, артып келеді. Бұл жағдай оқу материалын қандай дидактикалық принциптер (оңайдан қиын материалға көшіп отыру, теориялық талдау негізінде, өмірмен байланыстылығы тұрғыда, эксперименттік дәлелдеу принципінде . . . ) негізінде баяндауды таңдап алу ісін қиындатуда. Қазіргі мектеп және жоғары оқу орындарында зертханалық жұмыстарға аса көңіл бөле бермейді, жеткілікті құрал - жабдықтар жоқтың қасы, немесе бар құрал - жабдықтарды жеткілікті түрде меңгере алмайды. Бұл жұмыстың әдістемелік жаңалығы бірнеше жаңа зертханалық жұмыстардың әдістемелік нұсқаулары жасалынуы мен онда жұмыс жасау әдістері.
Дипломдық жұмыстың өзектілігі. Атомдың және ядролық физика объекттерін зертханалық жұмыстарсыз жете түсіну мүмкін емес. Сондықтан, бұл дипломдық жұмыста талданған материалдарды барлық жоғары оқу орындарында қолға алынуы тиіс мәселе.
Дипломдық жұмыстың мақсаты мен міндеттері. Атомдық және ядролық физикадағы физикалық құбылыстарды оқушыларға түсіндірудің бір қиыншылығы-олар көзге көрінбейтін, қолмен сезінуге болмайтын құбылыстар. Оларды эксперименттік тұрғыда сабақта түсіндіруге де қажетті демонстрациялық не лабораториялық приборлар жоқтың қасы әрі жасау да оңай емес. Дипломдық жұмысымның мақсаты - жоғары оқу орындарының студенттері және мектеп оқушыларына арналған атомдық және ядролық физикадан зертханалық жұмыстарды іске қосу және нұсқаулықтарын жасау.
Жұмыстың зерттеу объектісі: Атомдық және ядролық физикадан жоғары оқу орындарында және орта мектепте зертханалық жұмыстар.
Дипломдық жұмыстың құрылымы. Дипломдық жұмыстың жалпы кіріспеден, үш тараудан, қорытындыдан, тұрады.
- АТОМ ЖӘНЕ АТОМ ЯДРОСЫ ФИЗИКАСЫНЫҢ ТЕОРИЯЛЫҚ НЕГІЗДЕРІ
1. 1 Атомдық физика
Бор теориясы бойынша сутегі атомы. Атомның Томсон және Резерфорд моделі. Заттың атомдық құрылысы туралы ілім өте ерте кезден пайда болды. Б. э. д. IV-V ғ жасап өткен грек философ ғалымдары Демокрит, Эпикур, Лукреций, Аристотель көзқарастары бойынша зат бөлінбейтін өте ұсақ бөлшектерден құралған (атомос - бөлінбейтін) деді.
XVIII ғасыр басында А. Лавуазье, М. В. Ломоносов, Д. Дальтон еңбектерінде атомның бар екендігі дәлелденді, бірақ оның ішкі құрылысына үңіле қоймады, «атом - бөлінбейтін бөлшек» түсінігімен қалып қойды. Д. И. Менделеевтің 1869 ж жасаған элементтердің периодтық системасы атом құрылысы жайлы мәселені алға қойды. Электронның затта болуы және көптеген тәжірибе нәтижелері XIX ғ соңы XX ғ басында ғалымдар алдына атом құрылысын үйрену мәселесін қойды.
Көптеген тәжірибе нәтижелеріне сүйене отырып, 1903 ж Дж. Томсон атомның алғашқы моделін ұсынды. Бұл модель бойынша атом радиусы 10 -10 м шамасындай үздіксіз оң зарядталған шар болып, өзінің тепе-теңдігі айналасында тербелуші электрондар осы шар ішінде жайласқан. Ондағы оң заряд мөлшері электрондардың теріс зарядына тең, сондықтан атом бейтарап. Бірақ бұл модель шындыққа сай келмеді.
Атом құрылысы туралы ілімнің дамуына ағылшын физигі Э. Резерфордтың
 - бөлшектерінің затта шашырауына бақылау жүргізілген тәжірибесі үлкен үлесін қосты.
- бөлшектерінің затта шашырауына бақылау жүргізілген тәжірибесі үлкен үлесін қосты.
 - бөлшегі радиактив заттардың түрленуі кезінде пайда болатын массасы электрон массасынан 7300 есе үлкен, жылдамдығы ≈10
7
м
/
с
шамалас, заряды 2е оң зарядталған бөлшек. Резерфорд тәжірибесінде қалыңдығы 1
мкм
алтын фальгадан
- бөлшегі радиактив заттардың түрленуі кезінде пайда болатын массасы электрон массасынан 7300 есе үлкен, жылдамдығы ≈10
7
м
/
с
шамалас, заряды 2е оң зарядталған бөлшек. Резерфорд тәжірибесінде қалыңдығы 1
мкм
алтын фальгадан
 - бөлшектерінің өтуін бақылау кезінде
- бөлшектерінің өтуін бақылау кезінде
 - бөлшектерінің көпшілік бөлігі өзінің қозғалыс бағытынан ауытқуын, ал кейбір
- бөлшектерінің көпшілік бөлігі өзінің қозғалыс бағытынан ауытқуын, ал кейбір
 -бөлшек (2-нан біреуі) бағытын 180
0
өзгерткенін бақылады. Тәжірибе нәтижесін Резерфорд былай тұжырымдады, үлкен жылдамдықпен ауыр
-бөлшек (2-нан біреуі) бағытын 180
0
өзгерткенін бақылады. Тәжірибе нәтижесін Резерфорд былай тұжырымдады, үлкен жылдамдықпен ауыр
 -бөлшектің қозғалыс бағытының өзгеруіне электрон әсер ете алмайды, атомдық массасы едәуір үлкен оң зарядтың әсері, ал
-бөлшектің қозғалыс бағытының өзгеруіне электрон әсер ете алмайды, атомдық массасы едәуір үлкен оң зарядтың әсері, ал
 -бөлшектің 180
0
-қа ауытқуы өте сирек кездесуінің себебі, атомдағы оң заряд көлемі атом өлшемімен салыстырғанда өте кішкене.
-бөлшектің 180
0
-қа ауытқуы өте сирек кездесуінің себебі, атомдағы оң заряд көлемі атом өлшемімен салыстырғанда өте кішкене.
Сөйтіп, Резерфорд 1911 ж өз зерттеулерінің нәтижесіне сүйене отырып атомның ядролық (планетарлық) моделін ұсынды. Бұл модель бойынша, атом ядросы өлшемі 10 -15 м , және массасы атом массасына тең, заряды Ζе (Ζ - Менделеев кестесіндегі элемент реттік номері, е - элементар заряд) оң шоғырланған болып, электрон айналып жүреді.
Резерфорд моделі көптеген тәжірибе нәтижелерін түсіндіріп теориямен үйлесе алды. Алайда атомның электромагниттік сәулелену құбылысын Резерфорд моделі түсіндіре алмады. Мысалы, электрон ядроны радиусы r шеңбер бойымен айналып жүрсін. Электрон мен ядро арасындағы тартылыс күші Кулон заңы бойынша
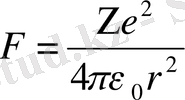
бұл күш электронға центрге тартқыш үдеу береді. Ньютон 2-заңы бойынша
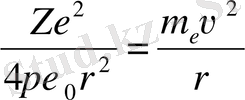 (1. 1)
(1. 1)
бұл жерде
 ,
,
 - электрон массасы және жылдамдығы.
- электрон массасы және жылдамдығы.
Берілген (2. 1) теңдеу радиустың
 мәніне жылдамдықтың осындай мәні сәйкес. Бұл энергияның үздіксіз мәніне сәйкес келеді. Ал шын мәнінде атом спектрі сызықты. Сонымен (2. 1) формуладан
мәніне жылдамдықтың осындай мәні сәйкес. Бұл энергияның үздіксіз мәніне сәйкес келеді. Ал шын мәнінде атом спектрі сызықты. Сонымен (2. 1) формуладан
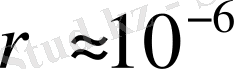 м
болғанда
м
болғанда
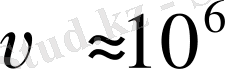 м/с
, а=10
22
м/с
2
болады. Классикалық электродинамика теориясы бойынша үдеумен қозғалған электрон электромагниттік сәулеленуі нәтижесінде энергиясы кемуге тиісті. Сөйтіп электрон ядроға жақындайды да, ақыр аяғында электрон ядроға құлап, атомның өмір сүру уақыты таусылады, бұл шындыққа үйлеспейді. Осындай кемшіліктерді жою үшін - атомның кванттық теориясы жасалды. [2]
м/с
, а=10
22
м/с
2
болады. Классикалық электродинамика теориясы бойынша үдеумен қозғалған электрон электромагниттік сәулеленуі нәтижесінде энергиясы кемуге тиісті. Сөйтіп электрон ядроға жақындайды да, ақыр аяғында электрон ядроға құлап, атомның өмір сүру уақыты таусылады, бұл шындыққа үйлеспейді. Осындай кемшіліктерді жою үшін - атомның кванттық теориясы жасалды. [2]
Сутек атомының сызықты спектрлері . Жеке атомдардың сәулелену спектрлерін үйрену әр түрлі зат атомының шығару спектрі әр түрлі екенін көрсетті. Солардың ішіндегі көп үйренілгені қарпайым атом - сутегі атомының спектрі болды.
Швед ғалымы И. Бальмер сутек атомы спектрлік сызықтарын сипаттайтын эмпирикалық формула алды.
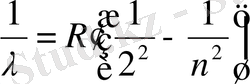 n=3, 4, 5… (1. 2)
n=3, 4, 5… (1. 2)
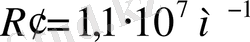
 - Ридберг тұрақтысы.
- Ридберг тұрақтысы.
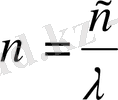 екенін ескерсек, жиілік үшін төмендегі формуланы аламыз.
екенін ескерсек, жиілік үшін төмендегі формуланы аламыз.
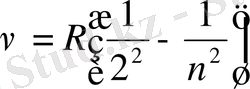 , n=3, 4, 5… (1. 3)
, n=3, 4, 5… (1. 3)
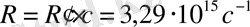
(1. 2), (1. 3) формулалардан λ, ν үшін Бальмер сериясы деп аталатын спектрлік сызықтар жиыны алынды. n мәні артқан сайын спектрлік сызықтар жақындайды;
 серияның шекарасы деп аталады.
серияның шекарасы деп аталады.
XX ғ басында сутегі спектрінде және бірнеше сериялар бар екені анықталды. Спектрдің ультракүлгін аймағындағы сызықтар жмыны Лайман сериясымен анықталады.
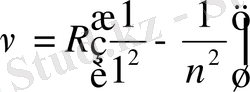 , n=2, 3, 4…
, n=2, 3, 4…
Инфрақызыл бөлігіндегі спектрлер жиыны үшін
Пашен сериясы
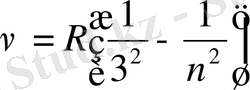 , n=4, 5, 6…
, n=4, 5, 6…
Брэкет сериясы
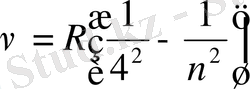 , n=5, 6, 7…
, n=5, 6, 7…
Пфунд сериясы
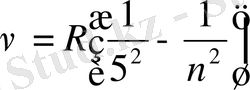 , n=6, 7, 8…
, n=6, 7, 8…
Хемфри сериясы
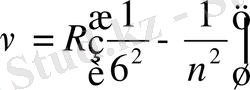 , n=7, 8, 9…
, n=7, 8, 9…
сәйкес келеді.
Жоғарыдағы формулаларды жалпы түрде былай жазуға болады.
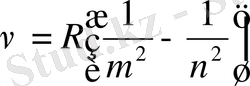
m
- серия түрін анықтап, 1
 6 дейін өзгереді.
6 дейін өзгереді.
n - m +1 мәнін қабылдайды және сол сериядағы сызықтарды анықтайды.
Сілтілі металдар қатарындағы мысалы, Li, Na, K - атомдарының спектрлері күрделі болып, белгілі заңдылыққа түспеді. Ридберг әр қайсысының спектр сызықтарын үш топқа топтады. Әрбір топ Бальмер сериялары бойынша жайласатынын байқады.
Жоғарыда келтірілген эмпирикалық формулалар көпке дейін өзінің теориялық дәлелдемесін таппады, бірақ тәжірибе нәтижелерімен жоғары анықтықпен үйлесе алды. Себебі мұндай заңдылықты классикалық физика түсініктерімен дәлелдеу мүмкін болмады.
Бор постулаттары. Франк және Герц тәжірибесі. Сутегі атомы спектрлерін Бор теориясы бойынша түсіндіру. Алғашқы атомның кванттық теориясын жаратқан ғалымдардың бірі дат ғалымы Нильс Бор болды. Ол өзі жаратқан теорияда атомның ядролық моделін және шығару, жұтылу спектрлерінің кванттық қасиетін байланыстыруды мақсат етті. Бұл теорияның негізінде Н. Бор екі постулатты (1913 ж) ұсынды.
Бордың 1-ші постулаты (стационарлық күй постулаты) : атомда стационар күйлер болып, онда атом энергия шығармайды. Атомның стационар күйінде электронға стационар орбита сәйкес келіп, электрон үдей қозғалса да электромагниттік толқындарын шығармайды. Осы кездегі электронның қозғалыс моментінің импульсі мынадай шартты қанағаттандырады.
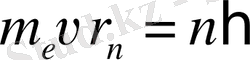 , (n=1, 2, 3, …) (1. 4)
, (n=1, 2, 3, …) (1. 4)
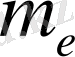 - электрон массасы,
- электрон массасы,
 - радиусы
- радиусы
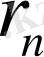 болған орбитадағы жылдамдық,
болған орбитадағы жылдамдық,
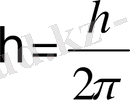 .
.
Бордың екінші постулаты . Электрон бір стационар күйден екінші стационар күйге өткенде энегиясы
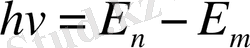 (1. 5)
(1. 5)
тең бір фотон шығарады немесе жұтады.
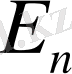 ,
,
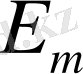 - атомның сәулеленуге дейінгі және кейінгі стационарлық күйлеріне сәйкес келетін энергиялары.
- атомның сәулеленуге дейінгі және кейінгі стационарлық күйлеріне сәйкес келетін энергиялары.
Егер
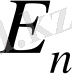 <
<
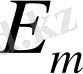 болса, фотон шығарылады, ал
болса, фотон шығарылады, ал
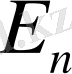 >
>
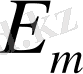 болса, онда жұтылады.
болса, онда жұтылады.
Атомның энергиясы дискрет мәндерге ие екенін Д. Франк және Герц өздерінің тәжірибелерінде баяндады. Тәжірибе үшін қойылған құрылғы схемасы 1. 1 - суретте көрсетілген.
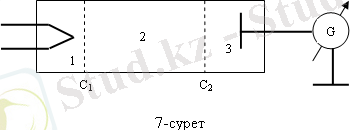
Сурет 1. 1 - Д. Франк және Герц тәжірибесі
Ондағы вакуумдық түтік сынап буымен толтырылған және қысым 13 Па жуық, С 1 , С 2 торлардан, К катодтан және А анодтан тұрады. Термоэлектрондық эмиссия құбылысы нәтижесінде катодтан ұшып шыққан электрон катодпен С 1 арасына қойылған потенциал арқылы үдетіледі. С 2 мен анод арасына онша үлкен емес тежеуші потенциал қойылады (шамамен 0, 5 В ) .
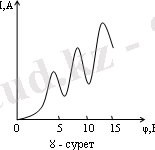
Сурет 1. 2 - Д. Франк және Герц тәжірибесінің нәтижесі
Суреттегі 1 аралықта үдетілген электрон 2 аралықтағы сынап атомдарымен соқтығысады. 3-аралықтағы тежеуші потенциалдан өте алатын электрондар анодқа жетеді. Электронмен серпімсіз соқтығысқан атом қозған күйге өтеді. Бор теориясы бойынша қозған атом белгілі мөлшерде энергия алуы тиіс. Онда эллектрон энергиясы дискрет мәндерге азайып отыруы қажет. Электрон атомға берген энергиясы атомның стационар күйдегі энергияларының өзгерісіне тең. Тәжірибеден (1. 2-сурет) нәтиже алынады, яғни үдетуші потенциал 4, 86 В шамасына жеткенше анод тогы сызықты артып отырады. 4, 86 В болғанда ток І күші күрт төмендеп қайтадан арта түседі. Кейінгі максимумдар 2*4, 86 В және 3*4, 86 В болады.
Демек 4, 86
эВ
энергияға ие болған электрон сынап атомымен соқтығысқанда өзінің толық кинетикалық энергиясын атомға береді де, энергиясы азайған электрон тежеуші потенциалдан өте алмай анодқа жетпейді, осы себептен ток бірден төмендейді. Энергиясы 4, 86
эВ
еселік мәнінде электрон энергиясын толық бергенше 2, 3, . . . рет соқтығысады. Олай болса, атом энергияны белгілі порциямен жұтып, белгілі бір энергетикалық күйде бола алады. Сынап атомы 4, 86
эВ
энергия жұтса, сәулелену арқылы сонша энергия шығаруы қажет. Сәулелену жиілігін Бордың 2-постулаты арқылы есептеуге болады.
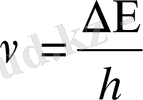 немесе
немесе
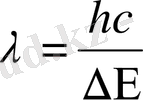
λ≈ 255 нм , бұл сынап буының спектріндегі ультракүлгін сызыққа сәйкес келеді. Мұндай сәйкестік Франк және Герц тәжірибелері Бордың екі постулатының да дұрыстығын дәлелдеді. Бұл атом физикасының дамуына дамуына өзінің үлкен үлесін қосты.
Бор постулаты сутек және сутегіге ұқсас атом (мсыалы, Не
+
, Li
+2
) спектрлерін теориялық жағынан және Ридберг тұрақтысының мәнін анықтауға мүмкіндік берді. Электрон стационар орбитасы үшін жазылған (2. 1) формуласы мен Бор 1-постулатын (1. 4) біріктіріп шешу арқылы
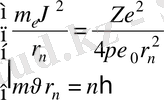
электронның кел келген стационар орбитасының радиусы п - мәнді өрнек аламыз.
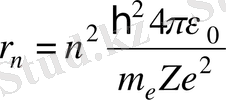 ,
п
=1, 2, . . . (1. 6)
,
п
=1, 2, . . . (1. 6)
(1. 6) формуладан Z =1, n =1 десек, бірінші Бор постулатын аламыз
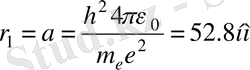 . (1. 7)
. (1. 7)
Электронның стационар орбита бойымен қозғалысы кезіндегі толық энергиясы электронның кинетикалық энергиясы және электростатикалық өрістегі потенциал энергиясы қосындысына тең
 .
.
Бұл жерде жоғарыда келтірілген формуладан
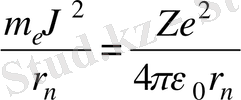 (1. 1)
(1. 1)
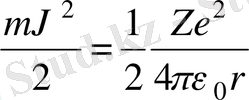 өрнегін есепке алсақ,
өрнегін есепке алсақ,
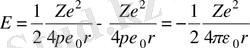
табылған өрнекке (2. 6) мәнін қойсақ
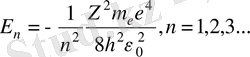 (1. 8)
(1. 8)
яғни электрон энергиясы тек үздікті (дискрет) мәнге ие екені және формуладағы минус таңбасы электрон атомда байланысқан күйде екенін көрсетеді. п - атомның энергетикалық деңгейлерін анықтайды, оны бас кванттық сан деп атайды.
n =1, атомның негізгі күйі
n >1, атомның қозған күйі деп аталады.
Формуладағы
п
үшін түрлі бүтін мәндері үшін түрлі энергетикалық деңгейлерді алуға болады[3] . 1. 3 - суреттегідей диаграмма түрінде кескіндеуге болады. Бас кванттық саны артқан сайын энергетикалық деңгейлердің арасы төменнен жоғары қарай жақындай береді де
п
→
 ұмтылғанда көршілес деңгейлер бірігіп кетеді.
ұмтылғанда көршілес деңгейлер бірігіп кетеді.
n =1 негізгі күйде сутек атомы ең кіші энергиялы ( Е = -13, 55 эВ ) болады. Бұл сан жағынан ионизация энергиясына тең.
Бордың 2-постулаты бойынша
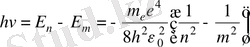
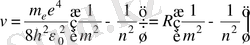 (1. 9)
(1. 9)
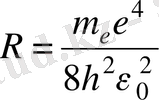 - Ридберг тұрақтысы.
- Ридберг тұрақтысы.
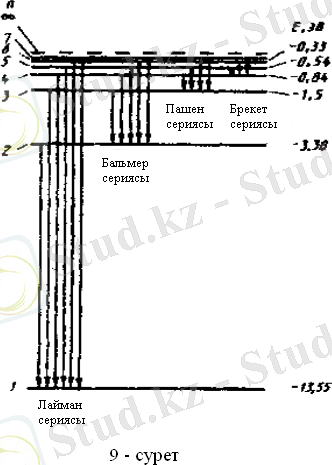
Сурет 1. 3 - атомның энергетикалық деңгейлерінің диаграмма түрінде кескінделуі
Бор постулаттары алдын алынған эмпирикалық формулаларды түсіндіре алды.
Сонымен Бор теориясы атомдық физиканың дамуына және кванттық механика теориясын жасауда үлкен жетістік болды. Дегенмен бұл теорияның да өзіндік кемістіктері болды. Біріншіден, Бор классикалық физика заңдарын қолданды, екіншіден, квант постулаттарына сүйенді. Бор теориясы сутек және оған ұқсас атомдар үшін спектр сызықтарын есептей алды, бірақ спектрлік сызықтардың интенсивтілігін, не үшін өту белгілі деңгейлер арасында болуын түсіндіріп бере алмады. Бор теориясының тағы бір айтарлықтай кемшілігі сутек элементінен кейінгі гелий атомының спектрін түсіндіріп бере алмады.
Сутегі атомындағы электронның 1
s-
күйі. Электрон спині. Спиндік кванттық сан. Сутегі атомындағы электронның 1
s-
күйі сфералық симметриялы, яғни
θ
және
φ
бұрыштарына тәуелді емес. Бұл күйде электронның толқындық
ψ
функциясы электронның ядродан r арақашықтығымен ғана анықталады. Яғни
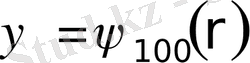 , мұнда
n=
1,
ℓ=
0,
, мұнда
n=
1,
ℓ=
0,
 =0.
=0.
Электронның 1 s- күйі үшін Шредингер теңдеуі мына түрдегі функцияны қанағаттандырады.
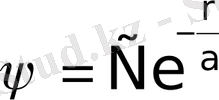 (1. 10)
(1. 10)
мұнда
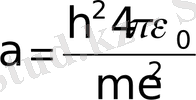 - шамасы сутегі атомы үшін 1-ші Бор радиусымен сәйкес келеді,
С
- ықтималдықтың нормалау шартынан анықталатын кейбір тұрақтылар.
- шамасы сутегі атомы үшін 1-ші Бор радиусымен сәйкес келеді,
С
- ықтималдықтың нормалау шартынан анықталатын кейбір тұрақтылар.
ψ
функцияның сфералық симметриясы арқасында кез-келген бағыттағы
r
арақашықтықтағы электронның болу ықтималдығы бірдей. Сондықтан ықтималдық тығыздықтың бірдей болуына жауапты көлем элементі
dV
әдетте радиусы
r
және қалыңдығы
dr
болатын сфералық қабықтың көлемі:
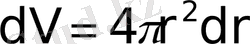 ретінде көрініс табады. Онда (1. 10) -ды ескере отырып ықтималдықтың нормалау шртына сәйкес мына теңдеуді аламыз.
ретінде көрініс табады. Онда (1. 10) -ды ескере отырып ықтималдықтың нормалау шртына сәйкес мына теңдеуді аламыз.
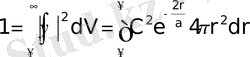
Бұл теңдікті интегралдасақ мынау шығады:
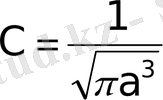 (1. 11)
(1. 11)
(4. 11) теңдеуін (4. 10) формулаға қойып, сутегі атомындағы электронның 1 s- күйі үшін нормаланған толқындық функцияны анықтаймыз:
Көлем элементінде электронның болу ықтималдығы мынадай:
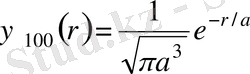 (1. 12)
(1. 12)
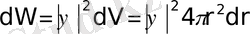
Осы формуланы (1. 4) -ге қойсақ мынау шығады.
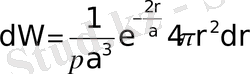 (1. 13)
(1. 13)
Электронның ядродан ең жоғары ықтималдықпен табылатын r max қашықтықты анықтайық. dW/dr қатысын зерттей келе, r max = a аламыз. Бұдан электрон жоғары ықтималдықпен бор радиусына тең арақашықтықта табыла алады. Яғни атом ядросы центрімен сфераның а радиусында орналасқан барлық нүктелерде электронның табылу ықтималдығына тең немесе одан жоғары. Кванттық механикалық есеп Бор теориясымен сәйкес келген болар еді. Бірақ кванттық механикада ықтималдық тығыздық r = a болғанда ғана өзінің максимумына жетеді (1. 4-сурет) . Осыдан сутегі атомының негізгі күйінде электронның ядроға дейінгі ең ықтималды арақашықтық Бор радиусына тең болады.
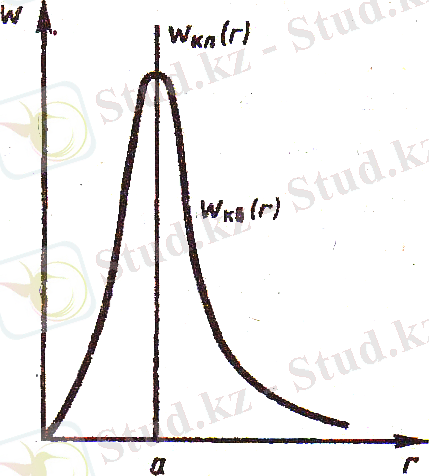
Сурет 1. 4 - Ықтималдық тығыздық r = a болғандағы қашықтық
Электрон спині. Спиндік кванттық сан. Неміс физиктері О. Штерн және В. Герлах магниттік моментке тікелей өтулер жүргізіп, 1922 ж s- күйдегі сутегі таомының жіңішке шоғы біртексіз магнит өрісінде екі шоққа ыдырайтынын анықтады. Бұл күйде электронның импульс моменті нөлге тең. Электронның орбиталдық қозғалысымен байланысты болған атомның магнит моменті механикалық моментке пропорционал, сондықтан ол нөлге тең және негізгікүйдегі сутегі атомының қозғалысына магнит өрісі әсер етпеуі тиіс. Яғни ыдырау процесі жүрмеуі керек. Бірақ кейінірек жоғары дәлдікті спектрлік приборларды қолдану арқылы сутегі атомы спектрлік сызықтары магнит өрісі болмаған кезде де нәзік құрылымға (яғни дублет) ие екені дәлелденген.
Спектрлік сызықтардың нәзік құрылымына және атомдық физикадағы бірқатар қиындықтарға түсініктеме беру үшін американ физиктері Д. Уленбек (1900-1974) және С. Гаудсмит (1902-1979 ж) тыныштық күйдегі электрон механикалық импульс моментіне ие деген тұжырымға келді. Ол механикалық импульс моменті спин деп аталады. [4]
Электрон (және басқа микробөлшектер) спині - кванттық шама.
Егер электронға меншікті механикалық импульс моменті (спин)
 тән болса, онда оған меншікті магнит моменті
тән болса, онда оған меншікті магнит моменті
 сәйкес келеді. Кванттық механика тұжырымына сәйкес спин моменті мына заң бойынша
сәйкес келеді. Кванттық механика тұжырымына сәйкес спин моменті мына заң бойынша
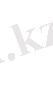
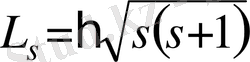 квантталады. Мұнда
s -
спиндік кванттық сан. Спин моментінің
квантталады. Мұнда
s -
спиндік кванттық сан. Спин моментінің
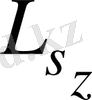 проекциясы да
проекциясы да
 векторы 2
s+
1 бағыттарын қабылдайтындай болып квантталады. Штерн және Герлах тәжірибелерінде тек екі бағыт қана бақыланды, 2
s+
1=2, одан
s=1/2
. Сыртқы магнит өрісіне бағытталған спин проекциясы кванттық шама ретінде былай анықталады:
векторы 2
s+
1 бағыттарын қабылдайтындай болып квантталады. Штерн және Герлах тәжірибелерінде тек екі бағыт қана бақыланды, 2
s+
1=2, одан
s=1/2
. Сыртқы магнит өрісіне бағытталған спин проекциясы кванттық шама ретінде былай анықталады:
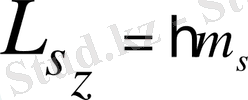 , мұнда
, мұнда
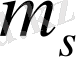 - берілген бағытта спин проекциясын анықтайтын магниттік кванттық сан. Ол тек қана бір мәнді
- берілген бағытта спин проекциясын анықтайтын магниттік кванттық сан. Ол тек қана бір мәнді
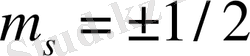 қабылдай алады.
қабылдай алады.
Осыдан тәжірибелер нәтижелері қосымша ішкі еркіндік дәрежелі электрондарды сипаттау керектігіне алып келді. Сондықтан атомдағы электронның күйін толық сипаттау үшін бас кванттық, орбиталдық, магниттік кванттық сандармен қатар магниттік спиндік санды енгіземіз.
Паули принципі. Атомда электрондардың күй бойынша орналасуы. Егер тепе-тең бөлшектер бірдей кваттық санға ие болса, онда олардың толқындық функциясы бөлшектердің орын ауыстыруына симметриялы. Бұдан бір жүйеге енетін екі бірдей фермиондар бірдей күйлерде бола алмайтыны келе шығады. Ал, фермиондар үшін толқындық функция антисимметриялы болуы керек еді. Тәжірибе нәтижелерін қорытындылай келе В. Паули табиғатта фермиондар толқындық функциялары антисимметриялы болған күйлерде ғана болады деген принцип ұсынды.
Бұдан Паулидің: жүйеде бірдей екі фермион бір мезетте бір күйде бола алмайды деген принципі келіп шығады. Оның бұл принципі кванттық механиканың негізі қаланбағанға дейін шыққан еді. Бірдей бозондардың бір күйде болу саны шектелмеген.
Атомдағы электронның күйін төрт кванттық сан белгілейді:
n -бос кванттық сан ( n =1, 2, 3, …),
ℓ -орбиталдық кванттық сан ( ℓ =0, 1, 2, …. N -1),
m l -магниттіқ кванттық сан ( m l =- l , …-1, 0, +1, …+ ℓ ),
m s -магниттік спиндік сан ( m s =+1/2, -1/2) .
Атомда электронның таралуы Паули принципіне бағынады: атомда төрт кванттық сандары бірдей болған бір ғана электрон бола алады. Яғни z( n, l, m l , m s ) =0 немесе 1, мұнда z( n, l, m l , m s ) -электрондар саны. Осыдан Паули принципіне сәйкес екі электрон ең болмағанда бір кванттық сан бойынша ажыратылады.
(1. 8) формулаға сәйкес берілген n санға l және m l мәндерімен айырмашылықтары бар n 2 әртүрлі күйлер сәйкес келеді. Кванттық m s саны тек екі мәнді (±1/2) қабылдай алады. Сондықтан берілген бас кванттық санымен анықталатын күйдегі электрондардың жалпы саны мынаған тең:
Z(
n
) =
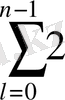 (2
l
+1) =2
n
2
(1. 14)
(2
l
+1) =2
n
2
(1. 14)
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz